Un inhibiteur IL-17 établi de longue date dans le traitement du psoriasis en plaques modéré et sévère est désormais disponible sans citrate.1,§ Grâce à la nouvelle formulation, la douleur au site d’injection est significativement réduite.2 Important pour les dérmatologues: Dans la pratique rien d’autre ne change.
Profil de sécurité et de tolérance bien établi3,4
La nouvelle formulation de Taltz® renonce au citrate comme régulateur d’acidité pour le traitement des patients atteints de psoriasis.2 La concentration du principe actif reste inchangé. Dans l’étude de bioéquivalence, aucunes différences pharmacodynamiques significatives n’a été démontrées par rapport à la formulation originale.2

- Bioéquivalence démontrée avec la formulation originale2,a
- Profil de sécurité identique: pas de nouveaux signaux identifiés2,b
Moins de douleurs au site d’injection2
Pour les patients traités qui ressentaient des douleurs pendant ou après l’injection, l’utilisation sera moins douloureuse. Lors de l’étude de la formulation sans citrate, les patients rappportaient en effet une diminution de la douleur pendant l’injection (Image 1).2
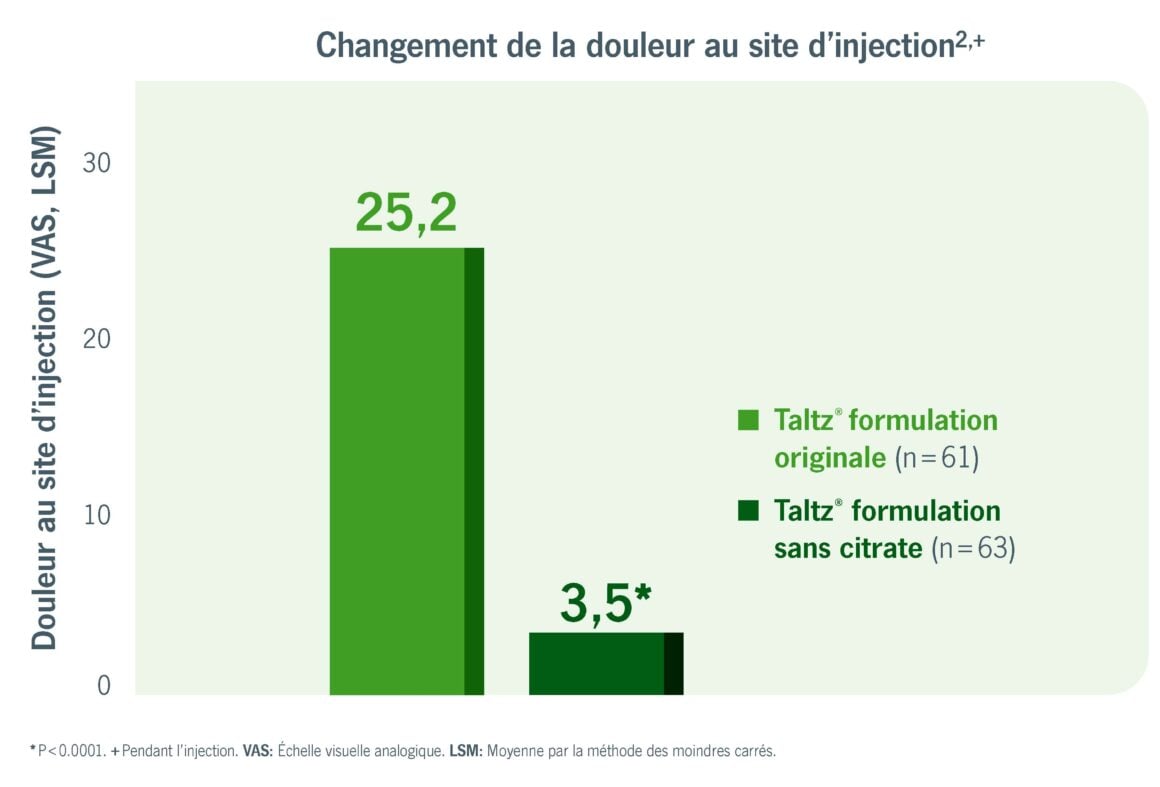
VS. BASELINE, ÉCHELLE VISUELLE ANALOGIQUE VAS) . MODIFIÉ SELON chabra et al., 20222
Pour vous, dans la pratique, cela signifie:
- Principe actif identique et bioéquivalence démontrée avec la formulation originale2,a
- Profil d’efficacité et de sécurité consistant2-4
- Forme pharmaceutique, schéma posologique et durée de conservation inchangés1
Efficacité3 et tolérance4 démontrées dans les études cliniques à long terme
Lors du choix du traitement, les patients traités accordent de l’importance à la perspective d’un succès thérapeutique à long terme.3 L’ étude clinique à long terme de Taltz (Ixekizumab) confirme : une efficacité durable sur 5 ans et un bon profil de tolérance.2-4
Un engagement constant en dermatologie
Avec la formulation sans citrate,2 Lilly poursuit son engagement dans le domaine de la dermatologie et permet aux patients atteints de psoriasis d’envisager une expérience améliorée avec Taltz® – avec une efficacité3 et une tolérance démontrées.4
§ Taltz® est indiqué dans le traitement du psoriasis en plaques modéré à sévère chez les patients adultes, qui n’ont pas répondu à d’autres traitements systémiques (y compris la ciclosporine ou le méthotrexate ou la puvathérapie) ou qui ne peuvent pas les suivre en raison de contre-indications ou d’intolérance.1
a Les résultats de l’étude de bioéquivalence ouverte (étude -ID:I1F-MC-RHCU) ont montré la bioéquivalence entre la formulation sans citrate et la formulation originale avec un intervalle de confiance à 90% du rapport des moyennes par la méthode des moindres carrés pour la pharmacocinétique et le Tmax étaient compris entre 0,8 et 1,25. Il n’y a pas eu de différence statistiquement significative dans l’exposition à l’Ixekizumab sur la base de la pharmacocinétique.2
bÀ l’exception d’une moindre douleur au site d’injection avec la formulation sans citrate, le profil de sécurité de l’Ixekizumab est consistant dans les deux formulations.2
Les spécialistes de la santé peuvent demander les références auprès de l’entreprise en tout temps.
Références:
- L’information professionelle de Taltz®: www.swissmedicinfo.ch.
- Chabra S et al. Ixekizumab Citrate-Free Formulation: Results from Two Clinical Trials. Advances in Therapy. 2022;39(6):2862-2872.
- Blauvelt A et al. Long-term efficacy and safety of ixekizumab: A 5-year analysis of the UNCOVER-3 randomized controlled trial. Journal of the American Academy of Dermatology. 2021;85(2):360-368.
- Genovese MC et al. Safety of ixekizumab in adult patients with plaque psoriasis, psoriatic arthritis and axial spondyloarthritis: data from 21 clinical trials. Rheumatology (Oxford, England). 2020;59(12):3834-3844.
Origine de l’image: © istock.com/ GooMmnutt
Publication au nom de Eli Lilly (Suisse) S.A. 16, Ch. Des Coquelicots, CH-1214 Vernier – Geneva
Cliquez ici pour accéder à l’information professionnelle de Taltz®
PP-IX-CH-1043/03.2024