Étude de cas présentée par le Dr méd. Alexander R. Siebenhüner, privat-docent
Clinique d’hématologie et d’oncologie, Hirslanden, Zurich
Informations concernant le patient
Patient : né en 1977 (45 ans au moment du diagnostic)
Diagnostic : 08/2023 : tumeur colorectale métastatique T4 + 2 métastases hépatiques ; microsatellites stables, HER2 négative, KRAS, NRAS et BRAF de type sauvage, exprimant l’EGFR
Diagnostic secondaire : arthrite auto-limitante de l’articulation sacro-iliaque.
Traitement :
10/2023 : 6 cycles de cétuximab (Erbitux®) + FOLFIRI
01/2024 : après une bonne réponse au traitement, résection antérieure du rectum par laparoscopie avec résection atypique des métastases hépatiques + cholécystectomie
03/2024 : début de 6 cycles de cétuximab + FOLFIRI supplémentaires
Anamnèse
Le patient a consulté son généraliste en juin 2023 pour des douleurs abdominales basses, des douleurs au flanc droit, une fatigue et des selles irrégulières. L’examen clinique et les valeurs sanguines ne présentaient pas d’anomalies. Environ huit semaines après cette consultation, il a présenté des douleurs croissantes et une sensation de pression surtout dans la partie basse de l’abdomen ainsi qu’un abattement, mais il n’a pas rapporté de présence de sang dans les selles. Le patient a convenu avec son médecin généraliste de la réalisation d’une coloscopie.
Diagnostic
La coloscopie a montré une tumeur peu sténosante du côlon, au niveau de la jonction colorectale entre le sigmoïde et le côlon, localisée à environ 12 cm de l’anus. La tumeur avait déjà envahi la lumière, mais s’était propagée localement et il était possible de traverser. La surface tumorale s’étendait sur près de 4 cm et la biopsie a permis de confirmer qu’il s’agissait d’un adénocarcinome de bas grade. L’analyse moléculaire a révélé une tumeur à microsatellites stables, HER2 négative, présentant les gènes KRAS et NRAS et BRAF de type sauvage et exprimant l’EGFR. Au début du mois de septembre, le patient a été adressé au Dr Siebenhüner. Après concertation au sein de l’équipe pluridisciplinaire, une stadification a été effectuée sur la base d’un examen TEP-TDM (Illustration 1A). Outre une tumeur métaboliquement active au niveau de la jonction colorectale, celui-ci a révélé deux métastases hépatiques métaboliquement actives ainsi que des métastases des ganglions lymphatiques loco-régionales dans la région voisine du rectosigmoïde, en rétro-péritonéal et le long de la V. mesenterica inferior. Aucune métastase osseuse ou pulmonaire n’a été observée. Au vu de l’aspect clinique, la valeur du CEA était basse, avec 10,5 µg/l (valeur normale : < 5 µg/l). Le diagnostic a été complété à l’aide d’une IRM, mais aucune autre métastase n’a été identifiée.
Traitement et évolution
En raison du contexte global, il a été décidé, dans le cadre d’une réunion de concertation pluridisciplinaire (tumor board), de commencer par une chimiothérapie (ChT) et de planifier une résection en cas de réponse au traitement. En raison de la présence de gènes RAS de type sauvage, on a opté pour le cétuximab (Erbitux®) et l’association FOLFIRI (acide folinique/5-fluorouracile/ irinotécan) [1]. Début octobre, le traitement a débuté par 6 cycles de l’association cétuximab-FOLFIRI. Au cours du traitement, une réaction cutanée naso-labiale (de grade 1) est survenue, ainsi que des toxicités hématologiques (de grade 1), sans que cela n’ait toutefois d’influence sur la posologie du traitement. La réaction cutanée a pu être bien contrôlée au moyen de soins cutanés adaptés et de l’application topique d’un traitement antibiotique au long cours à base de doxycycline; les effets indésirables n’ont quant à eux pas induit de modification ou de changement dans les cycles de traitement prévus. Le patient a très bien répondu au traitement (Illustration 1B), si bien qu’une résection antérieure du rectum par laparoscopie a pu être effectuée en janvier 2024, de même que la résection de deux métastases hépatiques situées dans les segments II et V. Une cholécystectomie a également été réalisée, afin de prévenir toute cholécystite post-opératoire. Après l’opération, la pièce opératoire présentait une tumeur ypT3 ypN2b, avec une atteinte de 16 ganglions lymphatiques sur 41, et avec un statut R0 et Pn1L1V1. Il a été décidé en réunion de concertation pluridisciplinaire, dans cette situation sans tumeur, de terminer les douze cycles de ChT, en réalisant donc encore six cycles supplémentaires de traitement par l’association cétuximab + FOLFIRI [1]. Ce traitement a été débuté en mars 2024 après une phase de récupération post-opératoire de deux mois et la situation sera à nouveau évaluée par imagerie au terme des six cycles. Dans l’hypothèse d’une situation sans tumeur, un suivi sera élaboré selon les directives de la SSG [2].
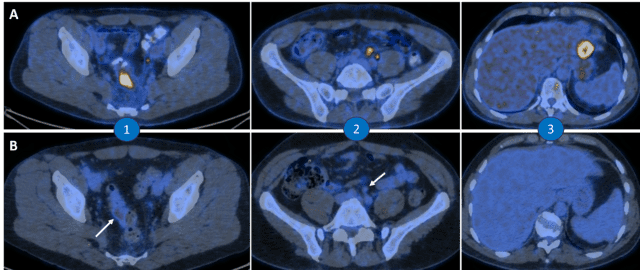
Illustration 1) TEP/TDM de l’abdomen (coupes transversales) A) Imagerie du 6 octobre 2023 : tumeur primitive du côlon (1) ainsi que métastases des ganglions lymphatiques (2) et métastases hépatiques (3). B) Contrôle de suivi du 8 janvier 2024 : rémission presque complète de la tumeur primitive (1) et des métastases (2+3) sous cétuximab. © A.R. Siebenhüner
Commentaires du Dr méd. Alexander R. Siebenhüner, privat-docent
Clinique d’hématologie et d’oncologie, Hirslanden, Zurich

Ce que je trouve passionnant dans ce cas, c’est que nous ne prescrivons habituellement pas un traitement séquentiel purement palliatif dans toutes les situations T4. Les directives de l’ESMO permettent une chirurgie localisée ainsi qu’une chirurgie des métastases, lors d’une réévaluation de la situation T4 [3]. Pour moi, il s’agit là d’un parfait exemple du type de cas dont l’on discute de manière répétée en réunion de concertation pluridisciplinaire afin de donner des opportunités thérapeutiques au patient. Il est important de discuter à plusieurs reprises de la progression du traitement et des mesures appropriées à adopter lors de la réunion de concertation pluridisciplinaire, dans le but d’évaluer les traitements potentiels conformes aux directives, qu’il s’agisse de l’indication de l’utilisation du médicament ou du processus chirurgical.
La question de l’ADN tumoral circulant fait actuellement l’objet de vifs débats dans de tels cas, et il existe déjà des données concernant le gène RAS de type sauvage. Une telle analyse n’est malheureusement pas autorisée à ce jour en Suisse. C’est la raison pour laquelle je n’ai pas pu la proposer au patient en dehors d’un programme scientifique. Dans le contexte de cette présentation de cas, j’aimerais également signaler qu’une telle analyse permettrait également d’améliorer le suivi. En cas d’augmentation des valeurs mesurées au niveau de l’ADN tumoral circulant, on pourrait éventuellement savoir plus rapidement si l’absence de tumeur est maintenue ou si le patient présente une récidive. Il serait alors possible de recommencer le traitement à temps.
Abréviations :
BRAF = B-Raf proto-oncogene; CEA = antigène carcinoembryonnaire; TDM = tomodensitométrie; ECOG-PS = Eastern Cooperative Oncology Group Performance Status; ESMO = European Society of Medical Oncology; EGFR = récepteur du facteur de croissance épithéliale; HER2 = récepteur du facteur de croissance épidermique humain 2; NRAS = Neuroblastoma RAS viral oncogene homolog; TEP = tomographie par émission de positons; (K)RAS = (Kirsten) rat sarcoma virus.
Information professionnelle abrégée d’ERBITUX®.
CH-ERB-00081 07/2024
Avec le soutien financier de Merck (Schweiz) AG.
Références
1. Information professionnelle d’ERBITUX® (cétuximab), www.swissmedicinfo.ch, état actuel.
2. Recommandations consensuelles de la Société suisse de gastroentérologie (SSG).
https://sggssg.ch/fileadmin/user_upload/smf-02496.pdf; dernière consultation: 04/2024.
3. Cervantes, A., et al., Metastatic colorectal cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol, 2023. 34(1): p. 10-32.
Les références sont disponibles sur demande.











