Les patients atteints de diabète sucré et d’obésité présentent un risque élevé de développer des maladies cardiovasculaires telles que l’infarctus du myocarde, l’accident vasculaire cérébral et l’insuffisance cardiaque. Une gestion interdisciplinaire du patient à risque cardiométabolique aborde donc la réduction du risque cardiovasculaire chez les patients atteints d’IRC, fait le point sur le traitement de l’insuffisance cardiaque et se concentre en détail sur la stéatose hépatique et son importance en tant que marqueur de risque ou cible pour les interventions thérapeutiques visant à réduire le risque cardiovasculaire.
La maladie rénale chronique (MRC) a évolué de manière négative au cours des dernières décennies en termes de mortalité. De la 24e place des causes principales, l’IRC est actuellement à la 16e place – avec une tendance estimée à la 5e place en 2040. “Le pronostic cardio-rénal sera donc à l’avenir le facteur décisif pour la probabilité de survie”, a rapporté le professeur Roland Schmieder, Erlangen (D). Le risque cardiovasculaire de l’IRC est établi sur la base de l’albuminurie et du débit de filtration glomérulaire (DFGe) par dosage de la créatinine sérique. Ces deux facteurs sont des prédicteurs de la mortalité cardiovasculaire et de la mortalité totale. Chez les patients atteints de diabète de type 2, il existe une mortalité excédentaire accrue lorsqu’une maladie rénale s’y ajoute (4,1% vs 47% après 10 ans). Selon les lignes directrices du KIDIGO, la gestion du traitement chez les patients atteints de diabète et d’IRC devrait donc réduire à la fois le risque de progression de l’IRC et celui de maladies cardiovasculaires. Pour cela, il est recommandé d’avoir un taux d’HbA1c compris entre 6,5% et 8,0% et une pression artérielle <140/80 mmHg. Pour cela, le blocage du système RAS s’est établi. Plusieurs études ont démontré une cardioprotection ainsi qu’une néphroprotection spécifique. Le traitement RAS doit être poursuivi même si le DFGe <30 mL/min/1,73m2, comme l’a démontré une étude récente.
Dans un second temps, les inhibiteurs du SGLT2 peuvent également améliorer le pronostic cardio-rénal. Entre-temps, plusieurs études ont non seulement montré que le risque de décès cardiovasculaire pouvait être réduit chez les patients atteints de diabète de type 2, mais aussi qu’une néphroprotection avait lieu indépendamment du statut du diabète. Plus récemment, une analyse exploratoire groupée pré-spécifique a montré que Finerenon, comparé à un placebo, réduisait de 14% le risque de mortalité cardiovasculaire et de 23% le risque de progression de l’IRC chez des patients diabétiques de type 2 et atteints d’IRC de stade 1 à 4, présentant une albuminurie modérée à sévère, une pression artérielle et une HbA1c bien contrôlées, sans HFrEF symptomatique et traités par des inhibiteurs du RAS optimisés.
Nouvelles approches dans le traitement de l’insuffisance cardiaque
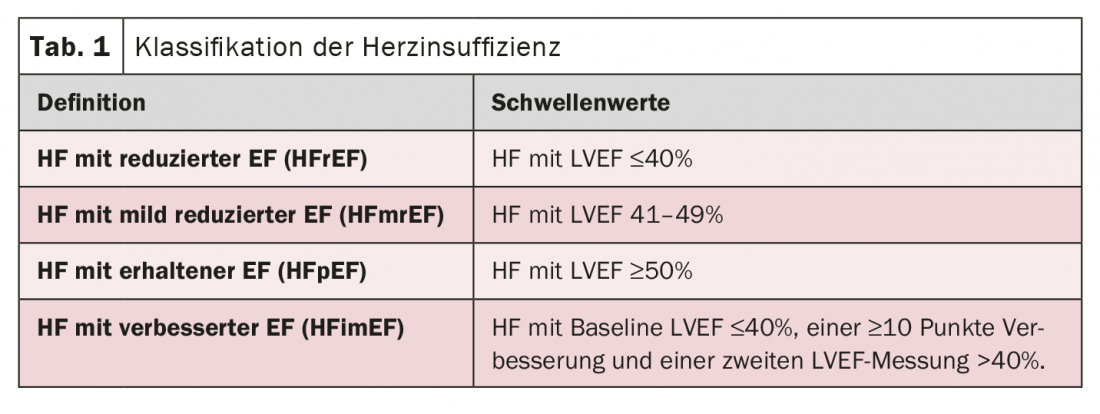
L’année dernière, la prise en charge thérapeutique de l’insuffisance cardiaque (IC) a connu de nombreux changements, a expliqué le Dr Katharina Schütt, PD, Aix-la-Chapelle (Allemagne). Avant tout, une nouvelle définition universelle de l’insuffisance cardiaque a été établie. Selon cette étude, toute personne présentant des symptômes ou des signes d’insuffisance cardiaque, ainsi qu’une élévation du Nt proBNP ou des signes de congestion cardiaque, est atteinte d’insuffisance cardiaque. La FC est classée en fonction de la fraction d’éjection du ventricule gauche (FEVG) (tableau 1) .
Avec la nouvelle ligne directrice de l’ESC, les patients HFrEF ne seront désormais plus traités selon un schéma par étapes. Au contraire, les quatre groupes de substances (IEC/ARNI, bêtabloquants, ARM et inhibiteurs du SGLT-2) doivent être utilisés de manière égale et combinée. Le groupe de patients HFmrEF est très hétérogène. Cependant, ils ressemblent souvent aux patients HFrEF. Dans ce cas, les diurétiques sont généralement recommandés comme traitement. Cependant, étant donné qu’il existe également un bénéfice potentiel de la gestion du traitement des patients HFrEF pour les patients HFmrEF, cette approche peut également être envisagée. Les patients dont la fonction de pompe est préservée (HFpEF) doivent être conscients que leur risque de mortalité est aussi élevé que celui des patients HFrEF, a averti l’experte. Cependant, jusqu’à présent, aucune donnée convaincante n’a pu être recueillie concernant une réduction de la morbidité et de la mortalité. Dans cette clientèle, l’accent est donc mis sur la gestion des comorbidités. Seuls les résultats de l’étude EMPEROR-Preserved permettent d’espérer. L’empagliflozine a été la première molécule à réduire de 21% le critère principal de décès cardiovasculaire chez les patients atteints d’HFmrEF et d’HFpEF. Le risque d’hospitalisation en raison de l’HF a également été réduit de 27%. Dans le même temps, la fonction rénale a été stabilisée.
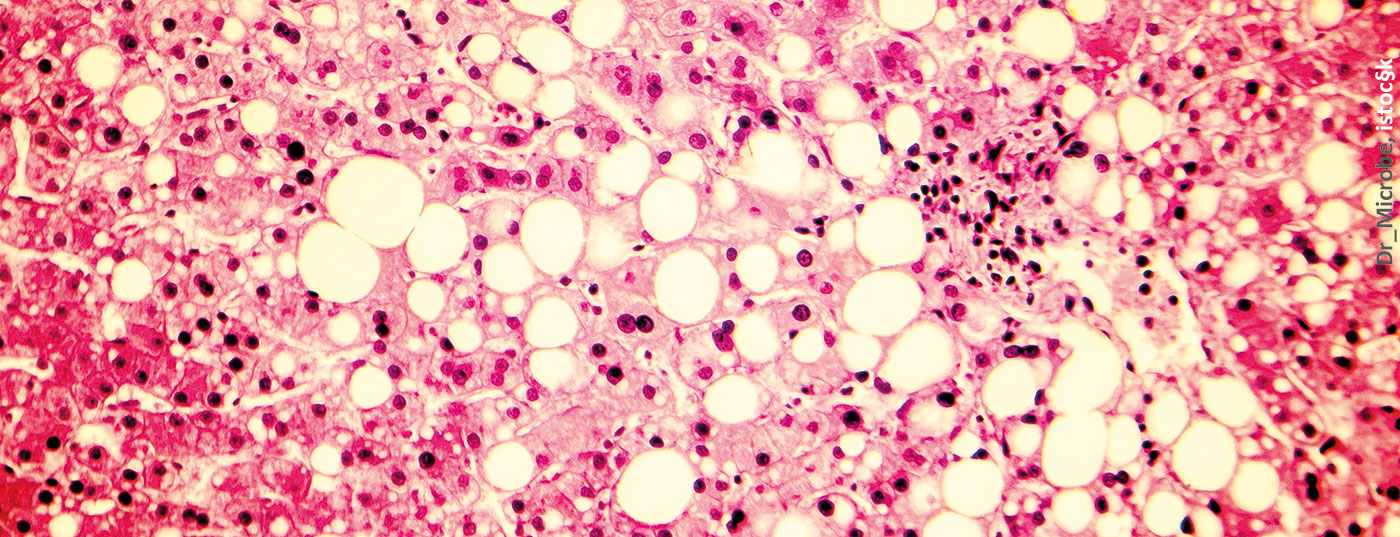
Marqueur de risque de la stéatose hépatique ?
Le Dr Sabine Kahl, Düsseldorf (D), s’est penchée sur le troisième complexe, le foie gras. On parle de stéatose hépatique non alcoolique (NAFLD) lorsque la teneur en graisse du foie est ≥5,56% et que le pourcentage d’hépatocytes avec dépôt de lipides >5% et que d’autres maladies peuvent être exclues. On estime qu’environ 25% de la population mondiale est touchée par cette maladie. Or, la NAFLD est étroitement associée au diabète de type 2. Ainsi, 70 à 80% des patients diabétiques présentent également une NAFLD – avec un risque accru de progression vers la fibrose, la cirrhose ou le cancer du foie. En outre, la NAFLD est également un facteur de risque pour les complications liées au diabète, telles que les maladies cardiovasculaires, l’IRC ou la rétinopathie. En effet, les principales causes de décès chez les patients NAFLD sont les maladies cardiovasculaires (43%), les tumeurs malignes extra-hépatiques (19%), le cancer du foie (5%) et la cirrhose (4%).
Il n’existe pas encore de médicament autorisé pour l’indication de la stéatose hépatique. Les approches thérapeutiques chez les personnes atteintes de NAFLD, de diabète de type 2 et d’obésité comprennent des interventions sur le mode de vie, une pharmacothérapie et une chirurgie métabolique. Il convient de viser une perte de poids de 5 à 10 % du poids corporel. Or, les interventions sur le mode de vie n’y parviennent que pour 10% des personnes concernées, selon l’experte. Il n’existe actuellement aucune intervention pharmacologique. De nombreux médicaments ont échoué en phase III d’essais cliniques. Dans le domaine du diabète, on peut heureusement essayer d’agir également sur la NAFLD par le biais de la médication antidiabétique. Dans la NASH, la pioglitazone, le liraglutide et le semaglutide ont permis d’améliorer l’histologie, mais pas le stade de fibrose. Les inhibiteurs de SGLT2 ont également été étudiés pour leur utilisation dans la NAFLD. Ils ont montré de bons effets sur la teneur en graisse du foie. On se demande si une combinaison de SGLT2i et de GLP-1-RA pourrait avoir des effets synergiques sur la glycémie, la perte de poids, le risque cardiovasculaire, le risque de MCN et la NAFLD.
L’experte a résumé que la NAFLD n’est pas seulement un marqueur de risque, mais qu’elle doit également faire l’objet d’un traitement ciblé. La base du traitement reste actuellement la modification du mode de vie en vue d’une perte de poids. L’administration combinée de GLP-1-RA et de SGLT2i pourrait constituer à l’avenir une stratégie thérapeutique efficace chez les patients souffrant d’un diabète de type 2 supplémentaire.
Source : Prise en charge interdisciplinaire du patient à risque cardio-métabolique – Mise à jour 2022. 27.05.2022, 16:00-17:30, salle 8
Congrès : 56e réunion annuelle de l’Association allemande du diabète (DDG)
CARDIOVASC 2022 ; 21(2) : 32-33