La BPCO est considérée comme une maladie évitable et traitable, mais ce n’est que partiellement vrai. La cigarette est le facteur de risque le plus souvent identifié et évitable dans notre pays – mais dans de nombreuses cohortes de patients, y compris en Suisse, on trouve un tiers ou même plus de non-fumeurs [1]. Les facteurs professionnels et environnementaux peuvent jouer un rôle. Le diagnostic de BPCO repose sur l’obstruction des voies respiratoires, définie comme un rapport (après bronchodilatation médicamenteuse) VEMS/CVF inférieur à 0,7 [2]. Bien que cette limite ait été remise en question et remplacée par des limites inférieures de la normale en fonction de l’âge (LLN, “lower limits of normal”), elle reste valable. L’article suivant donne un aperçu actuel du diagnostic et du traitement de la BPCO.
On estime que la BPCO touche 330 millions de personnes dans le monde et que seul un quart d’entre elles sont diagnostiquées. D’ici 2020, les épidémiologistes prévoient que la BPCO sera la troisième maladie la plus mortelle dans les pays occidentaux [3]. Une stratégie globale pour le diagnostic, la gestion et la prévention de la BPCO peut également être consultée dans le GOLD Executive Summary [4].
Diagnostic et évaluation
Antécédents, clinique et spirométrie en cabinet : les symptômes typiques sont la dyspnée, la toux chronique et la production de crachats. Il est souvent recommandé de réaliser une spirométrie au cabinet médical chez les patients de plus de 40 ans présentant un risque élevé, avec ou sans symptômes [5]. Celle-ci est simple et permet de diagnostiquer la BPCO et de la classer selon les degrés de gravité I à IV (légère, modérée, sévère et très sévère), comme l’a recommandé en 2001 le comité de l’Initiative mondiale pour la maladie pulmonaire obstructive chronique (GOLD) dans son premier rapport de consensus. Il n’existe à ce jour aucune base pour un dépistage généralisé.
La stratégie GOLD actuelle : au cours des années suivantes, il est apparu que l’obstruction des voies respiratoires n’était que partiellement corrélée à différents problèmes de santé et conséquences pour les patients, et qu’une approche plus globale était nécessaire pour détecter différents phénotypes [6].
Bien qu’une toute nouvelle orientation d’un système de classification en vigueur depuis quelques années seulement ne soit pas facile à communiquer, la catégorisation en quatre groupes de risque (A, B, C, D) présente également des avantages évidents : La classification reste basée sur la sévérité de l’obstruction, mais la gravité des symptômes et la fréquence des exacerbations sont désormais prises en compte. Ainsi, le taux de mortalité le plus faible se trouve dans la catégorie A, le plus élevé dans la catégorie D et un taux comparable dans les catégories B et C. C’est également le cas pour la fréquence des hospitalisations, mais les exacerbations augmentent de manière continue de A à D. Les patients qui souffrent d’exacerbations sont plus souvent hospitalisés que les autres. Les comorbidités sont (sans surprise) plus fréquentes dans les catégories B et D, plus symptomatiques. Cette classification actuelle ne sera pas non plus parfaite, car les patients atteints de BPCO se manifestent de manière trop hétérogène, par exemple avec ou sans emphysème concomitant, avec différents modèles d’inflammation, des troubles des échanges gazeux, des résultats supplémentaires détectables radiologiquement et bien d’autres choses encore [2].
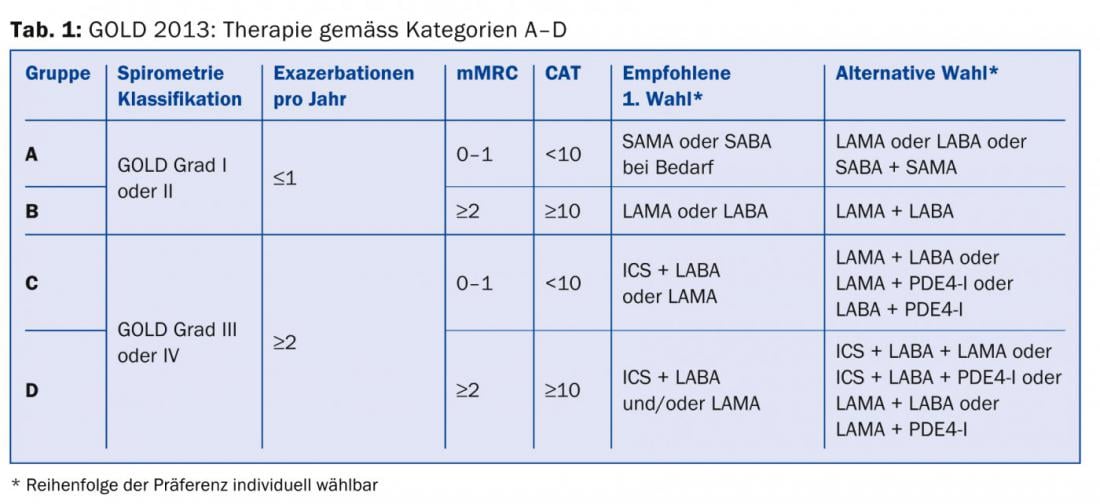
Bien que les directives suisses récemment publiées n’aient pas adopté cette nouvelle classification [7], il sera impossible d’y échapper, du moins en tant que pneumologue.

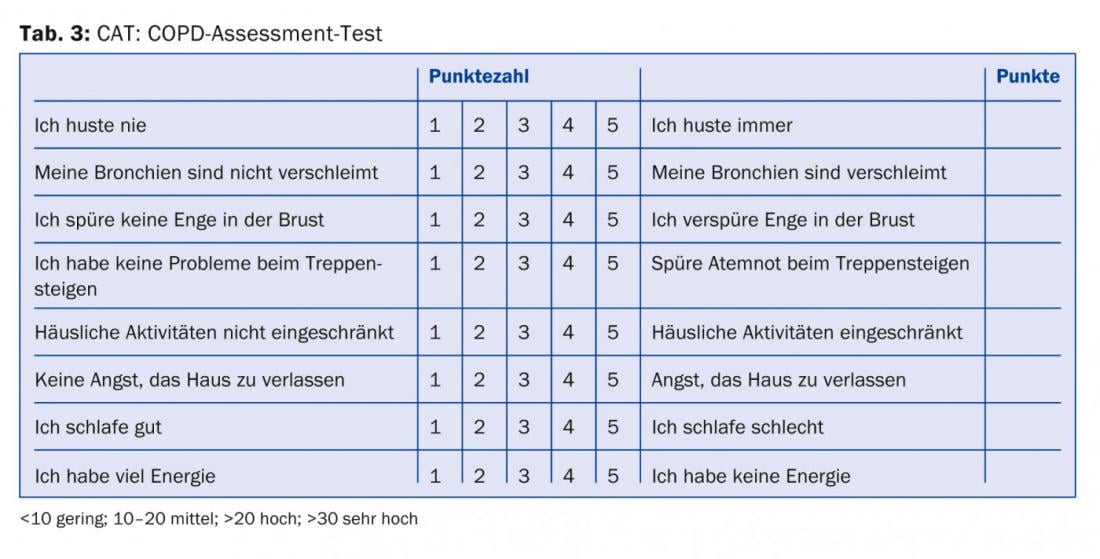
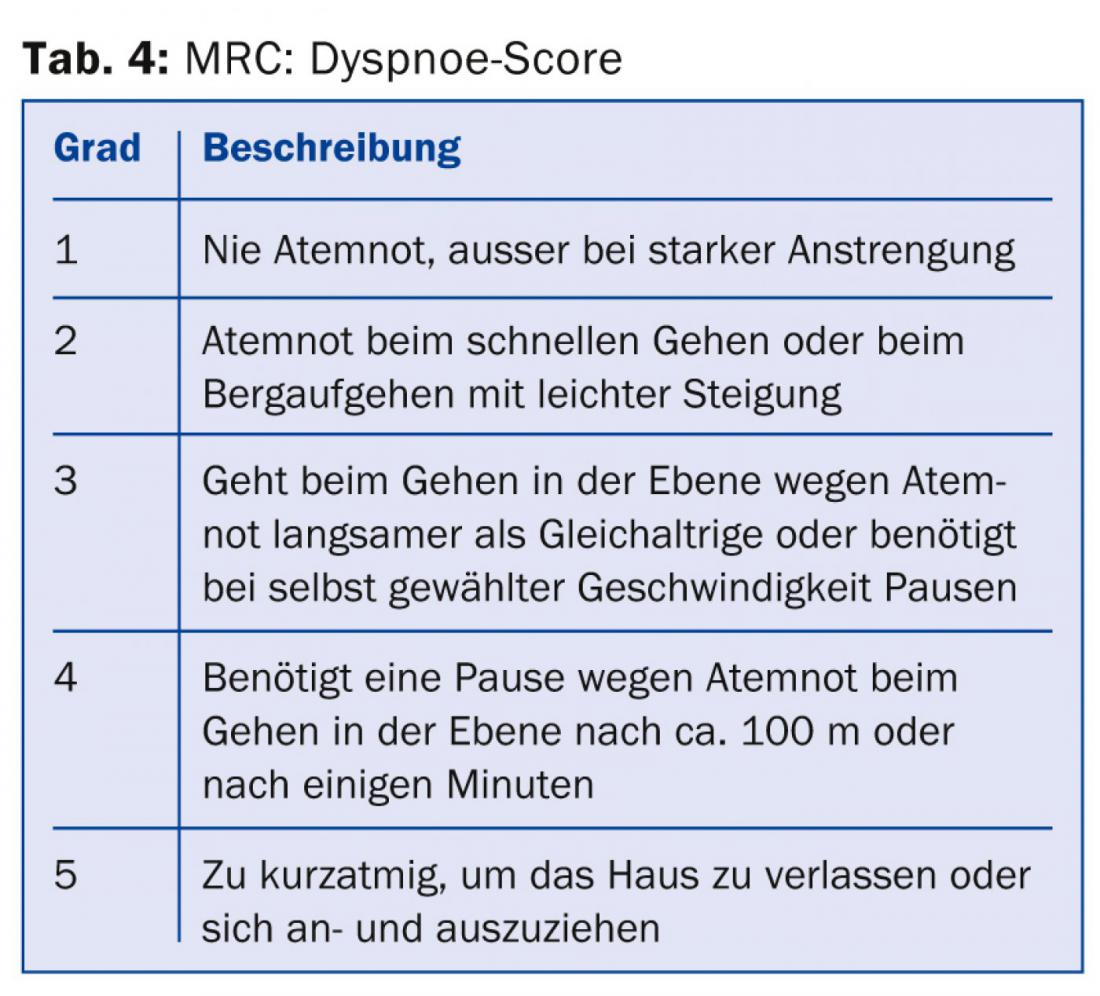
Tous les médecins qui traitent des patients atteints de BPCO devraient au moins savoir qu’en plus de la sévérité de l’obstruction des voies respiratoires, la gravité des symptômes et la fréquence des exacerbations [8] devraient être prises en compte dans la stratification des risques et le plan de traitement. Les informations nécessaires à la catégorisation et aux recommandations thérapeutiques (tab. 1) peuvent être obtenues à partir de la fonction pulmonaire (tab. 2), du score CAT (tab. 3), du score de dyspnée (tab. 4) et de l’anamnèse concernant les exacerbations.
L’expérience montre que les patients ne sont souvent pas traités conformément aux guidelines [9]. Cela peut être dû à des raisons individuelles, et il arrive souvent que des recommandations soient publiées avant que leur supériorité par rapport à une pratique antérieure n’ait été prouvée. On peut toutefois s’attendre à une réduction des coûts et peut-être à la prévention des effets secondaires si le traitement est conforme aux directives. Les traitements polypragmatiques et l’utilisation “sans concept” de tous les médicaments possibles, parfois avec plusieurs substances appartenant au même groupe de principes actifs, reflètent d’une part un effet limité et des symptômes persistants malgré le traitement, mais d’autre part aussi une conduite des patients pas assez clairement déterminée par le médecin.
Options thérapeutiques
La plupart des options thérapeutiques ne permettent pas de prolonger la vie et n’ont que peu ou pas d’effet sur la progression de la maladie. Néanmoins, l’intérêt des entreprises pharmaceutiques pour cette maladie est élevé, probablement en raison du nombre immense de patients et du grand nombre de cas non encore diagnostiqués. Actuellement, plusieurs nouveaux médicaments et combinaisons sont en cours de commercialisation ou sur le point de l’être. On ne peut toutefois pas s’attendre à un changement fondamental de la sévérité et du pronostic de la BPCO dans l’immédiat, mais plutôt à des différences graduelles dans le début de l’effet, dans la puissance de l’effet et dans l’amélioration de critères supplémentaires tels que la capacité d’endurance ou le “trough FEV1” (capacité de la première seconde à la fin de l’intervalle de dosage). Mais la facilité d’utilisation des dispositifs d’inhalation est également améliorée en permanence. Les défenseurs des substances présentes depuis plus longtemps sur le marché mettent pour leur part en avant des données avec un grand nombre de cas sur la sécurité du traitement et les bénéfices cliniques prouvés.
Thérapies médicamenteuses
Bronchodilatateurs et stéroïdes inhalés : les bronchodilatateurs à longue durée d’action (bêta-agonistes à longue durée d’action [LABA] et agonistes antimuscariniques à longue durée d’action [LAMA]) sont les principaux piliers du traitement médicamenteux. Bien que cela n’améliore que légèrement la capacité de la première seconde, la diminution de l’hyperinflation, les effets anti-inflammatoires et immunomodulateurs entraînent une diminution de la dyspnée, une amélioration des symptômes, une prévention des exacerbations, une amélioration de la qualité de vie et une réduction du besoin de médicaments de secours [10,11]. L’utilisation combinée de LABA/LAMA et de stéroïdes inhalés topiques (CSI) est recommandée chez les patients présentant des exacerbations fréquentes et/ou à partir d’un degré de sévérité de l’obstruction bronchique GOLD III. En pratique, les CSI sont trop souvent prescrits [12]. La prévention des exacerbations est contrebalancée par une augmentation, jusqu’à présent sous-estimée, des pneumonies dues à l’utilisation des CSI [13].
Autres thérapies anti-inflammatoires : La N-acétylcystéine, souvent prescrite, n’a probablement aucun effet thérapeutique ou pronostique dans le traitement de la BPCO. Une nouvelle substance efficace est le roflumilast, un inhibiteur de la phosphodiestérase-4. Cette substance permet d’éviter les exacerbations, principalement chez les patients présentant un “phénotype bronchitique” [14]. Cependant, seules les exacerbations modérées semblent pouvoir être évitées de manière significative, et aucun avantage en termes de qualité de vie et de mortalité n’a encore été démontré.

Autres options de traitement
Réhabilitation : les patients atteints de BPCO bénéficient généralement d’un entraînement physique. Des offres de programmes pour la thérapie d’entraînement médical (MTT) sont disponibles sur www.pneumo.ch. Une MTT réalisée en ambulatoire ou en hospitalisation améliore significativement la dyspnée, l’endurance, la qualité de vie et diminue les hospitalisations pour exacerbations [15].
Oxygène : l’oxygène peut être utilisé soit à des fins palliatives, soit à des fins pronostiques en cas d’hypoxémie et d’hypertension pulmonaire. Les patients mobiles sont ceux qui bénéficient le plus de l’oxygène liquide utilisable en ambulatoire. Les patients potentiellement éligibles à l’oxygénothérapie de longue durée doivent être identifiés par les médecins généralistes et adressés aux pneumologues pour titration, prescription et surveillance [16].
Chirurgie : la réduction chirurgicale du volume pulmonaire (RVP) est envisagée chez les patients présentant une souffrance et des limitations importantes à l’effort de faible intensité, en cas d’hyperinflation très marquée et principalement en cas d’emphysème hétérogène. Si la sélection est correcte, on peut même s’attendre à un avantage en termes de survie [17]. L’intervention est réalisable avec un risque acceptable, une abstinence tabagique contrôlée préalable est toujours exigée. L’ultime solution reste la transplantation pulmonaire.
RLV endoscopique : il est également possible d’obtenir une réduction du volume pulmonaire par des méthodes en partie endoscopiques, relativement simples et peu contraignantes (utilisation de valves ou de coils). La sélection des patients est ici cruciale, seuls quelques centres ont à ce jour une expérience suffisante et des résultats contrôlés [18].
stratégies d’adaptation (“disease-management”) : Une formation spécifique à la maladie est souvent dispensée dans le cadre de la MTT. Les médecins généralistes sont appelés à former les patients à la reconnaissance d’une exacerbation, à élaborer un concept d’urgence et à aider à briser la spirale descendante de la maladie, de l’anxiété, de l’isolement et de la dépression [19].
Vaccination : La vaccination contre la grippe réduit le taux d’exacerbation et, en particulier chez les patients âgés, les hospitalisations et la mortalité. Elle doit être effectuée chaque année. Les recommandations pour la vaccination antipneumococcique polyvalente ont été récemment remises en question. Les rappels avec le vaccin 23-valent (PPV 23) ne sont actuellement pas recommandés. Le plan de vaccination suisse prévoit actuellement une seule dose de vaccin antipneumococcique 13-valent (PCV-13) pour les personnes présentant un risque accru de complications liées à une maladie pneumococcique. Cette vaccination doit être effectuée à un intervalle minimal de quatre semaines d’une vaccination contre la grippe. Cependant, à l’heure actuelle, la vaccination contre le pneumocoque n’est remboursée que pour les enfants de moins de cinq ans.
Exacerbations aiguës
Les exacerbations aiguës, les complications les plus fréquentes en pratique, sont définies par une augmentation persistante de la dyspnée, de la toux ou de la production de crachats. Le traitement comprend une augmentation des inhalations, des corticostéroïdes oraux, qui peuvent éventuellement être utilisés moins longtemps qu’auparavant (seulement pendant cinq jours) à une dose de 50 mg d’équivalent prednisone [20], et des antibiotiques en cas d’augmentation de la purulence des crachats.
Controverses
Les attentes selon lesquelles la pharmacothérapie pourrait ralentir l’évolution de la BPCO n’ont pas encore été satisfaites. Il n’est pas clair si l’utilisation précoce d’inhalateurs peut arrêter la perte de fonction pulmonaire ou si les traitements combinés composés de LABA + LAMA + CSI apportent des avantages aux patients. L’utilisation de l’ICS devra être davantage remise en question. Le rapport bénéfice/risque a probablement été jugé trop favorable jusqu’à présent. A l’avenir, une plus grande importance sera accordée au traitement des comorbidités et à la thérapie la plus adaptée possible au phénotype.
Prof. Robert Thurnheer, docteur en médecine
Littérature :
1. Ackermann-Liebrich U, et al : American journal of respiratory and critical care medicine 1997 ; 155 : 122-129.
2. Initiative mondiale pour la maladie pulmonaire obstructive chronique, mise à jour 2014.
3. Halbert RJ, et al : ERJ 2006 ; 28 : 523-532.
4. Vestbo J, et al : American journal of respiratory and critical care medicine 2013 ; 187 : 347-365.
5. Rothe T : Praxis 2012 ; 101 : 1481-1487.
6. Vestbo J : Clinics in chest medicine 2014 ; 35 : 1-6.
7. Russi EW, et al : Respiration 2013 ; 85 : 160-174.
8. Aaron SD : American journal of respiratory and critical care medicine 2009 ; 179 : 335-336.
9. Fritsch K, et al : Swiss medical weekly 2005 ; 135 : 116-121.
10. Calverley PM, et al : NEJM 2007 ; 356 : 775-789.
11. Tashkin DP, et al : NEJM 2008 ; 359 : 1543-1554.
12. Jochmann A, et al : Swiss medical weekly 2012 ; 142 : w13567.
13. Suissa S, et al : Lancet 2009 ; 374 : 695-703.
15. Casaburi R, ZuWallack R : NEJM 2009 ; 360 : 1329-1335.
16. Calverley PM : Thorax 2000 ; 55 : 537-538.
17. Meyers BF, et al : The Annals of thoracic surgery 2001 ; 71 : 2081.
18. Herth FJ, et al : Respiration 2010 ; 79 : 5-13.
19. Bourbeau J : Copd 2011 ; 8 : 143-144.
20. Leuppi JD, et al : JAMA 2013 ; 309 : 2223-2231.
CONCLUSION POUR LA PRATIQUE
- Bien qu’aucune percée majeure n’ait encore été réalisée dans le traitement de la BPCO, une nouvelle compréhension de la maladie a contribué à une multitude d’interventions possibles et à un changement tangible.
- Les patients ne sont souvent pas traités conformément aux guidelines.
- Les dispositifs d’inhalation sont de plus en plus faciles à utiliser.
- Les patients atteints de BPCO bénéficient généralement d’un entraînement physique.
- Jusqu’à présent, la pharmacothérapie ne permet pas de ralentir l’évolution de la BPCO.
PRATIQUE DU MÉDECIN DE FAMILLE 2014 ; 9(8) : 18-21