Elle est largement méconnue : la cystite interstitielle. Mais l’inflammation chronique non infectieuse de la paroi de la vessie s’accompagne d’une symptomatologie douloureuse, de maladies concomitantes et d’une détresse psychologique.
Depuis l’automne 2018, la première ligne directrice sur le diagnostic et le traitement de la cystite interstitielle est entrée en vigueur [1]. Elle s’adresse aux médecins généralistes, urologues, gynécologues, internistes, thérapeutes de la douleur ainsi qu’aux psychosomaticiens et doit contribuer à une meilleure qualité de soins pour les personnes concernées.
Nombre élevé de cas non déclarés
Bien qu’il n’existe pas de définition universelle, la cystite interstitielle (CI) est considérée comme une inflammation chronique non infectieuse de la vessie qui se manifeste de manière symptomatique par des douleurs, une pollakiurie et une nycturie. Les symptômes se manifestent avec une intensité et une combinaison variables. Le diagnostic de syndrome de douleur de la vessie (Bladder Pain Syndrome, BPS) n’est pas suffisant dans ce cas, car il met trop l’accent sur la douleur, ce qui ne correspond pas au tableau clinique de l’IC. Cependant, en raison du chevauchement parfois étroit de différents tableaux cliniques, il n’est pas si facile de distinguer l’IC des autres maladies de la vessie (Fig. 1).
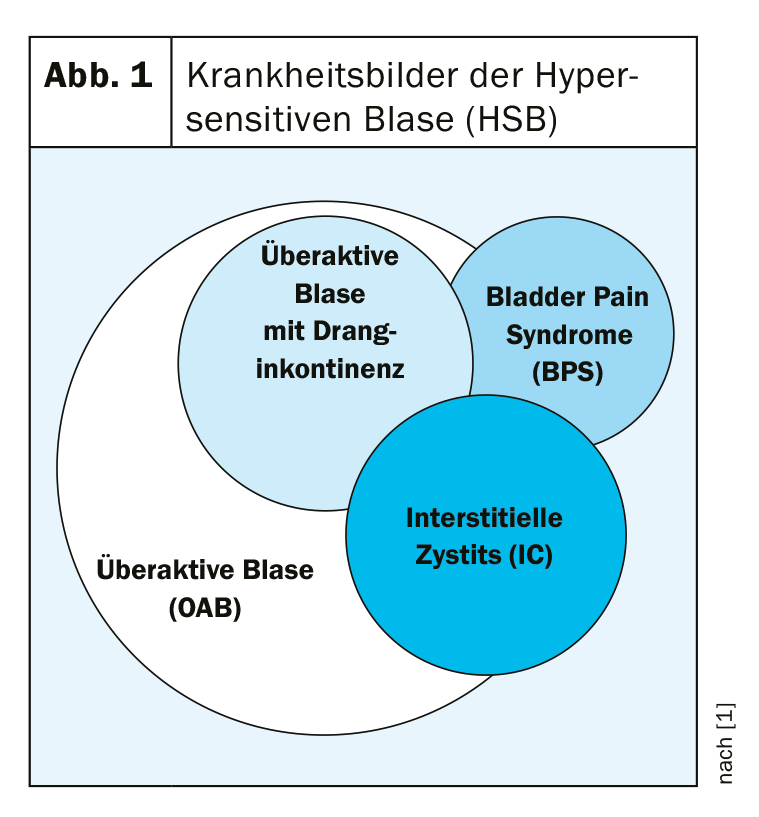
En principe, l’IC peut survenir dans toutes les tranches d’âge, la prévalence la plus élevée étant observée chez les personnes d’âge moyen. Les femmes sont environ neuf fois plus susceptibles d’être touchées que les hommes. Cependant, en l’absence d’études épidémiologiques, il n’existe pas de données précises. Le nombre de cas non déclarés est élevé.
On ne sait pas non plus comment une CI est créée. Plusieurs facteurs étiopathogéniques sont discutés. Les infections urinaires fréquentes modifient la couche de GAG, la perméabilité de la vessie et l’homéostasie de l’urothélium. En conséquence, les substances irritantes de l’urine pénètrent dans la sous-muqueuse et les couches plus profondes de la paroi de la vessie. Ce processus destructeur peut même entraîner la perte de l’urothélium. La muqueuse vésicale défectueuse évoque une sensibilité accrue de la vessie et des douleurs.
Le marathon des médecins accentue la souffrance
Il peut s’écouler jusqu’à neuf ans avant que les patients concernés ne reçoivent un diagnostic d’IC. Les erreurs de diagnostic ne sont pas rares, en particulier aux premiers stades de la maladie. Ce marathon médical est éprouvant et peut conduire les personnes concernées à se sentir comme des simulateurs, à s’isoler et même à développer une dépression. Pour compliquer encore les choses, les personnes atteintes de CI souffrent souvent de maladies associées telles que la fatigue, le syndrome du côlon irritable, la fibromyalgie, des troubles psychologiques et d’autres troubles neurologiques, somatiques fonctionnels ou rhumatismaux.
Il est donc d’autant plus important qu’il existe désormais un consensus sur la manière de diagnostiquer et de traiter la CI avec la ligne directrice S2k de la Société allemande d’urologie.
Comment diagnostiquer ?
Le guide S2k recommande, comme pour d’autres maladies, de commencer le diagnostic par une anamnèse complète. Des questionnaires tels que l’indice ICSI/ICPI (fréquence mictionnelle, paresthésies urinaires), le questionnaire PUF (dypareunie, douleurs pelviennes) et le Bladder Pain/IC Symptom Score (BPIC-SS) sont là pour vous aider. Des fiches de documentation sous la forme d’un journal de la douleur ou d’un protocole de mictions et de boissons sont également utiles. L’examen physique se concentre sur la région génitale. En outre, un échantillon d’urine doit être prélevé. Les examens complémentaires comprennent une urosonographie, une cystoscopie et, chez les hommes, une urodébitmétrie. Si nécessaire, une hydrodistension, un EMG de débit ou un test au chlorure de potassium peuvent être envisagés pour détecter une sensibilité accrue à la douleur. Une biopsie de la paroi de la vessie n’est pas déterminante pour le diagnostic, mais doit être envisagée en complément. Cependant, comme les mastocytes sont impliqués dans divers processus inflammatoires, cette méthode n’est pas univoque dans la détermination d’une IC. Une autre option de médecine complémentaire consiste à prélever un échantillon de selles, qui fournit des informations sur la flore intestinale. Aucun biomarqueur n’est actuellement connu, bien que des recherches soient en cours.
Le diagnostic implique également l’exclusion de toute une série de diagnostics différentiels. Il s’agit notamment de
- Maladies musculo-squelettiques (par ex. dysfonctionnement du plancher pelvien, fibromyalgie, hernies, douleurs dorsales chroniques, tumeurs malignes)
- Maladies gastro-intestinales (par ex. CED, syndrome du côlon irritable, sténoses de l’intestin grêle et du côlon, tumeurs malignes)
- Maladies gynécologiques (par ex. endométriose/adénomyosite, varicose pelvienne, sténose cervicale)
- Maladies urologiques (par ex. dysfonctionnement de la vessie, inflammation chronique des voies urinaires, prostatite, tumeurs malignes)
- Causes neurogènes (par ex. herpès génital, névralgies, varicelle zoster)
- Troubles mentaux (par ex. troubles affectifs, schizophréniques, somatoformes)
Traitement multimodal !
L’IC est incurable. La progression de la maladie peut toutefois être ralentie et les symptômes atténués. Un traitement approprié doit être interdisciplinaire et multimodal, en tenant compte des aspects biopsychosociaux (Fig. 2). La première étape consiste à modifier le mode de vie. La garde-robe, la sexualité et le sport doivent être organisés de manière à ne pas aggraver les troubles. Le stress et le froid ont un effet négatif, tandis que l’entraînement de la vessie est considéré comme ayant une certaine efficacité. Les intolérances alimentaires étant souvent associées aux symptômes de l’IC/BPS, une attention particulière doit être accordée à l’alimentation. En raison de leur faible teneur en histamine, les aliments non fermentés, fermentés ou ayant subi une maturation microbienne sont à privilégier. Comme pour le syndrome du côlon irritable, un régime low FODMAP peut s’avérer utile. Les symptômes psychosomatiques doivent être soulagés par des soins psychologiques ou psychiatriques, l’environnement social du patient jouant également un rôle important. Le dysfonctionnement du plancher pelvien, fréquent chez les femmes atteintes d’IC, peut être traité par la kinésithérapie.
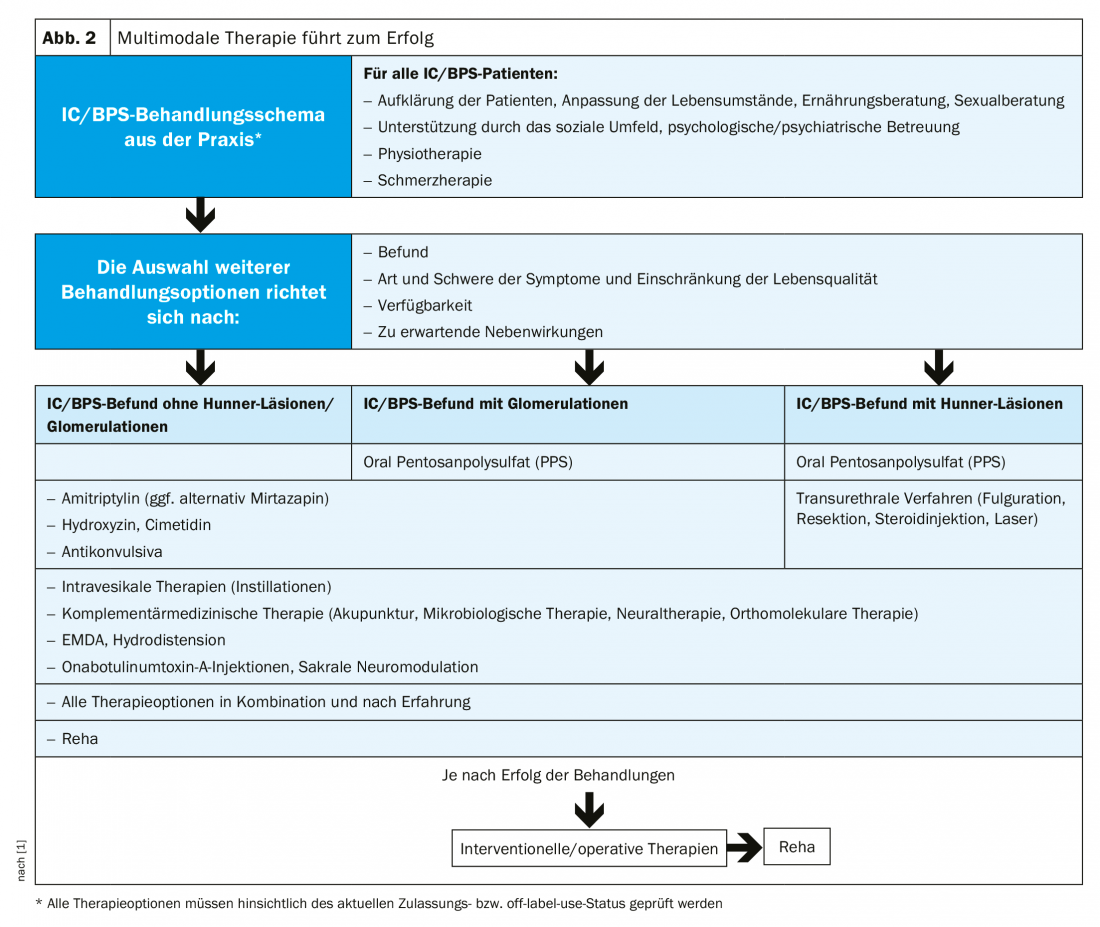
Actuellement, seul le polysulfate de pentosane (PPS) est autorisé en Europe comme traitement médicamenteux oral de l’IC. La substance active répare la couche de GAG de l’urothélium, empêchant ainsi les substances qui ont un effet toxique ou irritant sur la paroi de la vessie de pénétrer. Le PPS favorise également l’irrigation sanguine de la vessie. Les effets se font généralement sentir au bout de trois à six mois, sachant que plus le traitement commence tôt, mieux c’est !
D’autres substances actives peuvent être envisagées hors étiquette. En inhibant la recapture de la sérotonine/noradrénaline, l’amitriptyline modifie la transmission de la douleur dans le SNC et réduit l’activation des mastocytes, ce qui entraîne une diminution du besoin d’uriner et de la douleur. Une alternative à l’amitriptyline est l’antidépresseur tétracyclique mirtazapine qui, contrairement à l’amitriptyline, n’a pas d’effets secondaires anticholinergiques. L’hydroxyzine inhibe également l’activation des mastocytes et a un effet anticholinergique, anxiolytique et analgésique. Des études ont montré une réduction de la douleur et de la nycturie chez des patients atteints d’IC traités par la cimétidine, un antagoniste des récepteurs de l’histamine 2. Cet effet peut s’expliquer par le fait que la cimétidine inhibe la surexpression des récepteurs H1 et H2, des récepteurs P2X purinergiques et des récepteurs muscariniques cholinergiques, qui a été observée dans l’IC. Le montelukast, autorisé pour l’asthme, a également montré un effet dans l’IC dans une petite étude, en réduisant l’inflammation induite par les mastocytes. Les inhibiteurs de la phosphodiestérase 5 (PDE5) ont un effet relaxant sur les cellules musculaires lisses de la vessie, mais la cause de leur action n’est pas encore connue. La nifédipine, un antagoniste des canaux calciques, s’est également révélée efficace dans le traitement de l’IC. Des études prospectives randomisées font toutefois encore défaut.
Le guide S2k recommande également un traitement adéquat de la douleur. Il s’agit de soulager la douleur des patients et d’éviter l’utilisation inconsidérée d’analgésiques peu efficaces. Actuellement, il n’existe pas de consensus sur le traitement de l’IC, mais les experts font référence à différents groupes de médicaments qui peuvent également être utilisés en combinaison. En fonction de la gravité et de la réponse du patient, on peut utiliser des AINS, des anticonvulsivants, des novaminsulfon et des opioïdes.
En outre, l’utilisation de myorelaxants (par ex. tizanidine), d’alpha-bloquants (par ex. tamsulosine) et d’anticonvulsivants (par ex. prégabaline) est possible.
Les effets secondaires systémiques peuvent être contournés par des formes de traitement intravésical. Les inconvénients de cette thérapie, qui consiste à introduire de fortes concentrations de substances actives directement dans la vessie, sont toutefois le risque d’infection, le caractère invasif et le coût élevé.
Les méthodes de médecine complémentaire telles que l’acupuncture, la thérapie neurale, les thérapies microbiologiques ou la substitution de micronutriments constituent une autre possibilité. Si aucune de ces thérapies n’est couronnée de succès, il reste la chirurgie. Un traitement dans des centres de rééducation urologique spécialisés constitue à tout moment une mesure d’accompagnement. En fin de compte, l’objectif reste de protéger la personne atteinte d’IC d’une incapacité de travail imminente et/ou d’un isolement social.
Littérature :
- Société allemande d’urologie, éd. : S2k-Leitlinie Diagnostik und Therapie der Interstitiellen Cystitis (IC/BPS), version longue, 1ère édition, version 1. 2018.
PRATIQUE DU MÉDECIN DE FAMILLE 2019 ; 14(5) : 39-41











