Le traitement du pityriasis rubra pilaire peut représenter un défi. L’arsenal thérapeutique comprend les corticostéroïdes topiques, la photothérapie ou encore les thérapies systémiques classiques comme les rétinoïdes ou les immunosuppresseurs. Des rapports de cas récents et de petites séries de cas indiquent que l’utilisation hors étiquette de médicaments biologiques est une option de traitement à envisager pour les évolutions qui ne répondent pas au traitement conventionnel.
Le traitement du pityriasis rubra pilaire (PRP) (encadré) est souvent difficile et long. Il n’existe pas encore d’approche thérapeutique universelle pour le PRP. Outre les préparations topiques destinées à soulager les symptômes, une thérapie systémique est utilisée pour réduire l’inflammation, les deux voies thérapeutiques étant souvent combinées. Récemment, quelques rapports de cas et de petites séries de cas ont été publiés dans lesquels des médicaments biologiques ont permis de traiter avec succès des patients difficiles à traiter. Voici un résumé concis de quatre cas tirés de la pratique quotidienne.
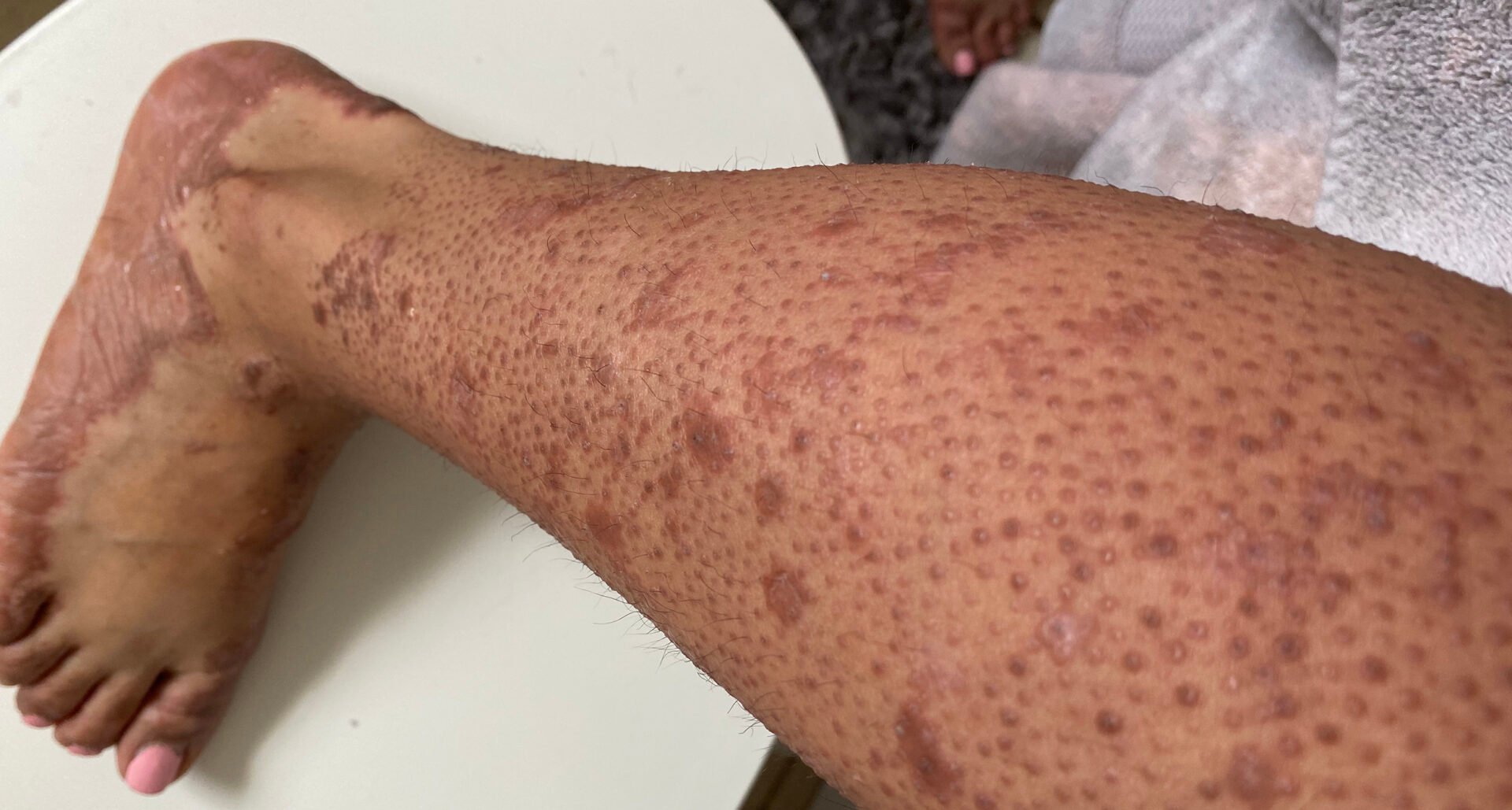
| Le pityriasis rubra pilaire (PRP) est une dermatose érythémato-squameuse inflammatoire d’étiologie inconnue, diagnostiquée sur la base des caractéristiques cliniques et histopathologiques classiques. On connaît au moins 6 sous-types, qui se retrouvent aussi bien chez les enfants que chez les adultes [3]. Elle se caractérise par des papules folliculaires et des plaques squameuses de petite taille, de couleur orange-rougeâtre. Le PRP s’étend généralement du visage dans le sens cranio-caudal, en épargnant les îlots de peau cliniquement normaux (nappes claires), au tronc et aux extrémités, y compris la paume des mains et la plante des pieds [4]. Jusqu’à présent, il n’a pas été possible d’identifier des marqueurs sérologiques ou immunohistochimiques pertinents pour le diagnostic. Le diagnostic différentiel varie en fonction du sous-type de PRP. En général, le PRP doit être distingué d’autres maladies papulosquameuses, notamment le psoriasis. |
Ustekinumab dans la PRP chez le nourrisson et l’adulte
Dans le cadre du congrès de la DDG de cette année, deux rapports de cas ont été présentés dans lesquels l’utilisation off-label de l’ustékinumab s’est avérée efficace [1]. L’ustékinumab neutralise les interleukines IL-12 et IL-23, exerçant ainsi une action immunosuppressive et anti-inflammatoire. Dans le cas 1 , Almeida et al. d’un nourrisson de six mois présentant des lésions érythémateuses-squameuses qui ont débuté sur le visage et ont évolué vers une érythrodermie [1]. L’histologie a révélé une dermatite psoriasiforme. Une mutation dans le gène CARD-14 a été identifiée (c.349 +2T>C), à la suite de quoi le tableau clinique a été classé comme une éruption papulosquameuse associée à CARD-14 (CAPE). Le nourrisson n’a pas répondu au traitement par méthotrexate et acitrétine. En revanche, l’administration d’ustékinumab en fonction du poids a permis d’obtenir une excellente réponse.
Dans le cas 2, les mêmes auteurs de l’étude ont décrit un adulte présentant un PRP qui se manifestait sous la forme de lésions érythémateuses-squameuses étendues et d’une accentuation folliculaire [1]. Là encore, l’histologie a révélé une dermatite psoriasiforme. Le patient n’a pas répondu au méthotrexate ni aux rétinoïdes oraux (isotrétinoïne), mais l’utilisation de l’ustékinumab a permis d’améliorer les résultats.
Risankizumab chez une patiente PRP de longue date de plus de 55 ans
Le cas 3 a été présenté lors du congrès de la DDG de l’année dernière [2]. Il s’agit d’une étude de cas dans laquelle le traitement par risankizumab, un inhibiteur de l’IL-23, s’est révélé efficace chez une patiente d’âge adulte moyen. La patiente de 57 ans, qui souffrait depuis 38 ans d’un pityriasis rubra pilaire (PRP) de type II selon Griffith, avait été traitée par le passé pendant plusieurs années avec des glucocorticostéroïdes topiques et du tacrolimus, mais cela n’avait pas entraîné d’amélioration clinique significative. Un traitement systémique par rétinoïdes était sine qua non et a provoqué des effets secondaires graves selon l’anamnèse. D’autres thérapies systémiques ont été refusées par la patiente.
Après une information détaillée, un traitement hors indication a été initié avec l’anticorps IL-23 risankizumab, à la dose approuvée pour le psoriasis en plaques (150 mg s.c. aux semaines 0, 4, puis toutes les 12 semaines). Un traitement topique préexistant à base de tacrolimus 0,1% une à deux fois par jour a été poursuivi en parallèle. Avant l’introduction du traitement systémique, l’ensemble du tégument présentait de larges plaques érythémateuses confluentes, parfois lichénifiées, avec une desquamation blanchâtre à fines lamelles. Entre les deux, on trouvait des îlots de peau saine (nappes claires). La région faciale présentait un érythème étendu avec desquamation ainsi qu’un ectropion bilatéral. Les ongles des doigts et des pieds présentaient une dystrophie distale et un sillon longitudinal. La présence de prurit ou de douleurs a été niée. Aucune maladie concomitante ou préexistante n’était connue. Quatre semaines seulement après la première administration de risankizumab, on a observé une nette régression de l’état cutané, avec disparition des plaques érythémateuses et absence presque totale de desquamation, ainsi qu’un ectropion moins prononcé aux deux yeux.
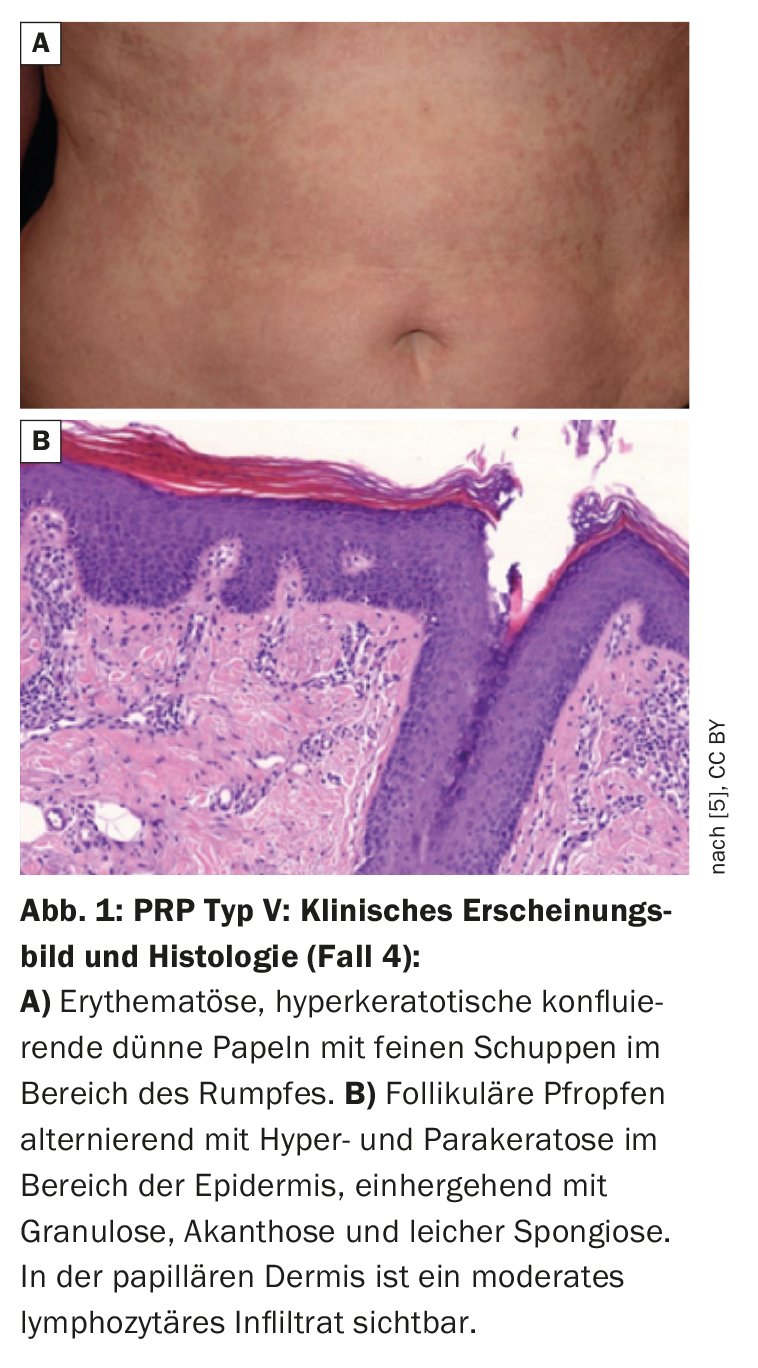
| Cas 4 : Patiente de 61 ans avec PRP de type V et variants CARD-14 Cette femme présentait une érythrodermie généralisée au niveau du tronc, avec une légère infiltration et de fines squames blanchâtres (figure 1). Les symptômes cutanés sont apparus pour la première fois dans l’enfance et la patiente suivait un traitement dermatologique depuis 28 ans. L’anamnèse a révélé une composante familiale – sa fille et un de ses petits-enfants avaient du psoriasis. Des analyses génétiques ont permis d’identifier des variants CARD-14 chez la patiente PRP. Le séquençage direct des régions codant pour CARD-14 a permis d’identifier trois variants Missense hétérozygotes : – c.1641G/C p.Arg547Ser (rs2066964) sur l’exon 14 – c.2044C/T et p.Arg682Trp (rs117918077) sur l’exon 17 – c.2458C/T p.Arg820Trp (rs11652075) sur l’exon 20 Les analyses de prédiction de la pathogénicité effectuées à l’aide d’un outil approprié ont révélé que le variant p.Arg682Trp-Missense est pathogène, tandis que les deux autres variants sont bénins. |
| d’après [5] |
Association entre les variants du gène CARD-14 et le PRP
Bien que les caractéristiques cliniques et histologiques du PRP et du psoriasis diffèrent, il existe néanmoins des chevauchements entre les deux pathologies, par exemple dans l’activation du facteur nucléaire kappa B (NF-κB) [3]. Cette cascade de signalisation est nécessaire au maintien de l’équilibre immunologique de la peau dans des conditions physiologiques, mais lorsqu’elle est (sur)activée, elle joue un rôle central dans les maladies inflammatoires de la peau [3]. La protéine CARD-14, présente préférentiellement dans les kératinocytes et les endothéliums des vaisseaux de la peau, active NF-κB [4]. Les éruptions papulosquameuses associées au CARD-14 (CAPE) sont associées au psoriasis, mais aussi au type juvénile atypique de pityriasis rubra pilaire (type V) [5–7]. On pense que certaines mutations du CARD-14 provoquent des réactions inflammatoires anormales et contribuent ainsi à l’étiopathogénie du PRP [5]. Il a notamment été démontré qu’une expression excessive de CARD-14 active la voie IL-23/Th17 [6], ce qui pourrait expliquer la réponse thérapeutique à l’ustekinumab et au risankizumab décrite dans les exemples de cas présentés. La figure 1 présente des résultats de PRP de type V avec des variants Missense hétérozygotes dans les régions codant pour CARD-14 (encadré) [5].
Littérature :
- De Almeida H, et al. : Traitement réussi par ustékinumab dans deux cas de pytiriasis rubra pilaire, P095. DDG-Tagung 2023, Abstractband, JDDG 2023 ; 21 Suppl 1 : 1-177.
- Bätcher L, Homey B, Meller S : Contrôle clinique du pityriasis rubra pilaire par le risankizumab, P002. DDG-Tagung 2023, Abstractband, JDDG 2022 ; Volume 20 (S1) ; 1-49.
- Brown F, Badri T. Pityriasis Rubra Pilaris. [Updated 2023 Jun 26]. Dans : StatPearls [Internet]. Treasure Island (FL) : StatPearls Publishing.
- Volc-Platzer B : Mutations CARD14 dans le pityriasis rubra pilaire et réponse thérapeutique à l’ustékinumab – une hypothèse. JDDG 2020, DOI : 10.1111/ddg.14218_g.
- Danis J, et al : Activation du facteur nucléaire κB chez un patient atteint de pityriasis de type V Rubra Pilaris portant de multiples variants CARD14. Front Immunol 2018 ; 9:1564. doi : 10.3389/fimmu.2018.01564, www.frontiersin.org/articles/10.3389/fimmu.2018.01564/full,(dernière consultation 17.10.2023)
- Frare CP, et al : CARD14-associated papulosquamous eruption (CAPE) in pediatric patients : Three additional cases and review of the literature. Pediatr Dermatol 2021 ; 38(5) : 1237-1242.
- Fuchs-Telem D, et al : Le pityriasis rubra pilaire familial est causé par des mutations dans CARD14. Am J Hum Genet 2012 ; 91 : 163-170.
DERMATOLOGIE PRATIQUE 2023 ; 33(5) : 48-49
Photo de couverture : Kelly McGauran, wikimedia