La survie globale des patients atteints de leucémie myéloïde chronique ne peut pas être modifiée par des optimisations du traitement par imatinib. Les résultats de l’étude ont montré qu’il n’y avait pas d’influence sur la réponse, bien que des évaluations antérieures aient montré qu’il y avait une influence sur la réponse.
L’imatinib a constitué une révolution dans le traitement de la leucémie myéloïde chronique (LMC). Les taux de survie ont ainsi fortement augmenté. Les patients qui répondent aux ITK ont désormais une espérance de vie presque normale. Les chercheurs s’intéressent donc désormais à la question de savoir si la dose habituelle de 400 mg est adaptée à tous les patients pour obtenir un résultat optimal. Plusieurs études examinent le bénéfice potentiel d’un traitement par imatinib modifié. Hehlmann et ses collègues l’ont déjà montré sur [2,4] (bien qu’en partie en contradiction avec d’autres études randomisées [3]), les approches basées sur l’imatinib à haute dose (800 mg) ou à dose adaptée (ou encore la combinaison avec l’interféron) peuvent certes modifier la réponse par rapport à la variante standard. Mais ce bénéfice se traduit-il à long terme par une meilleure survie, c’est-à-dire une survie plus longue ? Les différentes optimisations thérapeutiques permettent-elles d’obtenir des taux de survie plus élevés ?
L’étude LMC IV
Cette question a notamment été abordée dans le cadre de la grande étude randomisée CML IV – à laquelle la Suisse a participé. L’objectif était de déterminer dans quelle mesure le traitement standard de 400 mg/j d’imatinib pouvait être optimisé. Pour ce faire, 1551 patients nouvellement diagnostiqués en phase chronique ont été randomisés en cinq bras. Deux bras, ceux qui testaient l’imatinib en combinaison avec la cytarabine ou après l’échec de l’interféron, ont été fermés après une phase pilote pour la poursuite du recrutement de patients. Les trois autres consistaient en une dose standard de 400 mg/j, un traitement à haute dose de 800 mg/j et une combinaison d’imatinib et d’interféron. L’âge médian des patients était de 53 ans et 61% d’entre eux étaient des hommes.
Lors du congrès de l’EHA à Madrid, les données à long terme sur la survie ont été abordées, plus précisément la survie globale après une période d’observation médiane de 9,5 ans. Elle était de 82% pour l’ensemble des groupes (survie sans progression de 80%).
Survivre après une décennie
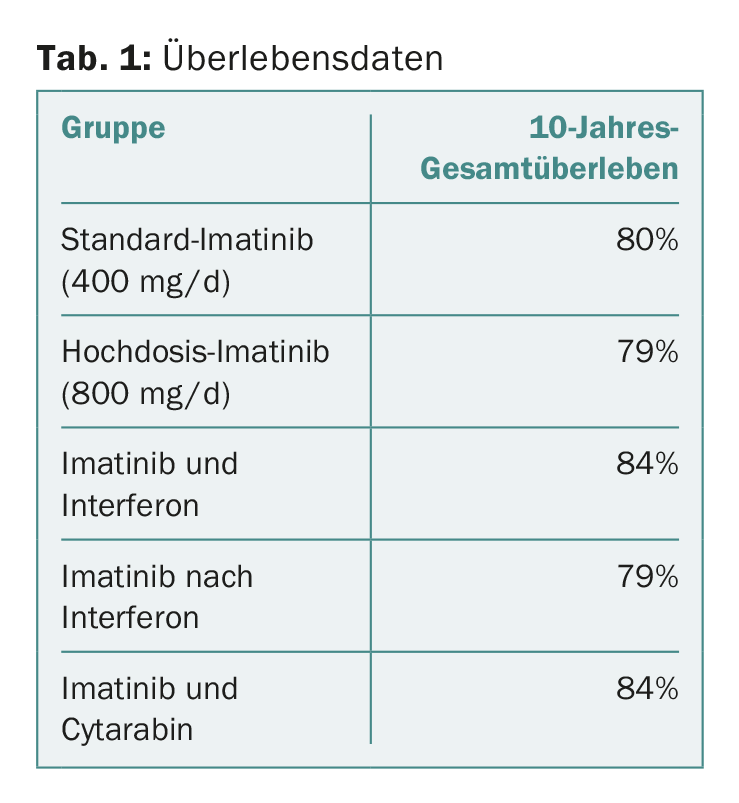
Les détails pour chaque groupe sont illustrés dans le tableau 1. Il s’avère qu’il n’y a pas de différences significatives entre les différentes approches ou optimisations de traitement. Les résultats de l’étude ont montré que le traitement à haute dose permettait d’obtenir une réponse plus rapide, comme l’avaient déjà montré des publications antérieures [2]. Ce qui a joué un rôle dans la survie à long terme, c’est l’atteinte des valeurs cibles (“jalons”) dans la réponse moléculaire à trois, six et douze mois – également en accord avec les données publiées précédemment dans l’étude [2,4]. Dans l’analyse multivariée, les comorbidités et le statut tabagique sont également apparus comme des facteurs d’influence pertinents pour la survie. Le fait que le centre de traitement soit académique ou non a également joué un rôle significatif – mais pas le sexe du patient.
Est-ce la fin du monde ?
CML IV a donc montré : Les taux de survie des patients atteints de LMC sous imatinib sont élevés et ne sont pas nécessairement influencés par un régime de traitement initial avec une réponse plus rapide, mais plutôt par des facteurs externes tels que le tabagisme, le type de centre de traitement et les comorbidités du patient.
Le risque de décéder au bout de dix ans en raison de paramètres indépendants de la LMC plutôt que de la maladie elle-même était nettement plus élevé pour les participants, soit deux fois plus, ce qui est finalement un effet attendu pour des médicaments bien efficaces [5]. En outre, le score de survie à long terme EUTOS (European Treatment and Outcome Study), qui évalue le risque de mortalité associé à la LMC, est un facteur prédictif significatif du pronostic : les groupes à haut risque ont survécu moins longtemps que les groupes à faible risque.
D’une part, la survie est donc indépendante du délai de réponse (du moins dans cette étude et situation de traitement ou durée d’observation). La thérapie à haute dose n’a donc pas entraîné de différence significative. Inversement, le temps de réponse n’est pas un marqueur de substitution approprié pour la survie globale. D’autre part, il ne faut pas oublier que l’atteinte des valeurs cibles de la réponse moléculaire à certains moments a joué un rôle dans le pronostic, comme on pouvait s’y attendre. Les patients avec BCR-ABLIS <1% à six mois ont eu une survie à cinq ans de 97% contre 89% pour BCR-ABLIS >1% (p<0,001) [6].
La survie globale est-elle un bon indicateur de la réussite d’un traitement ?
La présentation de l’EHA laisse donc quelque peu perplexe. Bien que davantage de patients obtiennent (plus rapidement) une réponse avec le dosage le plus élevé et que celle-ci soit associée à une meilleure survie globale, les différences entre les variantes de dosage ne semblent pas avoir d’effet significatif à long terme : Tous vivent aussi longtemps, quel que soit le schéma d’imatinib qu’ils ont reçu. D’autres facteurs, qui ne sont pas directement liés à la LMC, deviennent plus importants : le patient est-il par ailleurs en bonne santé ? Fume-t-il ?
On peut aussi formuler les choses à l’envers : La survie globale peut ne pas être appropriée pour évaluer le succès à long terme de traitements spécifiques de la LMC [5]. En effet, si l’on s’en tenait uniquement à cela, l’imatinib au dosage standard serait la goutte d’eau qui fait déborder le vase.
Bien entendu, les critères d’évaluation tels que l’obtention d’une réponse profonde permettant peut-être même d’arrêter le TKI (voir l’étude EURO-SKI [7] avec mise à jour lors du congrès de l’EHA de l’année dernière [8]) ou la protection contre la progression jouent également un rôle central pour les patients atteints de LMC et ne doivent pas être oubliés dans ce contexte.
Source : Congrès 2017 de l’Association européenne d’hématologie (EHA), 22-25 juin 2017, Madrid
Littérature :
- Hehlmann R, et al : Assessment Of Imatinib 400mg As First Line Treatment Of Chronic Myeloid Leukemia : 10 -Year Survival Results Of The Randomized Cml Study IV. EHA 2017 ; Abstract S424.
- Hehlmann R, et al : Deep Molecular Response Is Reached by the Majority of Patients Treated With Imatinib, Predicts Survival, and Is Achieved More Quickly by Optimized High-Dose Imatinib : Results From the Randomized CML-Study IV. Journal of Clinical Oncology 2014 ; 32(5) : 415-423.
- JE Cortes, et al. : Étude de phase III, randomisée, en ouvert, du mesylate d’imatinib quotidien 400 mg versus 800 mg chez des patients atteints de leucémie myéloïde chronique en phase chronique, nouvellement diagnostiquée et non traitée auparavant, en utilisant des points finaux moléculaires : Optimisation de l’inhibiteur de tyrosine kinase et étude de sélectivité. J Clin Oncol 2010 ; 28 : 424-430.
- Hehlmann R, et al. : Tolerability-Adapted Imatinib 800 mg/d Versus 400 mg/d Versus 400 mg/d Plus Interferon-α in Newly Diagnosed Chronic Myeloid Leukemia. Journal of Clinical Oncology 2011 ; 29(12) : 1634-1642.
- Saussele S, et al : Impact des comorbidités sur la survie globale des patients atteints de leucémie myéloïde chronique : résultats de l’étude randomisée IV sur la LMC. Blood 2015 ; 126(1) : 42-49.
- Hanfstein B, et al : Une réponse moléculaire et cytogénétique précoce est prédictive de la survie globale et sans progression à long terme dans la leucémie myéloïde chronique (LMC). Leucémie 2012 ; 26(9) : 2096-2102.
- Mahon FX, et al : Interim Analysis of a Pan European Stop Tyrosine Kinase Inhibitor Trial in Chronic Myeloid Leukemia : The EURO-SKI study. Blood 2014 ; 124 : 151.
- Richter J, et al. : Stopping tyrosinekinase-inhibitors in a very large cohort of European chronic myeloid leukemia patients : results of the EURO-SKI trial. EHA 2016 ; Abstract S145.
InFo ONKOLOGIE & HÄMATOLOGIE 2017 ; 5(4) : 7-8