L’Office fédéral de la santé publique (OFSP) et la Commission fédérale pour les vaccinations (CFV) recommandent aux personnes en bonne santé âgées de 65 ans et plus, ainsi qu’aux patients immunodéprimés âgés de 50 ans et plus ou souffrant d’une immunodéficience sévère âgés de 18 ans et plus, de se faire vacciner contre l’herpès zoster à l’aide du nouveau vaccin inactivé recombinant composé de deux principes actifs : la glycoprotéine E (subinit viral) et l’AS01B (adjuvant). Celui-ci est dès à présent admis aux caisses et disponible en Suisse.
Avec l’âge, le nombre et la fonctionnalité des cellules immunitaires qui empêchent la réactivation du virus varicelle-zona (VZV) diminuent [2,6,7,9,10]. Cela entraîne une augmentation de l’incidence et de la sévérité du zona. En Suisse, il y a entre 17 000 et 30 000 cas d’herpès zoster par an [2]. Environ 99% des adultes de 50 ans et plus sont infectés par le virus responsable du zona et chez une personne sur trois, le VZV latent se réactive et provoque le zona [2,3]. Certaines maladies préexistantes, telles que la polyarthrite rhumatoïde, les maladies inflammatoires chroniques de l’intestin, le diabète, la BPCO, l’asthme, le lupus érythémateux disséminé ou la dépression, augmentent également le risque d’herpès zoster. Le risque d’herpès zoster est le plus élevé dans les maladies qui entraînent une déficience immunitaire grave, comme les lymphomes ou les myélomes, et il est même 13 fois plus élevé sous chimiothérapie [2,5,6,11,12].
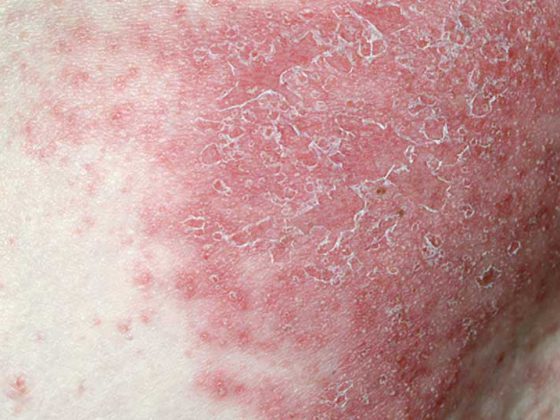
Zona et les complications potentiellement graves
Le zona est une maladie douloureuse qui peut s’accompagner de complications graves et durables, parmi lesquelles la névralgie post-zostérienne (NPZ) et le zona ophtalmique [2]. Le PHN touche jusqu’à 30% des patients atteints de zona et se caractérise par des douleurs nerveuses persistant parfois pendant des années [2,4]. Le zona ophtalmique touche environ 20% des patients atteints de zona. Dans ce cas, des complications ophtalmologiques et, dans de rares cas, la cécité peuvent survenir [2,13]. Le taux de récidive de l’herpès zoster à huit ans est estimé à 6,2% selon Yawn et al. Les récidives étaient plus fréquentes chez les personnes souffrant de douleurs d’une durée de >30 d et chez les individus immunodéprimés. En raison des taux de récidive relativement élevés, la vaccination devrait également être proposée aux patients ayant déjà souffert d’herpès zoster [14].
Prévention grâce à un nouveau vaccin inactivé recombinant
SHINGRIX® est le premier et le seul vaccin contre le zona qui induit une réponse immunitaire forte et durable grâce à l’association d’un antigène recombinant et d’un système adjuvant [1,15–19]. L’antigène (glycoprotéine E [gE]) déclenche une réponse immunitaire spécifique contre le VZV. gE est exprimé à la surface des cellules infectées par le VZV et est essentiel à la réplication du virus. Le système adjuvant (AS01B) provoque une amplification de la réponse immunitaire à l’antigène du vaccin. Il induit une réponse immunitaire antigE forte et durable. La combinaison unique de MPL et de QS-21 renforce à la fois la réponse immunitaire humorale et cellulaire contre gE* [1,17–22]. Cette propriété le rend également approprié pour les patients immunodéficients ou immunosupprimés [1].
* VZV = virus varicelle-zona ; MPL : 3-O-desacyl-4′-monophosporyl lipide A de Salmonella minnesota ; QS-21 : fraction saponine QS-21 de l’arbre à écorce de savon.
Efficacité et profil de sécurité
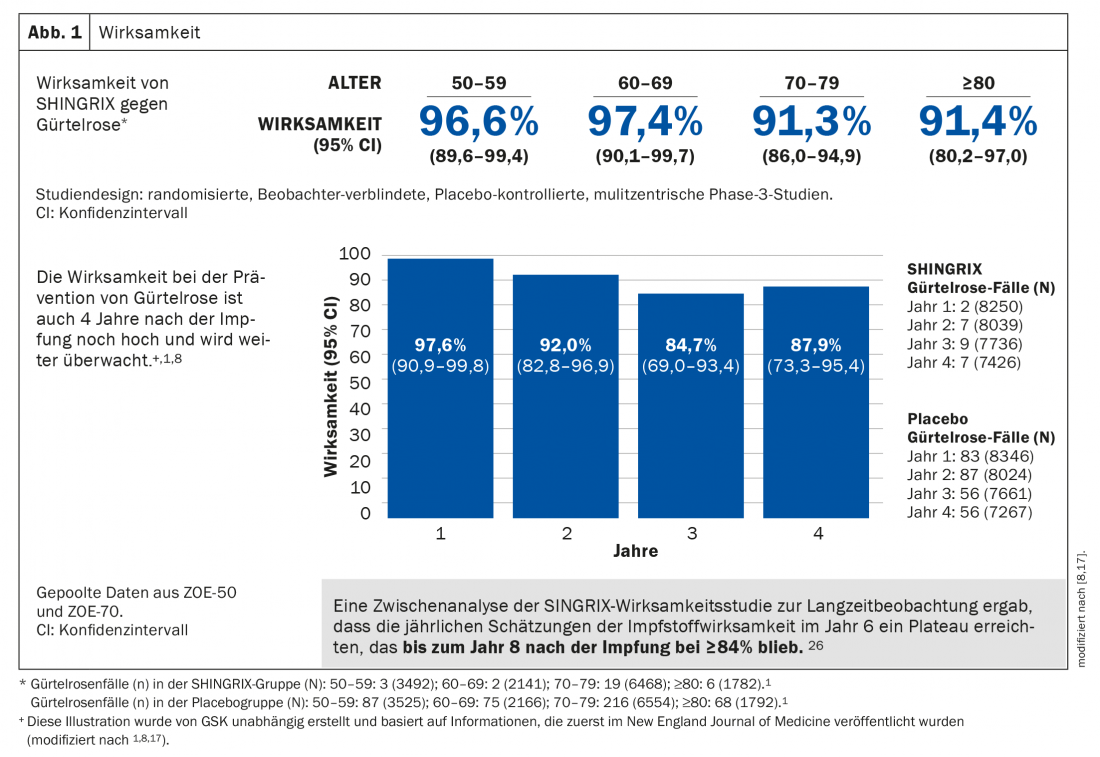
Le vaccin sous-unité adjuvanté a montré une efficacité de plus de 90% dans la prévention du zona dans tous les groupes d’âge à partir de 50 ans, qui se maintient à un niveau très élevé après plus de sept ans. De même, le risque de développer une PHN est considérablement réduit (Fig. 1) [1]. L’innocuité a été largement évaluée dans deux études cliniques de phase 3 à grande échelle. La majorité des événements indésirables étaient d’intensité légère à modérée et comprenaient notamment des douleurs, des rougeurs et des gonflements au site d’injection. Les patients peuvent également souffrir de douleurs musculaires, d’épuisement, de maux de tête, de frissons, de fièvre ou de maux d’estomac. Dans les études cliniques, ces effets indésirables ont duré en moyenne 2 à 3 jours [1,8,17].
Recommandations de vaccination de l’OFSP et de la CFV
La vaccination contre l’herpès zoster avec deux doses et un intervalle minimum de 1 à 2 mois se fait selon deux catégories de recommandations [25]: A Recommandation de vaccination complémentaire : La vaccination est recommandée pour toutes les personnes immunocompétentes âgées de ≥65 ans et plus, indépendamment de leurs antécédents individuels de varicelle et d’herpès zoster. Deux doses sont recommandées, avec un intervalle minimum de deux mois.
B Recommandation de vaccination pour deux groupes à risque définis :
B1 : La vaccination est recommandée pour tous les patients âgés de ≥50 ans présentant une immunodéficience actuelle ou future (notamment cellulaire) associée à un risque accru de zona. Deux doses sont recommandées, avec un intervalle minimum de deux mois.
B2 : La vaccination est recommandée pour les patients âgés de ≥18 ans qui souffrent actuellement d’une immunodéficience grave ou qui reçoivent actuellement ou recevront dans un avenir prévisible un traitement immunosuppresseur. La première dose doit idéalement être administrée ≥4 semaines avant le début supposé, attendu ou prévu d’une immunosuppression sévère. La deuxième dose avec un intervalle minimum d’un à deux mois après la première dose ou dès que possible à un moment ultérieur favorable d’un point de vue médical pendant ou après le traitement.
SHINGRIX® est exclusivement destiné à être injecté par voie intramusculaire, uniquement à titre prophylactique et non pour le traitement de la maladie clinique confirmée. Le vaccin peut être administré en même temps qu’un vaccin grippal saisonnier non adjuvanté, un vaccin polysaccharidique pneumococcique 23-valent (PPV23) ou un vaccin diphtérie-tétanos-coqueluche acellulaire à teneur réduite en antigène (dTpa) (site d’injection différent). La réponse immunitaire (2 doses) n’a pas été affectée par la vaccination préalable avec un vaccin vivant HZ atténué [1]. Un intervalle minimum entre une vaccination par ARNm COVID et l’administration d’autres vaccins n’est pas nécessaire, comme pour tous les autres vaccins non-vivants [24].
Source : GlaxoSmithKline AG
Littérature :
- Information professionnelle Shingrix. www.swissmedicinfo.ch, consulté en octobre 2021.
- Commission fédérale pour les vaccinations (CFV). Évaluation de la vaccination contre l’herpès zoster selon les critères d’analyse des recommandations nationales de vaccination en Suisse. 14 décembre 2015 ; 1-34.
- Hillebrand K, Bricout H, Schulze-Rath R, et al : Incidence de l’herpès zoster et de ses complications en Allemagne 2005-2009. Journal of Infection 2015 Feb ; Vol 70 : 178-186.
- Kawai K, Gebremeskel BG, Acosta CJ : Systematic review of incidence and complications of herpes zoster : towards a global perspective. BMJ Open 2014 Jun;4(6) : e004833.
- Mahalingam R, Wellish M, Wolf W, et al : ADN viral latent de varicelle-zona dans les ganglions trigéminaux et thoraciques humains. N Engl J Med 1990 Sep ; 323(10) : 627-631.
- Weinberg A, Lazar AA, Zerbe GO, et al : Influence de l’âge et de la nature de la primo-infection sur les réponses immunitaires cellulaires spécifiques au virus varicelle-zona. J Infect Dis. 2010 ; 201(7) : 1024-1030.
- Kimberlin DW, Whitley RJ : Vaccin contre le varicelle-zona pour la prévention du zona. N Engl J Med. 2007 Mar;356(13) : 1338-1343.
- Cunningham AL, Lal H, Kovac M, et al : Efficacy of the herpes zoster subunit vaccine in adults 70 years of age or older. N Engl J Med 2016 Sep ; 375(11) : 1019-1032.
- Levin MJ : Sénescence immunitaire et vaccins pour la prévention du zona chez les personnes âgées. Curr Opin Immunol 2012 août ; 24(4) : 494-500.
- Patterson-Bartlett J, Levin MJ, Lang N, et al : Phenotypic and functional characterization of ex vivo T cell responses to the live attenuated herpes zoster vaccine. Vaccine 2007 Oct ; 25(41) : 7087-7093.
- Lungu O, Annunziato PW, Gershon A, et al : Virus de la varicelle-zona réactivé et latent dans la racine ganglionnaire dorsale humaine. Proc Natl Acad Sci USA 1995 Nov ; 92(24) : 10980-10984.
- Furuta Y, Takasu T, Fukuda S, et al : Détection de l’ADN du virus varicelle-zona dans le ganglion géniculé humain par réaction de polymérisation en chaîne. J Infect Dis 1992 Nov ; 166(5) : 1157-1159.
- Volpi A : Complications graves de l’herpès zoster. Herpès 2007 Sep ; 14 Suppl 2 : 35-39.
- Yawn BP, Wollan P, Kurland MJ, et al : Herpes Zoster Recurrences More Frequent Than Previously Reported. Mayo Clin Proc. février 2011;86(2) : 88-93.
- Chlibek R, Smetana J, Pauksens K, et al : Sécurité et immunogénicité de trois formulations différentes d’un vaccin candidat adjuvé contre le virus de la varicelle et du zona chez les adultes âgés : une étude de phase II, randomisée et contrôlée. Vaccine 2014 Mar ; 32(15) : 1745-1753.
- Bharucha T, Ming D, Breuer J : A critical appraisal of ‘Shingrix’, a novel herpes zoster subunit vaccine (HZ/Su or GSK1437173A) for varicella zoster virus. Hum Vaccin Immunother. 2017 Aug;13(8) : 1789-1797.
- Lal H, Cunningham AL, Godeaux O, et al : Efficacité d’un vaccin adjuvanté contre le zona chez les adultes âgés. N Engl J Med 2015 May ; 372(22) : 2087-2096.
- Schwarz TF, Volpe S, Catteau G, et al : Persistance de la réponse immunitaire à un vaccin adjuvé contre le virus varicelle-zona jusqu’à l’âge de neuf ans chez les adultes âgés. Hum Vaccin Immunother 2018 Jun ; 14(6) : 1370-1377.
- Merck Sharp & Dohme. Zostavax European public assessment report, Annex I : Summary of product characteristics : EMA ; [updated January 2019 ; accessed December 2020]. Disponible à partir de : www.ema.europa.eu/en/documents/product-information/zostavaxepar-product-information_en.pdf.
- Lecrenier N, Beukelaers P, Colindres R, et al : Développement du vaccin adjuvanté recombinant contre le zona et ses implications pour la prévention des shingles. Expert Review of Vaccines 2018 ; 17(7) : 619-634.
- Dendouga N, Fochesato M, Lockman L, et al : Réponses immunitaires à médiation cellulaire à un vaccin contre la glycoprotéine E du virus varicelle-zona en utilisant à la fois un agoniste TLR et QS21 chez la souris. Vaccine. 2012 avr;30(20) : 3126-3135.
- Leroux-Roels G, Marchant A, Levy J, et al : Impact des adjuvants sur les réponses des cellules T CD4(+) et des cellules B à un vaccin antigénique protéique : résultats d’un essai de phase II, randomisé, multicentrique. Clin Immunol 2016 Aug ; 169 : 16-27.
- US Food and Drug Administration ; Vaccines and Related Biological Products Advisory Committee. Document d’information : Shingrix (Zoster Vaccine Recombinant, Adjuvanted). 2017 [accessed December 2020]. Disponible à partir de : www.fda.gov/media/107553/download.
- OFSP : Recommandation de vaccination pour les vaccins ARNm contre le Covid-19 (état au 14.09.2021), consulté sur%20gegen%en sept. 2021.
- OFSP : Nouvelles recommandations pour la vaccination contre l’herpès zoster : vaccin SHINGRIX. Bulletin de l’OFSP 47/2021;22 : 9-15.
- Boutry C, et al : Le vaccin adjuvanté contre le zona recombinant confère une protection à long terme contre le zona : Résultats provisoires d’une étude d’extension des essais cliniques pivots de phase III (ZOE-50 et ZOE-70). Clin Inf Dis 2021 : 1-30.
PRATIQUE DU MÉDECIN DE FAMILLE 2022 ; 17(3) : 32-33