L’hypertension pulmonaire dans les cardiopathies gauches est dans la plupart des cas due à une augmentation passive de la pression due à une augmentation des pressions de remplissage du côté gauche. Alors que l’hypertension pulmonaire post-capillaire isolée est fréquente, seul un petit groupe de patients est touché par une maladie vasculaire pulmonaire grave.
Alors que l’hypertension artérielle pulmonaire idiopathique reste un zèbre dans le vaste domaine de l’hypertension pulmonaire (HTP), 65 à 80% des patients atteints d’HTP ont une maladie du cœur gauche à l’origine de l’augmentation de la pression dans la petite circulation (ci-après abrégée en PH-LHD pour Left Heart Disease) [20]. Les principaux cliniciens et scientifiques dans le domaine de l’HTP font la distinction entre l’HTP-LHD avec un phénotype ventriculaire gauche et l’HTP-LHD avec un phénotype ventriculaire droit, le type ventriculaire gauche faisant référence à la présence d’une HTP post-capillaire isolée (IpcPH) et le type ventriculaire droit à la présence d’une HTP post et pré-capillaire combinée (CpcPH). Alors que l’HIPC est fréquente, seul un petit groupe de patients (<10%) est atteint d’une maladie vasculaire pulmonaire grave (HVPC). On pense que le passage du phénotype ventriculaire gauche au phénotype ventriculaire droit est fluide et qu’il est causé par ce que l’on appelle le remodelage des petites artères pulmonaires du lit vasculaire pulmonaire. Cet article de synthèse examinera plus en détail les critères diagnostiques, leurs limites et imprécisions, ainsi que les options thérapeutiques possibles pour la PH-LHD.
Définition, physiopathologie et diagnostic
L’HTP est un problème fréquent et important pour le pronostic des patients atteints de cardiopathie gauche. Elle est associée à une réduction des performances, ainsi qu’à une augmentation de la morbidité et de la mortalité [15]. Selon les directives actuelles, l’HTP-LHD est classée dans le groupe 2 de l’OMS sur un total de 5 groupes d’HTP (groupe 1 : hypertension artérielle pulmonaire (HTAP), 2 : HTP dans les cardiopathies gauches, 3 : HTP dans les pneumopathies ou l’hypoxie, 4 : HTP thromboembolique chronique, 5 : HTP d’attribution incertaine ou de mécanisme multifactoriel) [7]. Tout d’abord, l’HTP résulte d’une congestion passive, dite post-capillaire, des pressions de remplissage du côté gauche – et surtout de l’oreillette gauche. Ce reflux est associé à une augmentation de la perméabilité de la membrane alvéolo-capillaire et peut provoquer un œdème pulmonaire interstitiel et alvéolaire. L’HTP peut survenir chez les patients atteints d’insuffisance cardiaque gauche avec une fonction de pompe réduite (HFrEF), mais aussi avec une fonction de pompe préservée (HFpEF) ou des défauts valvulaires. La prévalence de l’HTP chez les HFrEF est estimée entre 40-75% [8,17] et chez les HFpEF entre 36-83% [13,22].
On suppose que chez certains patients – dans le sens d’une séquence physiopathologique temporelle – l’augmentation permanente et passive de la pression dans la circulation pulmonaire peut conduire à un remodelage (irréversible) des vaisseaux artériels pulmonaires et donc à une maladie vasculaire pulmonaire et finalement à une insuffisance cardiaque droite. On ne sait toutefois pas exactement chez quels patients cela se produit et chez quels patients cela ne se produit pas. Comme pour de nombreuses maladies, une prédisposition génétique est suspectée en plus des facteurs environnementaux, mais elle n’a pas encore été prouvée.
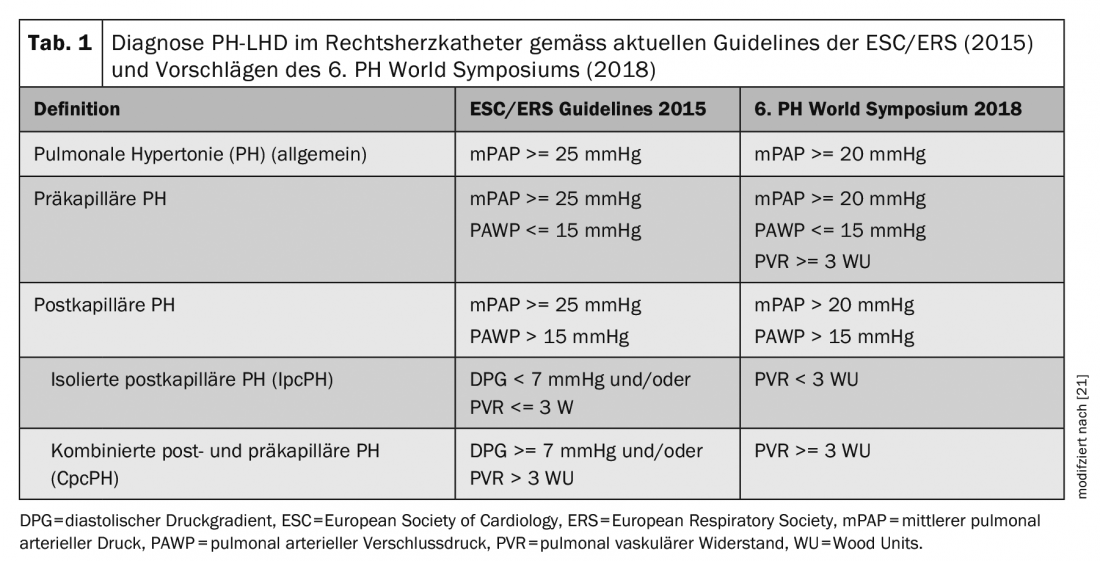
Selon les directives actuelles [7], une HTP post-capillaire est diagnostiquée lorsque le cathéter cardiaque droit mesure une pression artérielle pulmonaire moyenne (PAPm) >= 25 mmHg et une pression artérielle pulmonaire occlusive (PAPO) >15 mmHg. Le gradient de pression diastolique (PAP diastolique – PAWP) et la résistance vasculaire pulmonaire (PVR = (mPAP-PAWP)/débit cardiaque) sont également déterminés afin de différencier davantage l’HIPC de l’HCP. Voir le tableau 1, où figurent également les nouveaux critères diagnostiques selon les propositions du 6e PH World Symposium [25]. Des études portant sur plus de 20 000 sujets ont montré qu’une mPAP comprise entre 21-24 mmHg est associée à une mortalité accrue, quel que soit le groupe de PH, y compris chez les patients souffrant d’insuffisance cardiaque gauche [3,5,16]. La valeur normale de la mPAP est de (moyenne +/- écart-type) 14 +/- 3 mmHg. Dans l’ensemble, ces études ont donc montré qu’au-delà du seuil de la moyenne + 2 écarts-types, il existe une valeur de maladie, raison pour laquelle les recommandations actuelles pour le diagnostic de l’HTP ont été modifiées lors du PH World Symposium, passant de mPAP >= 25 mmHg à >20 mmHg.
Tous les patients n’ont pas besoin d’un cathéter cardiaque droit
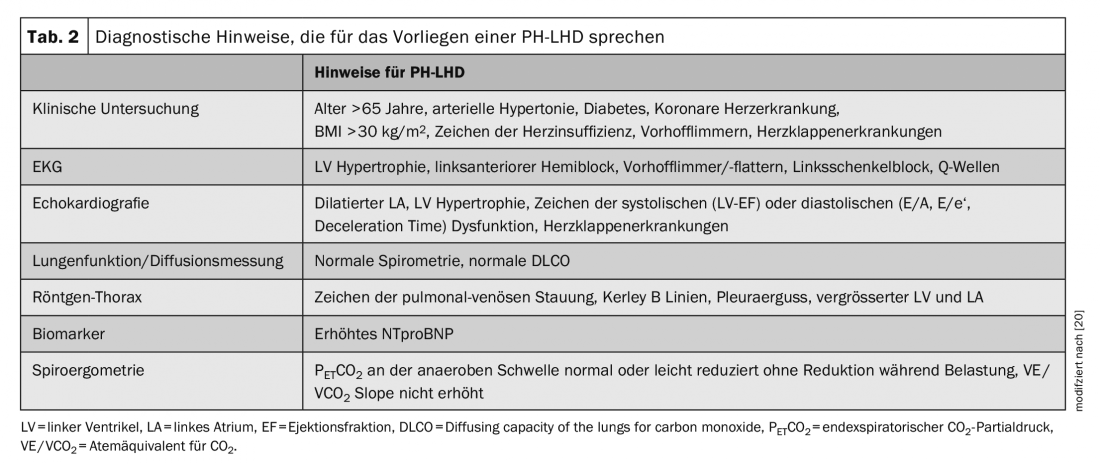
Si un patient présente une HTP, des examens non invasifs sont d’abord recommandés afin de mieux cerner la cause et de formuler une hypothèse de travail. En raison de la complexité du sujet, nous n’aborderons ici que la différenciation entre une HTAP et une HTP-LHD et négligerons les autres groupes d’HTP (groupes 2, 4 et 5), bien que ces diagnostics différentiels importants ne doivent pas être oubliés dans l’évaluation d’une HTP. Les examens et les résultats recommandés qui indiquent une PH-LHD sont listés dans le tableau 2.
Si l’échocardiographie révèle des signes d’une maladie vasculaire pulmonaire, notamment un rapport VG/LV élevé >= 1,0, indice d’excentricité LV >1,2, formation de l’apex par le ventricule droit, diamètre de la veine cave > 2 cm sans collapsus et une PAP systolique estimée à >50 mmHg, un cathétérisme cardiaque droit doit être effectué pour une différenciation plus poussée, même en présence des signes d’HTP mentionnés dans le tableau 2. S’il n’y a qu’une HTP légère ou aucun des signes échocardiographiques de la maladie vasculaire pulmonaire, il s’agit très probablement d’une HTP post-capillaire et il n’est pas indiqué de procéder à un examen invasif supplémentaire.
Limites et difficultés du cathétérisme cardiaque droit
La mesure correcte de la PAWP est essentielle pour le diagnostic de l’HTP en tant que tel et pour différencier une éventuelle composante précapillaire. Il existe ici des limites et des imprécisions que l’enquêteur doit connaître et prendre en compte lors de l’interprétation des résultats.
La mesure de la PAWP n’est pas réalisable chez tous les patients (la position “wedge” ne peut pas être atteinte en cas de dilatation des artères pulmonaires, par exemple). Dans ces cas, notamment en cas de forte suspicion d’HTP, il est recommandé de mesurer directement la pression diastolique finale du ventricule gauche (PEDVG) dans le cathéter cardiaque gauche.
Une détermination incorrecte du point zéro peut également entraîner des erreurs de mesure. Le point zéro doit être situé en position mito-thoracique, au niveau de l’oreillette gauche [11]. En présence d’une déformation du thorax, il peut être extrêmement difficile de déterminer le point zéro.
Les experts ne sont pas d’accord sur la mesure du PAWP. Alors que de nombreux cardiologues préfèrent mesurer le repos à la fin de l’expiration normale, les experts en HTP sont plutôt d’avis que les courbes de PAWP doivent également être moyennées sur plusieurs cycles respiratoires, notamment pour pouvoir comparer les valeurs au repos avec les valeurs à l’effort [12]. La rétention de la respiration ou la respiration forcée entraîne une altération des valeurs (pression intrathoracique, Valsalva, etc.). Chez les patients souffrant de maladies pulmonaires, telles que le diabète de type 2, la maladie d’Alzheimer et le cancer du poumon. BPCO, les courbes de pression présentent des variations respiratoires proéminentes. Dans ces cas, il est recommandé de calculer la moyenne des courbes de pression sur plusieurs cycles respiratoires.
Même en présence d’une fibrillation auriculaire ou d’une onde v élevée indiquant une régurgitation mitrale, il existe un risque de mesure erronée de la PAWP. L’obésité abdominale peut également fausser les mesures en augmentant la pression intra-abdominale et intrathoracique.
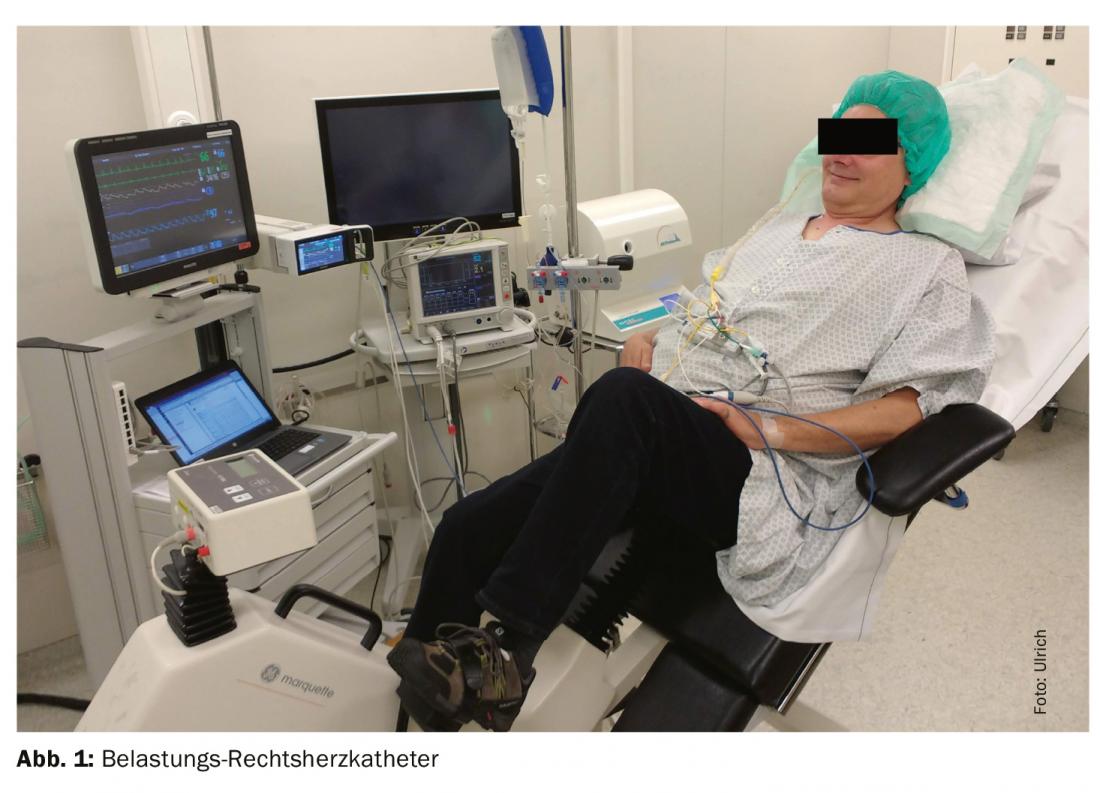
Enfin, le cathéter cardiaque droit ne doit être réalisé qu’en cas de maladie compensée, c’est-à-dire en l’absence de rétention d’eau cardiaque. Chez un patient bien contrôlé en normovolémie, la pression hydrostatique dans la petite circulation devrait être normale et l’HTP au repos ne devrait pas être présente. Néanmoins, un patient trop “sec” peut également présenter des pressions PAWP faussement profondes et donc classer à tort une HTP post-capillaire comme précapillaire. Pour démasquer une HTP occulte, il est recommandé de réaliser une épreuve d’effort complémentaire en administrant un volume ou en effectuant une épreuve d’effort (bicyclette ergométrique, fig. 1), surtout si la pression PAWP est limite (13-15 mmHg). Il n’existe cependant pas encore de méthodes de mesure standardisées et validées à cet effet [25]. Ces examens et l’interprétation des résultats pouvant être très complexes, il est recommandé de les adresser à un centre tertiaire expérimenté en PH.
Thérapie
Étant donné que dans la plupart des cas d’HTP-LHD, il s’agit d’une HTP passive, post-capillaire, l’objectif thérapeutique principal de toutes les HTP-LHD est un ajustement optimal du traitement de l’insuffisance cardiaque ainsi que la normalisation des pressions de remplissage. Il s’agit notamment d’un traitement diurétique intensif, d’un traitement médicamenteux de l’insuffisance cardiaque et d’interventions (CRT, DAI, LVAD, MitraClip, etc.).
HFrEF : Selon les directives actuelles [19], un traitement médicamenteux comprenant des inhibiteurs de l’ECA/antagonistes des récepteurs de l’angiotensine II, des inhibiteurs de la néprilysine, des bêtabloquants et des antagonistes des récepteurs des minéralocorticoïdes est recommandé. L’essentiel est avant tout d’atteindre les doses cibles prévues et d’obtenir une bonne adhérence au traitement. Les premiers résultats de l’étude sur la dapagilfozine, un inhibiteur de SGLT2, sont prometteurs [27]. En outre, l’accent est mis sur un contrôle adéquat de la fréquence cardiaque, qui peut être complété par l’ivabradine en cas d’effet insuffisant du bêtabloquant. Si le traitement médicamenteux ne suffit pas, une thérapie de resynchronisation cardiaque peut être indiquée.
HFpEF : le traitement de l’HFpEF reste un défi. Il n’existe à ce jour aucune bonne thérapie basée sur des preuves et pour laquelle un succès thérapeutique a été démontré. Le récent essai PARAGON-HF (valsartan vs Entresto) n’a pas non plus atteint un critère d’évaluation primaire significatif [23]. En principe, dans l’état actuel des connaissances, le traitement de la rigidité du ventricule gauche et de la dysfonction diastolique recommande l’optimisation du contrôle de la pression artérielle et un traitement diurétique intensif pour contrôler l’équilibre volumétrique. Il faut également penser à exclure une amylose cardiaque en présence d’une FHPF.
Insuffisance valvulaire mitrale fonctionnelle : En présence d’une insuffisance valvulaire mitrale fonctionnelle due à une dilatation des cavités cardiaques du côté gauche, celle-ci n’est pas seulement associée à une mortalité accrue [4], mais doit également être considérée comme une cause possible d’HTP. Une amélioration significative de l’hémodynamique chez les patients atteints d’HFrEF a été démontrée après reconstruction de la valve mitrale [6]. Il convient néanmoins de noter que les patients atteints d’HTP présentent des taux de mortalité plus élevés lors des interventions par clip mitral [24].
Dispositif d’assistance ventriculaire gauche (DAVG) : le DAVG doit également être brièvement mentionné ici, car il constitue une option thérapeutique en cas de FHFR avancée. L’augmentation de l’éjection ventriculaire gauche permet de soulager le VG, ce qui vise à normaliser l’hémodynamique. Chez 30% de tous les patients présentant une HTP fixée (c’est-à-dire une composante vasculaire pulmonaire), l’utilisation de l’appareillage et des inotropes avant la transplantation cardiaque a permis de normaliser l’hémodynamique pulmonaire [2].
Capteur de pression implantable – CardioMEMS : l’utilisation de capteurs de pression implantables a permis de démontrer qu’une décompensation “hémodynamique” survient environ 2 à 3 semaines avant la décompensation clinique. Une surveillance ciblée de la pression pulmonaire par CardioMEMS a permis de réduire de manière significative le taux d’hospitalisation des patients atteints d’HFpEF et d’HFrEF grâce à une intervention médicamenteuse précoce (diurétiques) [1].
Traitement ciblé de l’HTP : les traitements existants pour l’HTP (antagonistes des récepteurs de l’endothéline (ERA), prostanoïdes, inhibiteurs de la phosphodiestérase 5 (inhibiteurs de la PDE-5), stimulateurs solubles de la guanylate cyclase (sGC)) ne sont pas autorisés pour l’HTP. Même les directives actuelles ne recommandent généralement pas de thérapie PH ciblée chez les patients atteints de LHD PH (III-C) [7].
Néanmoins, dans des cas sélectionnés, en présence d’une composante vasculaire pulmonaire significative avec une PVR nettement plus élevée, un essai thérapeutique peut être réalisé avec une médication PH ciblée (recommandation IIa-C). Ces réflexions sont principalement basées sur de petites séries de cas et de données de registres concernant le sildénafil, un inhibiteur de la PDE-5, qui a notamment entraîné une réduction du RVP et une amélioration de la fonction ventriculaire droite chez les patients atteints d’HPC [9,10,14,26] ainsi que sur les résultats du registre européen Compera [18]. Le raisonnement sous-jacent est qu’une IPAH rare concomitante (zèbre) peut être présente en même temps qu’une insuffisance cardiaque fréquente (cheval).
En revanche, diverses grandes études randomisées ont montré des résultats neutres, voire des aggravations, lorsque des traitements ciblés de l’HTAP sont administrés à des patients non sélectionnés souffrant d’insuffisance cardiaque gauche sans composante essentielle de l’HTP. Un résumé des études récemment achevées et des études en cours est disponible dans les commentaires actuels du PH Worldsymposium [25]. La principale critique formulée à l’encontre des études achevées à ce jour est le manque de différenciation hémodynamique claire, la plupart des patients inclus étant des patients atteints d’IpcPH et parfois des patients atteints d’HFpEF sans HTP. L’effet délétère de la médication de l’HTP chez les patients souffrant d’HTP post-capillaire isolée est probablement dû à une tentative de vasodilatation pulmonaire par l’effet de la médication, avec une augmentation consécutive du débit sanguin pulmonaire, qui peut entraîner un œdème pulmonaire et une décompensation cardiaque chez les patients présentant des pressions de remplissage élevées préexistantes du côté gauche.
En résumé, chez les patients souffrant d’HTP post-capillaire isolée (IpcPH), la thérapie ciblée de l’HTP ne devrait pas être utilisée et peut même être nocive. Les patients atteints de CpcPH qui pourraient bénéficier d’un traitement devraient être adressés à un centre de PH où ils pourraient être évalués par des experts et traités, idéalement dans le cadre d’études.
Messages Take-Home
- L’hypertension pulmonaire dans les cardiopathies gauches (PH-LHD) est fréquente et, dans la plupart des cas, elle est due à une augmentation passive de la pression due à une augmentation des pressions de remplissage du côté gauche.
- Si l’on soupçonne une composante pré-capillaire/une maladie vasculaire pulmonaire, il convient de procéder à un examen plus approfondi par cathétérisme cardiaque droit.
- Un traitement spécifique de l’HTP peut être envisagé par l’expert du centre d’HTP chez les patients présentant une composante pré-capillaire significative, car il peut être difficile de faire la distinction avec l’hypertension artérielle pulmonaire idiopathique, qui est rare.
Littérature :
- Abraham WT, Stevenson LW, Bourge RC, et al. : Sustained efficacy of pulmonary artery pressure to guide adjustment of chronic heart failure therapy : complete follow-up results from the CHAMPION randomised trial. Lancet 387 : 453-461, 2016.
- Al-Kindi SG, Farhoud M, Zacharias M, et al. : Left Ventricular Assist Devices or Inotropes for Decreasing Pulmonary Vascular Resistance in Patients with Pulmonary Hypertension Listed for Heart Transplantation. Journal of cardiac failure 23 : 209-215, 2017.
- Assad TR, Maron BA, Robbins IM, et al. : Effet pronostique et évaluation hémodynamique longitudinale de l’hypertension pulmonaire borderline. JAMA Cardiology 2 : 1361-1368, 2017.
- Bursi F, Barbieri A, Grigioni F, et al : Implications pronostiques de la régurgitation mitrale fonctionnelle en fonction de la sévérité de l’insuffisance cardiaque chronique sous-jacente : une étude à long terme. 12 : 382-388, 2010.
- Douschan P, Kovacs G, Avian A, et al : Mild Elevation of Pulmonary Arterial Pressure as a Predictor of Mortality. 197 : 509-516, 2018.
- Gaemperli O, Moccetti M, Surder D, et al : Acute haemodynamic changes after percutaneous mitral valve repair : relation to mid-term outcomes. 98 : 126-132, 2012.
- Galie N, Humbert M, Vachiery JL, et al. : 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension : The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS) : Endorsed by : Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). European heart journal 37 : 67-119, 2016.
- Ghio S, Gavazzi A, Campana C, et al : Independent and additive prognostic value of right ventricular systolic function and pulmonary artery pressure in patients with chronic heart failure. Journal of the American College of Cardiology 37 : 183-188, 2001.
- Guazzi M, Vicenzi M, Arena R, Guazzi MD : Pulmonary hypertension in heart failure with preserved ejection fraction : a target of phosphodiesterase-5 inhibition in a 1-year study. Circulation 124 : 164-174, 2011.
- Hoendermis ES, Liu LC, Hummel YM, et al. : Effects of sildenafil on invasive haemodynamics and exercise capacity in heart failure patients with preserved ejection fraction and pulmonary hypertension : a randomized controlled trial. European heart journal 36 : 2565-2573, 2015.
- Kovacs G, Avian A, Pienn M, et al : Lecture des tracés de pression vasculaire pulmonaire. Comment gérer les problèmes du niveau zéro et des oscillations respiratoires. American journal of respiratory and critical care medicine 190 : 252-257, 2014.
- Kovacs G, Herve P, Barbera JA, et al. : An official European Respiratory Society statement : pulmonary haemodynamics during exercise. The European respiratory journal 50 : 2017.
- Lam CS, Roger VL, Rodeheffer RJ, et al : Pulmonary hypertension in heart failure with preserved ejection fraction : a community-based study. Journal of the American College of Cardiology 53 : 1119-1126, 2009.
- Lewis GD, Shah R, Shahzad K, et al : Sildenafil improves exercise capacity and quality of life in patients with systolic heart failure and secondary pulmonary hypertension. Circulation 116 : 1555-1562, 2007.
- Luscher TF : Pulmonary embolism and pulmonary hypertension : two issues often neglected in cardiology. European heart journal 36 : 581-583, 2015.
- Maron BA, Hess E, Maddox TM, et al. : Association of Borderline Pulmonary Hypertension With Mortality and Hospitalization in a Large Patient Cohort : Insights From the Veterans Affairs Clinical Assessment, Reporting, and Tracking Program. Circulation 133 : 1240-1248, 2016.
- Miller WL, Grill DE, Borlaug BA : Clinical features, heodynamics, and outcomes of pulmonary hypertension due to chronic heart failure with reduced ejection fraction : pulmonary hypertension and heart failure. JACC Insuffisance cardiaque 1 : 290-299, 2013.
- Opitz CF, Hoeper MM, Gibbs JS, et al : Hypertension pulmonaire pré-capillaire, combinée et post-capillaire : un continuum pathophysiologique. Journal of the American College of Cardiology 68 : 368-378, 2016.
- Ponikowski P, Voors AA, Anker SD, et al. : 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure : The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Développé avec la contribution spéciale de l’Association pour l’insuffisance cardiaque (HFA) de l’ESC. Eur J Heart Fail 18 : 891-975, 2016.
- Rosenkranz S, Gibbs JS, Wachter R, et al : Left ventricular heart failure and pulmonary hypertension. European heart journal 37 : 942-954, 2016.
- Rosenkranz S, Kramer T, Gerhardt F, et al : Pulmonary hypertension in HFpEF and HFrEF : Pathophysiology, diagnosis, treatment approaches. Cœur 2019.
- Shah AM, Shah SJ, Anand IS, et al. : Structure et fonction cardiaques dans l’insuffisance cardiaque avec fraction d’éjection préservée : résultats de base de l’étude échocardiographique de l’essai de traitement de l’insuffisance cardiaque avec fonction préservée par un antagoniste de l’aldostérone. Circulation Heart failure 7 : 104-115, 2014.
- Solomon SD, McMurray JJV, Anand IS, et al : Angiotensin-Neprilysin Inhibition in Heart Failure with Preserved Ejection Fraction. The New England journal of medicine 2019.
- Tigges E, Blankenberg S, von Bardeleben RS, et al. : Implication de l’hypertension pulmonaire chez les patients sous traitement par MitraClip : résultats de l’enregistrement allemand des interventions sur valve mitrale transcathéter (TRAMI). 20 : 585-594, 2018.
- Vachiery JL, Tedford RJ, Rosenkranz S, et al : Hypertension pulmonaire due à une maladie du cœur gauche. The European respiratory journal 53 : 2019.
- Wu X, Yang T, Zhou Q, Li S, Huang L : Utilisation supplémentaire d’un inhibiteur de la phosphodiestérase 5 chez les patients souffrant d’hypertension pulmonaire secondaire à une insuffisance cardiaque systolique chronique : une méta-analyse. Eur J Heart Fail 16 : 444-453, 2014.
- www.escardio.org/The-ESC/Press-Office/Press-releases/dapagliflozin-reduces-death-and-hospitalisation-in-patients-with-heart-failure, dernière consultation le 03.09.2019).
CARDIOVASC 2019 ; 18(6) : 11-15











