Une fois de plus, la Conférence européenne sur le cancer du poumon s’est tenue à Genève. Cette fois encore, l’accent a surtout été mis sur le cancer du poumon non à petites cellules. Les thérapies qui ciblent les variants mutés et non mutés de l’EGFR sont étudiées seules ou en combinaison avec la chimiothérapie. Plusieurs de ces médicaments sont déjà autorisés dans l’UE et aux États-Unis. En outre, une approche innovante de l’immunologie a été discutée avec un traitement du mésothéliome.
Les choses bougent dans le traitement du cancer du poumon non à petites cellules (NSCLC). Lors du congrès, les résultats des études sur l’osimertinib ont été abordés. Il s’agit d’un puissant inhibiteur irréversible de la tyrosine kinase EGFR de troisième génération, déjà approuvé aux États-Unis et dans l’UE (pas encore en Suisse). Deux late breaking abstracts ont confirmé son efficacité dans le NSCLC muté EGFR, notamment en présence d’une mutation T790M. Une mise à jour de l’AURA P1 (phase I) et des données regroupées de l’AURA extension et de l’AURA 2 (toutes deux des études de phase II) ont montré les résultats suivants pour l’osimertinib à la dose recommandée de 80 mg/j (par voie orale) :
- Sur les 63 patients de l’AURA P1, 71% ont présenté une réponse objective qui a duré 9,6 mois en moyenne. La survie sans progression a été de 9,7 mois. Les effets secondaires causaux les plus fréquents ont été les éruptions cutanées (37%, aucun de grade 3) et les diarrhées (35%, dont 2% de grade 3).
- Sur les 411 patients des deux études de phase II regroupées, 66% ont présenté une réponse objective (selon la revue indépendante) qui s’est maintenue pendant 12,5 mois en moyenne. La survie sans progression a été de 11 mois. Après un an, 47,5% des participants n’avaient toujours pas progressé. Là encore, l’éruption cutanée (41%, dont 1% de grade 3) et la diarrhée (38%, dont 1% de grade 3) ont été les effets secondaires causaux les plus fréquents.
Les données groupées de la phase II confirment clairement les résultats de l’AURA P1 et des publications précédentes, ont déclaré les présentateurs. Chez les patients atteints de NSCLC avancé et de la mutation T790M de l’EGFR qui ont progressé sous un précédent traitement par EGFR-TKI, l’osimertinib 80 mg/d permet d’obtenir un taux de réponse élevé sur une durée relativement longue, avec une survie sans progression encourageante (surtout par rapport aux quatre à cinq mois sous chimiothérapie) et un profil d’effets secondaires contrôlable.
Selon les auteurs, le diagnostic moléculaire de la mutation T790M devrait désormais être la norme. Les données montreraient clairement que les patients présentant un mécanisme de résistance correspondant bénéficient de l’osimertinib.
L’osimertinib également efficace en première ligne
La deuxième présentation a montré les données de deux cohortes de phase I avec l’osimertinib à la dose de 80 ou 160 mg/j, administré cette fois en première ligne, c’est-à-dire chez 60 patients naïfs de traitement. Il s’agissait là aussi d’une mise à jour de l’étude AURA. Les patients avaient un NSCLC localement avancé ou métastasé, muté par EGFR (cinq d’entre eux étaient T790M-positifs). La durée médiane du suivi était de 16,6 mois. Le taux de réponse objective global était de 77% (67% dans la cohorte 80 mg et 87% dans la cohorte 160 mg). Les patients sont restés en médiane 19,3 mois sans progression. Au bout d’un an et demi, on a constaté une amélioration de la qualité de vie dans 55% des cas et dans 20% des cas respectivement. selon la cohorte, 57% (80 mg) et 53% (160 mg) n’ont pas progressé.
Les effets secondaires les plus fréquents étaient la diarrhée (60% et 87%, dont 0% et 7% de grade 3 ou plus), la stomatite (43% et 50%, dont 0% et 3% de grade 3 ou plus) et la paronychie (30% et 53%, dont 0% et 7% de grade 3 ou plus). A 10% (80 mg), respectivement 47% (160 mg) des patients ont dû réduire la dose pour maîtriser les effets secondaires.
La prise d’osimertinib modifie-t-elle la biologie des tumeurs ?
Les auteurs concluent que l’osimertinib présente également un potentiel en première ligne. Il s’agirait de l’un des meilleurs taux de réponse globale obtenus avec les traitements de première ligne des NSCLC à EGFR muté, et la survie sans progression dépasserait de loin l’expérience acquise avec les médicaments équivalents de première et deuxième génération (environ 10-13 mois). De nombreux patients n’ont pas encore montré de progression et continuent de bénéficier de l’osimertinib.
En outre, chez ceux dont la maladie progresse, la mutation T790M ne semble pas être responsable de la résistance, comme le montrent les données initiales. Il est donc possible que l’utilisation de l’osimertinib en première ligne modifie la biologie de la tumeur. Le profil de sécurité est bon, en particulier à la dose la plus faible (autorisée), un taux de 10% de patients avec des réductions de dose est considéré comme faible.
Autres études en préparation
L’inhibition de l’EGFR est actuellement la norme thérapeutique pour les patients atteints de NSCLC présentant des mutations activant l’EGFR. Via la mutation T790M, 50 à 60% des patients développent une résistance au traitement. L’osimertinib est particulièrement utile pour ces patients, car il inhibe puissamment les mutations EGFR initiales (exons 19 et 21), mais aussi la mutation EGFR-T790M. Avec l’osimertinib, la résistance peut être retardée, la tumeur doit apparemment chercher de nouveaux mécanismes de résistance en plus de la mutation EGFR-T790M. Une étude de phase III portant sur plus de 500 patients et comparant l’osimertinib à l’erlotinib et au gefitinib devrait permettre de clarifier les avantages de cet inhibiteur de troisième génération en première ligne. Les résultats sont attendus dans environ un an et demi.
Necitumumab – Les patients atteints de tumeurs exprimant l’EGFR en bénéficient le plus
En plus de l’osimertinib, de nouvelles données ont été publiées sur le necitumumab. Cet anticorps monoclonal cible également l’EGFR et est administré en association avec la chimiothérapie (gemcitabine et cisplatine) chez les patients atteints de CBNPC avec un carcinome épidermoïde avancé. Le necitumumab est déjà autorisé aux États-Unis et dans l’Union européenne.
Les données présentées au congrès provenaient de l’étude SQUIRE (phase III) et concernaient le sous-groupe de patients atteints de tumeurs exprimant l’EGFR (95% de la population évaluée [n=982]). Alors qu’aucun bénéfice n’a été observé chez les 5% de patients sans protéine EGFR, une amélioration significative de la survie globale et de la survie sans progression de 21% et 16% a été observée chez les 95% de patients présentant des tumeurs exprimant l’EGFR (par rapport à la chimiothérapie seule), soit un bénéfice légèrement supérieur à celui observé dans la population globale. C’est un résultat évident compte tenu du mécanisme d’action du necitumumab : là où il n’y a pas de récepteur et donc pas de cible, le médicament ne peut pas se lier. Selon l’EMA, le necitumumab n’est donc autorisé que pour les patients atteints de tumeurs exprimant l’EGFR, tandis que la FDA a pris sa décision sur la base de la population totale de SQUIRE et n’a pas précisé davantage l’autorisation.
Cette analyse de sous-groupe ne permet pas non plus de conclure avec certitude, car le groupe de patients ne présentant pas de tumeurs exprimant l’EGFR était nettement trop petit (5% ou seulement 47 patients) et le design de l’étude ne visait pas ces patients. Il faut attendre des études à plus grande échelle pour pouvoir dire avec certitude si les patients atteints de tumeurs EGFR négatives bénéficient également du necitumumab ou non.
Une bactérie peut-elle aider à lutter contre le mésothéliome ?
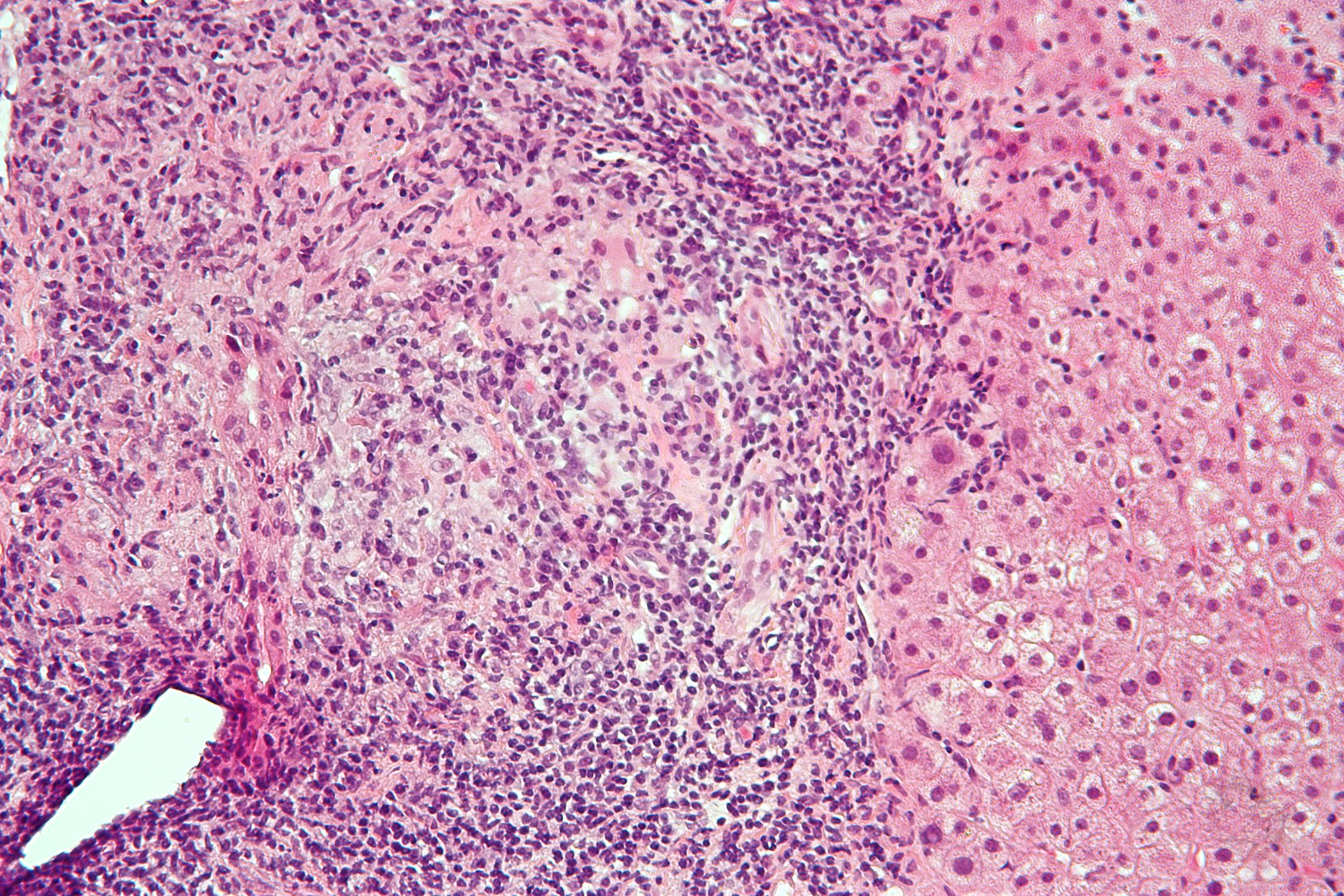
Le mésothéliome pleural malin est une maladie rare, mais très agressive et de mauvais pronostic. Le traitement est difficile et consiste actuellement de manière standard en du pemetrexed et une chimiothérapie à base de platine. Les taux de réponse obtenus sont d’environ 30%, ce qui signifie que le bénéfice en termes de survie est faible. De nouvelles approches thérapeutiques sont donc nécessaires. L’un d’eux promet l’immunothérapie avec une bactérie vivante appelée CRS-207, une forme atténuée de Listeria monocytogenes avec deux délétions de gènes, afin de réduire la pathogénicité. La bactérie a été conçue pour exprimer la mésothéline, un antigène surexprimé par différentes tumeurs, dont précisément le mésothéliome, et qui joue un rôle important dans la survie cellulaire. Ainsi, CRS-207 induirait une réponse anti-mésothéline et donc une réponse immunitaire adaptative propre à l’organisme et spécifique à la tumeur. Associée à la chimiothérapie, elle modifie le microenvironnement de la tumeur et permet une destruction immuno-médiée des cellules tumorales.
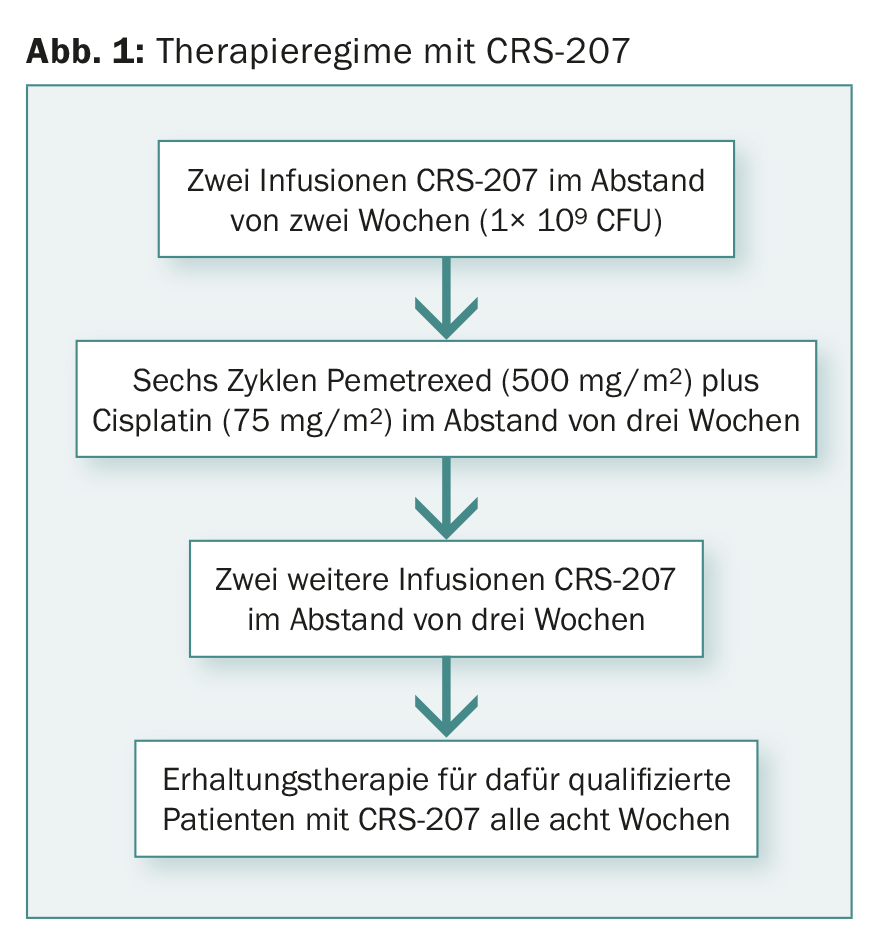
L’étude de phase Ib a porté sur des patients naïfs de chimiothérapie atteints d’un mésothéliome de la plaque avancé et non résécable. Au moment de la présentation, les données de 38 patients avaient été évaluées. La figure 1 montre le régime thérapeutique.
En immunohistochimie, on a constaté une augmentation des lymphocytes infiltrant la tumeur après le traitement par SRC. Après un suivi médian de 9,4 mois, 59% des personnes traitées ont présenté une réponse partielle. Pour 35%, la maladie était stable. Ensemble, cela donne un taux de contrôle de la maladie de 94%. En médiane, les patients ont vécu 8,5 mois sans progression.
Le traitement n’a pas été associé à des effets secondaires graves ou à des décès. Les symptômes les plus fréquemment rapportés sont la fièvre, la baisse de température/rigueur, l’hypotension, les nausées et les vomissements (grade 1 et 2). La plupart des effets secondaires étaient liés à la perfusion elle-même et ont disparu au bout de 24 heures.
La réponse immunitaire est effectivement stimulée
Une réponse de près de 60% avec un taux de contrôle global de la maladie de plus de 90% est encourageante, ont résumé les présentateurs. En outre, la nouvelle approche a permis de mesurer non seulement les lymphocytes infiltrant la tumeur, mais aussi les changements correspondants dans les cellules immunitaires circulantes et les biomarqueurs sériques. On a par exemple mesuré une augmentation des macrophages, des cellules infiltrantes CD8+ et des cellules tueuses naturelles. La réponse immunitaire spécifique et non spécifique visée, suivie d’une lutte synergique contre la tumeur en association avec la chimiothérapie, a donc pu être effectivement initiée.
Le traitement va maintenant faire l’objet d’études de phase III, car il semble à première vue donner de bien meilleurs résultats que la chimiothérapie seule. Le profil de sécurité et de tolérance de la nouvelle approche est également étonnamment bon, les toxicités cumulatives ne semblent pas se produire.
Source : ELCC 2016 European Lung Cancer Conference, 13-16 avril 2016, Genève
InFo ONKOLOGIE & HÄMATOLOGIE 2016 ; 4(4) : 30-32