La terapia del NSCLC ALK-positivo o ROS1-positivo si è sviluppata notevolmente negli ultimi anni con la disponibilità di vari inibitori di ALK o ROS1. In questo ECM, vengono riassunte e discusse le attuali linee guida ESMO e i dati degli studi più importanti.
Con 4300 nuove diagnosi all’anno, il carcinoma bronchiale è uno dei tipi di cancro più comuni in Svizzera [1]. La malattia è anche associata alla più alta (21,6%) mortalità legata al cancro negli uomini e alla seconda più alta (15,7%) nelle donne dopo il cancro al seno [1]. Il carcinoma polmonare non a piccole cellule (NSCLC) è presente nell’85% dei pazienti, più comunemente con istologia adenocarcinoma (40%). Inoltre, le fusioni della chinasi del linfoma anaplastico (ALK) possono essere rilevate in circa il 5% dei tumori e le fusioni del proto-oncogene ROS 1, chinasi del recettore tirosinico (ROS1) in circa il 4,5% [2]. Rispetto al resto della popolazione, i pazienti con NSCLC ALK- o ROS1-positivo sono più giovani e più spesso mai o poco fumatori [3,4]. Nel frattempo, il test del biomarcatore ALK/ROS1 è una componente consolidata nella diagnosi del NSCLC e costituisce una base necessaria per le decisioni terapeutiche [5]. Per i pazienti con malattia metastatica (stadio IV), il trattamento è di tipo palliativo e mira a migliorare i sintomi, a mantenere almeno la qualità di vita e a prolungare la sopravvivenza globale [6]. Con l’approvazione degli inibitori di ALK del 1. (Crizotinib), 2. (alectinib, ceritinib) e La terapia di terza generazione (lorlatinib) è stata rivoluzionata e personalizzata [7]. In questo ECM, vengono riassunte e discusse le attuali linee guida ESMO e i dati degli studi più importanti. L’attenzione si concentra qui sui farmaci approvati in Svizzera [8].
Terapia di prima linea
Le linee guida ESMO raccomandano l’uso di crizotinib, alectinib, ceritinib o brigatinib** in prima linea di terapia (Tab. 1) [5]. Nello studio PROFILE-1014, è stato osservato un prolungamento significativo della sopravvivenza mediana libera da progressione (PFS) con crizotinib rispetto alla chemioterapia con cisplatino o carboplatino in combinazione con pemetrexed (10,9 vs. 7,0 mesi, HR 0,45, p>0,001) [13]. I tassi di risposta obiettiva (ORR) sono stati del 74% con crizotinib e del 45% nel braccio di chemioterapia [13]. Dopo un periodo di osservazione di circa 46 mesi, la OS mediana nel braccio crizotinib non era ancora stata raggiunta ed era di 47,5 mesi con la chemioterapia (HR 0,76, p=0,0978). Sebbene crizotinib fosse numericamente superiore, non c’è stata una differenza statisticamente significativa nella OS tra i bracci di trattamento, molto probabilmente a causa di effetti di crossover o di terapie di follow-up molto efficaci dopo la progressione [14].
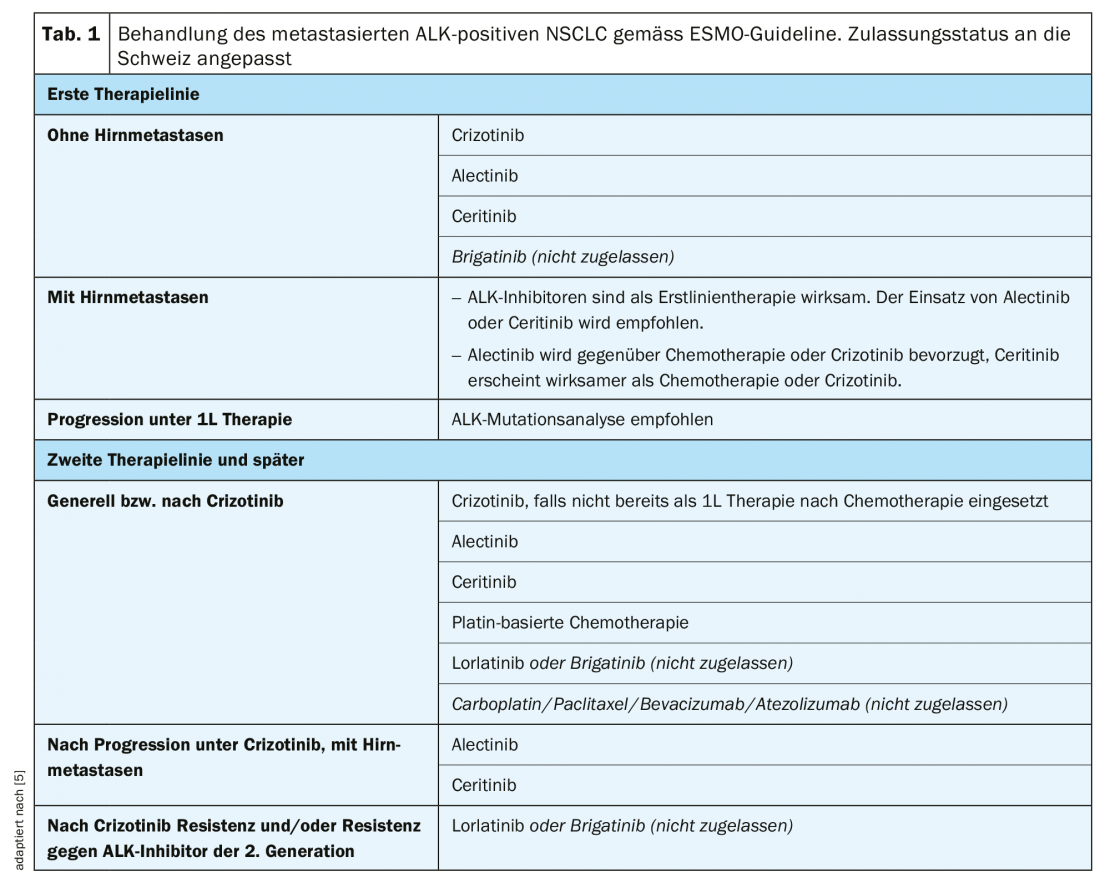
Come altra opzione nella terapia di prima linea, ceritinib ha mostrato una PFS mediana significativamente migliore (16,6 vs. 8,1 mesi, HR 0,55, p<0,00001) rispetto alla chemioterapia a base di platino (cisplatino o carboplatino più pemetrexed seguito da terapia di mantenimento con pemetrexed) nello studio ASCEND-4 [15]. La OS mediana non era ancora stata raggiunta con ceritinib ed era di 26,2 mesi con la chemioterapia (HR 0,73, p=0,056) [15].
Lo studio ALEX ha confrontato l’inibitore ALK di seconda generazione alectinib con crizotinib in pazienti precedentemente non trattati [16]. Alectinib ha mostrato una PFS mediana significativamente migliore rispetto a crizotinib (non raggiunto vs. 11,1 mesi, HR 0,47, p<0,001) [16]. Un risultato simile è stato raggiunto anche nello studio giapponese J-ALEX (alectinib, non raggiunto vs crizotinib, 10,2 mesi, HR 0,34, p>0,001) [17]. Alectinib è stato meglio tollerato in entrambi gli studi, con un minor numero di interruzioni, riduzioni della dose o sospensioni rispetto a crizotinib [16,17].
Sviluppo di mutazioni di resistenza
Praticamente tutti i pazienti con NSCLC ALK-positivo vanno incontro a progressione entro uno o due anni dalla terapia di prima linea con un inibitore di ALK a causa di una resistenza primaria o acquisita [5,18]. In questo contesto, la resistenza può essere dovuta a cambiamenti specifici di ALK (on-target), come mutazioni o amplificazioni del gene ALK, o ad altri meccanismi (off-target), come l’attivazione di vie di segnalazione alternative [18].
Circa il 20% dei pazienti che assumono crizotinib e più della metà di quelli che assumono un inibitore di ALK di seconda generazione (alectinib, ceritinib) sviluppano mutazioni di resistenza [18]. Lo spettro di resistenza dopo la progressione con crizotinib differisce significativamente da quello con gli inibitori ALK di seconda generazione [18] . Ad esempio, la mutazione ALK p.G1202R può essere rilevata solo nel 2% delle biopsie resistenti a crizotinib, ma si presenta come la mutazione di resistenza più comune tra gli inibitori ALK di seconda generazione, conferendo così la resistenza tumorale a tutti gli inibitori ALK di seconda generazione [18]. Ogni inibitore di ALK sembra anche essere associato a uno spettro specifico di mutazioni di resistenza [18]. Gli inibitori di ALK di terza generazione (lorlatinib e brigatinib) coprono un campo più ampio di mutazioni di resistenza ad ALK (compresa ALK p.G1202R) rispetto ai vecchi inibitori di ALK [18].
Terapia di seconda linea
La scelta della terapia dalla seconda linea in poi è fortemente influenzata dalle mutazioni di resistenza presenti. Un’analisi delle mutazioni sul DNA tumorale libero e circolante (ctDNA; la cosiddetta biopsia liquida) o su una nuova biopsia tissutale dovrebbe quindi essere utilizzata per determinare il meccanismo di resistenza in caso di progressione con un inibitore di ALK di prima o seconda generazione [19]. Questa procedura è suggerita anche dalle linee guida ESMO come parte del processo decisionale per la scelta della linea terapeutica successiva [5].
Rispetto alla chemioterapia, crizotinib ha migliorato significativamente la PFS mediana (7,7 vs. 3,0 mesi, HR 0,49, p<0,001) e l’ORR (65% vs. 20%) nello studio PROFILE-1007 in pazienti naïve all’inibitore ALK ma pretrattati con un regime a base di platino [20]. Crizotinib è raccomandato come linea di terapia successiva, se non è stato utilizzato in precedenza [5].
Nei pazienti pretrattati con chemioterapia e crizotinib, è stato osservato un miglioramento significativo della PFS mediana di 3,8 mesi con ceritinib rispetto alla chemioterapia nello studio ASCEND-5 (5,4 vs. 1,6 mesi, HR 0,49, p<0,0001) [21]. Alectinib ha anche ottenuto una PFS mediana significativamente prolungata di 9,6 mesi rispetto a 1,4 mesi con la chemioterapia nello studio ALUR in pazienti dopo chemioterapia e pre-trattamento con crizotinib (HR 0,15, p<0,001) [22]. Sulla base di questi dati, ceritinib o alectinib sono raccomandati come terapia di seconda linea dopo la progressione o l’intolleranza con crizotinib [5].
Terapia in linee successive
Nelle linee di terapia successive, la scelta degli inibitori di ALK disponibili è solitamente limitata a causa delle mutazioni di resistenza esistenti. In uno studio di fase II, l’inibitore di ALK di terza generazione lorlatinib è stato testato in pazienti precedentemente trattati con due o tre inibitori di ALK (lorlatinib di prima generazione). o di seconda generazione , crizotinib, alectinib, ceritinib) con o senza chemioterapia ha ottenuto un ORR del 38,7% e una PFS mediana di 6,9 mesi [23]. In un’ulteriore analisi, l’efficacia di lorlatinib è stata studiata nel contesto di diverse mutazioni di resistenza ALK. Dopo il fallimento del trattamento con crizotinib, lorlatinib si è dimostrato altamente efficace nei pazienti con e senza mutazioni di resistenza ALK [24]. Al contrario, nei pazienti che avevano ricevuto in precedenza almeno un inibitore di ALK, è stata osservata un’efficacia significativamente migliore di lorlatinib in presenza di mutazioni di resistenza di ALK rispetto all’assenza di mutazioni di resistenza di ALK [24]. Le mutazioni di resistenza ad ALK potrebbero quindi essere utilizzate come biomarcatore di risposta alla terapia con lorlatinib dopo il fallimento con un inibitore di ALK di seconda generazione [24]. Dopo lo sviluppo della resistenza a crizotinib o agli inibitori di ALK di seconda generazione, la terapia sequenziale con lorlatinib* o brigatinib** è l’approccio preferito secondo le linee guida ESMO [5].
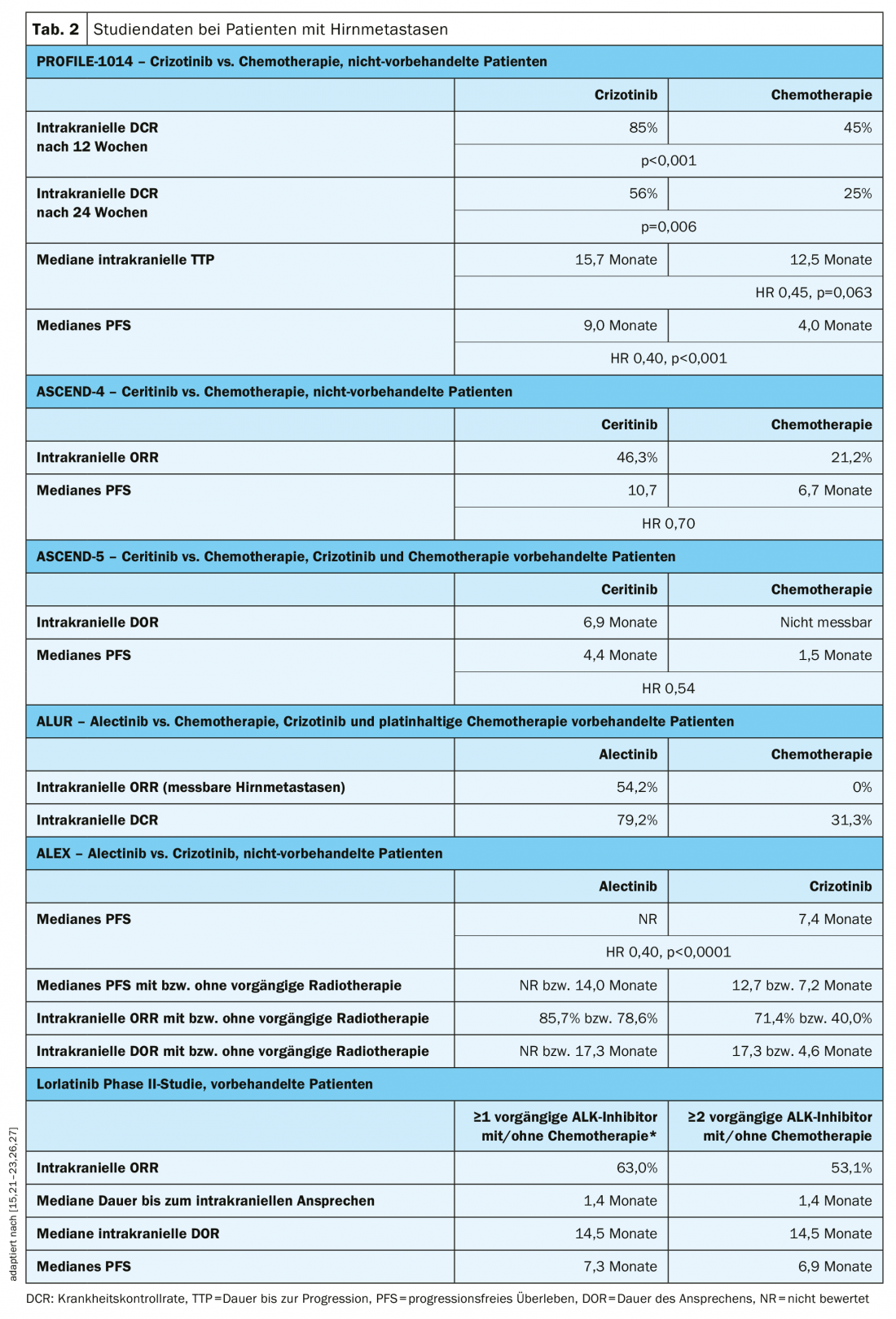
Pazienti con metastasi cerebrali
A più del 20% dei pazienti con NSCLC ALK-positivo vengono diagnosticate metastasi cerebrali alla diagnosi iniziale e l’incidenza aumenta a più del 50% con il progredire della malattia [25]. Una sfida nel trattamento delle metastasi cerebrali è il superamento della barriera emato-encefalica. Gli inibitori di ALK di seconda e terza generazione hanno mostrato proprietà significativamente migliori in questo senso rispetto a crizotinib [5,6].
Tutti gli studi sugli inibitori di ALK hanno incluso pazienti con metastasi cerebrali. Un’analisi prospettica dei dati dei pazienti con metastasi cerebrali nello studio PROFILE-1014 ha mostrato che crizotinib ha migliorato significativamente i tassi di controllo della malattia intracranica rispetto alla chemioterapia (Tabella 2) [26]. La durata fino alla progressione del tumore intracranico è stata prolungata con crizotinib, ma la differenza rispetto al braccio di chemioterapia non è stata statisticamente significativa (Tab. 2) [26]. Ceritinib ha migliorato la risposta intracranica e la PFS mediana nei pazienti con metastasi cerebrali esistenti rispetto alla chemioterapia a base di platino in prima linea (studio ASCEND-4) o dopo un pre-trattamento con crizotinib e chemioterapia (studio ASCEND-5) (Tabella 2) [15,21]. Nello studio ALUR, i pazienti con metastasi cerebrali misurabili dopo la pre-terapia con crizotinib hanno ottenuto un ORR intracranico significativamente più elevato con alectinib rispetto alla chemioterapia (tab. 2) [22]. Anche come terapia di prima linea, alectinib ha portato a un miglioramento significativo della PFS mediana nei pazienti con metastasi cerebrali rispetto a crizotinib nello studio ALEX, indipendentemente dal fatto che fosse già stata somministrata la radioterapia (tab. 2) [27]. Nello studio pivotale di fase II, è stato osservato un ORR intracranico di 53,1 mesi e una PFS mediana di 6,9 mesi con lorlatinib nei pazienti con metastasi cerebrali dopo un pre-trattamento con almeno due inibitori di ALK (tab. 2) [23].
Profili di sicurezza degli inibitori di ALK
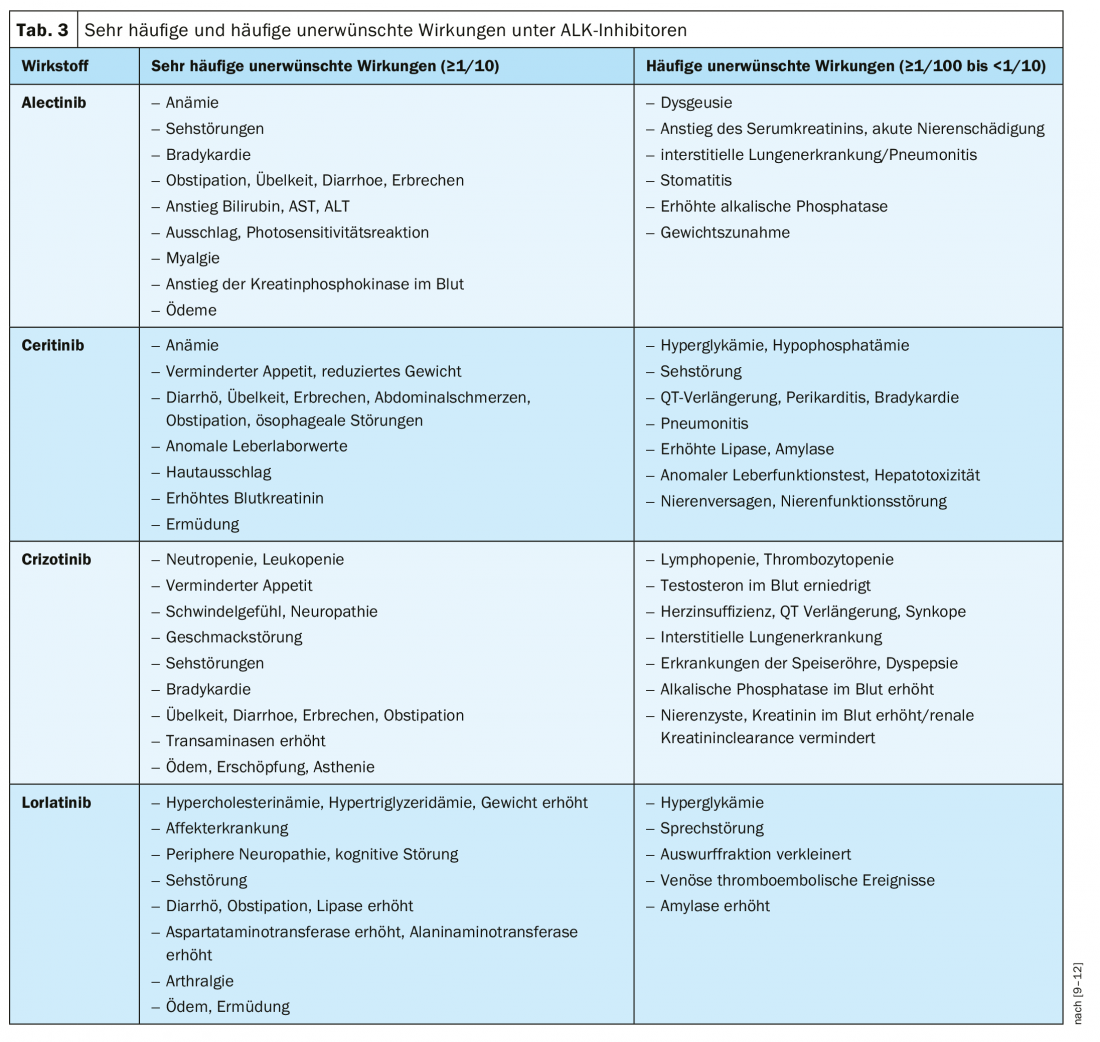
Sebbene tutti gli inibitori di ALK possano essere generalmente classificati come sicuri, il profilo di sicurezza degli agenti disponibili gioca un ruolo importante nella scelta della terapia, soprattutto se si tratta di un contesto palliativo, come nel NSCLC ALK-positivo avanzato [28]. La Tabella 3 riassume gli aspetti di sicurezza più importanti degli inibitori di ALK approvati in Svizzera secondo le informazioni specialistiche.
Sequenza degli inibitori di ALK
Con la moltitudine di inibitori di ALK disponibili, determinare una sequenza terapeutica ottimale rimane una sfida [29]. Ogni inibitore di ALK ha caratteristiche uniche, che comprendono la penetrazione nel sistema nervoso centrale, il profilo di sicurezza e lo spettro di attività in diverse mutazioni di resistenza [29].
Oltre allo stato di approvazione dei vari inibitori di ALK, anche i profili di tossicità e i fattori individuali del paziente giocano un ruolo nella scelta della terapia di prima linea [7]. Poiché crizotinib è stato il primo inibitore di ALK disponibile, la maggior parte dei dati sono disponibili per le sequenze che iniziano con crizotinib [29]. Sulla base degli studi clinici disponibili, ci si aspetta che crizotinib seguito da alectinib o ceritinib abbia una PFS mediana da 5,4 a 15,6 mesi, una OS mediana da 14,9 a 26,0 mesi e un ORR dal 33,0% all’80,0% [29]. Non sono ancora disponibili studi che confrontino direttamente diverse sequenze di inibitori di ALK [29].
Il NSCLC ROS1-positivo
ROS1 codifica una tirosin-chinasi recettoriale molto simile ad ALK [30]. Alcuni degli inibitori di ALK disponibili mostrano quindi un’elevata affinità per ROS1 e, di conseguenza, un’attività antitumorale nei pazienti con NSCLC ROS1-positivo [31].
Crizotinib è stato il primo inibitore di ALK approvato anche per il trattamento del NSCLC ROS1-positivo e la sua efficacia in questo contesto è stata dimostrata in diversi studi prospettici e retrospettivi [30,32–39]. Nello studio di Fase I PROFILE-1001, è stato osservato un ORR del 72% con crizotinib, con l’11% dei pazienti che ha mostrato una risposta completa e il 60% una risposta parziale [38]. La PFS mediana è stata di 19,3 mesi e la OS mediana di 51,4 mesi [38]. Il profilo di sicurezza di crizotinib è paragonabile a quello dei pazienti NSCLC ALK-positivi [38]. Crizotinib ha anche mostrato una significativa attività antitumorale nello studio METROS di fase II. La PFS mediana è stata di 22,8 mesi con un ORR del 65% [32]. Nelle linee guida ESMO, la monoterapia con crizotinib è raccomandata come terapia di prima o seconda linea per i pazienti con NSCLC ROS1-positivo in stadio IV [5]. Dopo la terapia di prima linea con crizotinib, la chemioterapia a base di platino può essere proposta in seconda linea [5].
Discussione e prospettive future
Le opzioni di trattamento per il NSCLC avanzato ALK-positivo vengono costantemente ampliate. Gli inibitori di ALK del I farmaci di seconda generazione si sono affermati nel contesto di resistenza al crizotinib e sono sempre più utilizzati nella prima linea di terapia nei pazienti con malattia avanzata [5]. Con lorlatinib come inibitore di ALK del La terza generazione è ora un’altra opzione disponibile per i pazienti dopo il fallimento del trattamento con due inibitori di ALK [24]. Inoltre, altri inibitori di ALK sono in fase di sviluppo clinico o stanno per essere approvati.
Brigatinib non è ancora approvato in Svizzera, ma è menzionato nelle linee guida ESMO come opzione nella prima linea di terapia. Nello studio ALTA-1L, è stato osservato un tasso di PFS più elevato con brigatinib in prima linea di terapia (HR 0,49, p<0,001) rispetto a crizotinib [40]. I pazienti resistenti a crizotinib hanno anche mostrato un ORR del 45% e del 54% e una PFS mediana di 9,2 e 12,9 mesi, rispettivamente, nello studio ALTA di brigatinib (90 mg o 180 mg al giorno) [41]. L’ORR intracranico è stato del 42% e del 67% e la PFS intracranica mediana è stata di 15,6 e 12,8 mesi, rispettivamente [41].
In vitro, l’inibitore ALK ensartinib ha inibito la crescita delle cellule NSCLC ALK-positive 10 volte di più rispetto a crizotinib [42]. Inoltre, in un primo studio di ricerca della dose, i pazienti trattati con una dose ≥200 mg hanno mostrato un tasso di risposta (RR) del 60% e una PFS mediana di 9,2 mesi. Nei pazienti precedentemente naïve agli inibitori di ALK, sono stati osservati un RR dell’80% e una PFS mediana di 26,2 mesi [42]. Dal 2016, l’efficacia e la sicurezza di ensartinib rispetto a crizotinib sono state studiate nello studio di fase III in aperto eXalt3 (NCT02767804) in pazienti NSCLC naïve all’inibitore ALK, ALK-positivi [43].
Oltre alle varie monoterapie con inibitori di ALK, si stanno discutendo anche opzioni di combinazione con inibitori del checkpoint immunitario come opzioni di trattamento per il NSCLC ALK-positivo. I dati iniziali della fase 1b dello studio JAVELIN-101 hanno mostrato una promettente attività antitumorale (ORR 46,6%) e un profilo di sicurezza accettabile con l’anticorpo monoclonale anti-PD-L1 IgG1 avelumab in combinazione con lorlatinib [44]. Anche la combinazione di alectinib con l’anticorpo anti-PD-L1 atezolizumab ha ottenuto i primi risultati positivi in uno studio di fase 1b con tossicità tollerabile in pazienti precedentemente non trattati (follow-up mediano 13 mesi, ORR 81%, PFS mediana 21,7 mesi). Tuttavia, al momento dell’analisi, solo 6 dei 21 pazienti erano in progressione [45].
Anche altri inibitori di ALK/ROS1 sono attualmente in fase di studio clinico per il NSCLC ROS1-positivo. In uno studio di fase I/II, è stato raggiunto un ORR del 41% (95% CI 29-53) con lorlatinib in pazienti ROS1-positivi, TKI-naïve o pretrattati (n=69) con o senza metastasi al SNC [46]. Una risposta obiettiva è stata osservata nel 62% dei pazienti TKI-naïve (10% risposta completa, 52% risposta parziale), nel 45% dei pazienti con metastasi al sistema nervoso centrale e nell’80% del gruppo senza metastasi al sistema nervoso centrale. Il tempo mediano alla prima risposta tumorale (TTR) è stato di 1,4 mesi e la durata mediana della risposta (DOR) è stata di 25,3 mesi (95% CI 7,5-31,9) [46]. Lo studio pivotal di fase II su lorlatinib comprendeva una coorte ROS1-positiva (EXP-6) oltre ai pazienti ALK-positivi (EXP1-5) [23,47]. In questo gruppo di pazienti è stata osservata una risposta rapida e sostenuta con lorlatinib, indipendentemente dalla pre-terapia con crizotinib [47]. L’ORR complessivo e la PFS mediana sono stati rispettivamente di 36,2% e 9,9 mesi, nei pazienti crizotinib-naïve di 61,5% e 21,0 mesi, e dopo la pre-terapia con crizotinib di 26,5% e 8,5 mesi, rispettivamente [47]. Lorlatinib è approvato solo in Svizzera per il trattamento del NSCLC ALK-positivo [9].
Un altro composto in fase di valutazione è il potente inibitore di ROS1, entrectinib, come opzione terapeutica nel NSCLC avanzato ROS1-positivo. L’analisi integrata di tre studi di fase I/II (ALKA-372-001, STARTRK-1, STARTRK-2) ha mostrato un ORR del 77% e una PFS mediana di 26 e 14 mesi in pazienti senza e con metastasi cerebrali, rispettivamente [48]. Entrectinib ha mostrato una buona tollerabilità e un profilo di sicurezza gestibile [48].
Nel complesso, la situazione del trattamento dei pazienti con NSCLC ALK-positivo o ROS1-positivo è stata notevolmente migliorata negli ultimi anni. Tuttavia, sono necessari ulteriori studi, ad esempio per rispondere alle domande sulla sequenza ottimale degli inibitori di ALK. Con le approvazioni previste di altre sostanze, le opzioni terapeutiche saranno ulteriormente ampliate in futuro.
Messaggi da portare a casa
- In Svizzera, gli inibitori di ALK crizotinib (1a generazione), alectinib e ceritinib (2a generazione) e lorlatinib (3a generazione) sono approvati per il trattamento del NSCLC avanzato ALK-positivo.
- L’uso di crizotinib, alectinib o ceritinib è raccomandato come terapia di prima linea per il NSCLC ALK-positivo. Alectinib o ceritinib sono preferiti per le metastasi cerebrali esistenti.
- Circa il 20% dei pazienti in terapia con crizotinib e più del 50% con alectinib o ceritinib sviluppano mutazioni di resistenza. Lo spettro di resistenza degli inibitori di ALK varia.
- Dopo lo sviluppo della resistenza a crizotinib, si raccomanda di utilizzare alectinib o ceritinib come linea di terapia successiva.
- Lorlatinib copre un campo più ampio di mutazioni di resistenza rispetto agli inibitori di ALK del 1. e di seconda generazione e viene quindi utilizzato dopo la progressione con alectinib o ceritinib.
- Crizotinib è raccomandato come terapia di prima o seconda linea per il NSCLC ROS1-positivo.
* Lorlatinib è approvato in Svizzera dopo la progressione con almeno due inibitori di ALK.
** Brigatinib non è approvato in Svizzera.
Letteratura:
- Krebsliga Schweiz – Il cancro in Svizzera: figure importanti. A dicembre 2018.
- Carcinoma polmonare non a piccole cellule. My Cancer Genome www.mycancer genome.org/content/disease/non-small-cell-lung-carcinoma. Ultimo accesso: 15.10.2019.
- Shaw AT, et al: Caratteristiche cliniche ed esito dei pazienti con carcinoma polmonare non a piccole cellule che ospitano EML4-ALK. Journal of clinical oncology: official journal of the American Society of Clinical Oncology, 2009. 27(26): 4247-4253.
- Davare MA, et al: Approfondimento strutturale sui profili di selettività e resistenza degli inibitori della tirosin-chinasi ROS1. Atti dell’Accademia Nazionale delle Scienze degli Stati Uniti d’America, 2015. 112(39): E5381-E5390.
- Planchard D, et al: Carcinoma polmonare non a piccole cellule metastatico: Linee guida di pratica clinica ESMO per la diagnosi, il trattamento e il follow-up. Ann Oncol, 2019. 30(5): 863-870.
- Griesinger F, et al.: Metastasi cerebrali nel NSCLC ALK-positivo – è tempo di adeguare gli attuali algoritmi di trattamento. Oncotarget, 2018. 9(80): 35181-35194.
- Ziogas DC, et al: Trattamento del carcinoma polmonare non a piccole cellule ALK-positivo. Annali di medicina traslazionale, 2018. 6(8): 141-141.
- Elenco dei medicinali autorizzati per uso umano. www.swissmedic.ch/swissmedic/de/home/services/listen_neu.html#-257211596. Ultimo accesso 02.03.2020.
- Informazioni tecniche attuali Lorviqua® (lorlatinib). Stato delle informazioni: gennaio 2020. www.swissmedicinfo.ch.
- Attuale riassunto delle caratteristiche del prodotto di Xalkori® (crizotinib). Stato delle informazioni: ottobre 2018. www.swissmedicinfo.ch.
- Informazioni tecniche attuali Alecensa® (alectinib). Stato delle informazioni: aprile 2018. www.swissmedicinfo.ch.
- Informazioni tecniche attuali Zykadia® (ceritinib). Stato delle informazioni: maggio 2019. www.swissmedicinfo.ch.
- Solomon, BJ, et al: Crizotinib in prima linea rispetto alla chemioterapia nel carcinoma polmonare ALK-positivo. New England Journal of Medicine, 2014. 371(23): 2167-2177.
- Solomon BJ, et al: Analisi finale della sopravvivenza globale da uno studio che confronta Crizotinib in prima linea rispetto alla chemioterapia nel carcinoma polmonare non a piccole cellule positivo alla mutazione ALK. J Clin Oncol, 2018. 36(22): 2251-2258.
- Soria JC, et al: Ceritinib in prima linea rispetto alla chemioterapia a base di platino nel carcinoma polmonare non a piccole cellule ALK-arrangiato in fase avanzata (ASCEND-4): uno studio randomizzato, in aperto, di fase 3. Lancet, 2017. 389(10072): 917-929.
- Peters S, et al: Alectinib rispetto a crizotinib nel carcinoma polmonare non a piccole cellule ALK-Positivo non trattato. New England Journal of Medicine, 2017. 377(9): 829-838.
- Hida T, et al: Alectinib rispetto a crizotinib nei pazienti con carcinoma polmonare non a piccole cellule ALK-positivo (J-ALEX): studio randomizzato di fase 3 in aperto. Lancet, 2017. 390(10089): 29-39.
- Gainor JF, et al: Meccanismi molecolari di resistenza agli inibitori di ALK di prima e seconda generazione nel carcinoma polmonare con recettori ALK. Cancer discovery, 2016. 6(10): 1118-1133.
- McCusker MG, et al: Come tratto il carcinoma polmonare non a piccole cellule ALK-positivo. ESMO Open, 2019. 4(Suppl 2): e000524.
- Shaw AT, et al: Crizotinib rispetto alla chemioterapia nel carcinoma polmonare ALK-positivo avanzato. N Engl J Med, 2013. 368(25): 2385-2394.
- Shaw, A.T., et al: Ceritinib rispetto alla chemioterapia in pazienti con carcinoma polmonare non a piccole cellule con riarrangiamento ALK, precedentemente sottoposti a chemioterapia e crizotinib (ASCEND-5): uno studio di fase 3 randomizzato, controllato, in aperto. Lancet Oncol, 2017. 18(7): 874-886.
- Novello S, et al: Alectinib rispetto alla chemioterapia nel carcinoma polmonare non a piccole cellule anaplastico della chinasi del linfoma (ALK) pretrattato con crizotinib: risultati dello studio di fase III ALUR. Annali di oncologia : rivista ufficiale della Società Europea di Oncologia Medica, 2018. 29(6): 1409-1416.
- Solomon BJ, et al: Lorlatinib nei pazienti con carcinoma polmonare non a piccole cellule ALK-positivo: risultati di uno studio globale di fase 2. Lancet Oncol, 2018.
- Shaw AT, et al: Mutazioni di resistenza ALK ed efficacia di Lorlatinib nel carcinoma polmonare non a piccole cellule anaplastico positivo alla chinasi. Journal of Clinical Oncology, 2019. 37(16): 1370-1379.
- Rangachari D, et al.: Metastasi cerebrali nei pazienti con carcinoma polmonare non a piccole cellule mutato in EGFR o riarrangiato in ALK. Lung cancer (Amsterdam, Paesi Bassi), 2015. 88(1): 108-111.
- Solomon BJ, et al: Efficacia intracranica di Crizotinib rispetto alla chemioterapia nei pazienti con carcinoma polmonare non a piccole cellule ALK-Positivo in stadio avanzato: risultati di PROFILE 1014. J Clin Oncol, 2016. 34(24): 2858-2865.
- Gadgeel S, et al: Alectinib rispetto a crizotinib nel carcinoma polmonare non a piccole cellule (ALK+) positivo alla chinasi linfatica anaplastica senza trattamento: risultati di efficacia sul SNC dello studio ALEX. Annali di oncologia: rivista ufficiale della Società Europea di Oncologia Medica, 2018. 29(11): 2214-2222.
- Zhu Q, et al: Analisi di sicurezza in pool dell’inibitore ALK-TKI nel NSCLC ALK-positivo. BMC cancer, 2017. 17(1): 412-412.
- Barrows SM, et al: Revisione sistematica del sequenziamento degli inibitori di ALK nel carcinoma polmonare non a piccole cellule ALK-positivo. Lung Cancer (Auckland, N.Z.), 2019. 10: 11-20.
- Michels S, et al: Sicurezza ed efficacia di Crizotinib nei pazienti con carcinoma polmonare avanzato o metastatico ROS1-Rearranged (EUCROSS): Uno studio clinico europeo di fase II. Journal of Thoracic Oncology, 2019. 14(7): 1266-1276.
- Sehgal K, et al.: Puntare i riarrangiamenti ROS1 nel carcinoma polmonare non a piccole cellule con crizotinib e altri inibitori della chinasi. Ricerca traslazionale sul cancro, 2018. 7(Suppl 7): S779-S786.
- Landi L, et al: Crizotinib nel carcinoma polmonare non a piccole cellule pretrattato deregolato MET o riarrangiato ROS1 (METROS): uno studio di fase II, prospettico, multicentrico, a due bracci. Ricerca clinica sul cancro, 2019.
- Liu C, et al: Crizotinib nei pazienti cinesi con carcinoma polmonare non a piccole cellule avanzato ROS1-Rearranged nella pratica clinica di routine. Oncologia mirata, 2019: 1-9.
- Masuda K, et al: Efficacia e sicurezza di crizotinib nei pazienti con carcinoma polmonare non a piccole cellule riarrangiato ROS1: un’analisi retrospettiva. Journal of thoracic disease, 2019. 11(7): 2965.
- Mazières J, et al: Terapia con Crizotinib per l’adenocarcinoma polmonare avanzato e un riarrangiamento ROS1: risultati della coorte EUROS1. Giornale di oncologia clinica, 2015. 33(9): 992-999.
- Moro-Sibilot D, et al: Crizotinib nel NSCLC c-MET- o ROS1-positivo: risultati dello studio di fase II AcSé. Annali di Oncologia, 2019.
- Park S, et al: Caratteristiche ed esito dei pazienti con carcinoma polmonare non a piccole cellule ROS1-positivo nella pratica clinica di routine. Journal of Thoracic Oncology, 2018. 13(9): 1373-1382.
- Shaw A, et al: Crizotinib nel carcinoma polmonare non a piccole cellule (NSCLC) in fase avanzata con ROS1: risultati aggiornati, compresa la sopravvivenza globale, da PROFILE 1001. Annals of Oncology, 2019. 30(7): 1121-1126.
- Wu YL., et al: Studio di fase II di crizotinib nei pazienti dell’Asia orientale con carcinoma polmonare non a piccole cellule avanzato ROS1-positivo. Journal of Clinical Oncology, 2018. 36(14): 1405-1411.
- Camidge DR, et al: Brigatinib rispetto a crizotinib nel carcinoma polmonare non a piccole cellule ALK-positivo. New England Journal of Medicine, 2018. 379(21): 2027-2039.
- Kim DW, et al: Brigatinib nei pazienti con carcinoma polmonare non a piccole cellule refrattario al crizotinib e positivo al linfoma anaplastico chinasi: uno studio di fase II randomizzato e multicentrico. J Clin Oncol, 2017. 35(22): 2490-2498.
- Horn L, et al: Ensartinib (X-396) nel carcinoma polmonare non a piccole cellule ALK-Positivo: risultati di uno studio multicentrico di fase I/II, first-in-human. Clinical cancer research: an official journal of the American Association for Cancer Research, 2018. 24(12): 2771-2779.
- Horn L, et al: eXalt3: uno studio di fase III di ensartinib (X-396) nel carcinoma polmonare non a piccole cellule (NSCLC) positivo alla chinasi del linfoma anaplastico (ALK). Journal of Clinical Oncology, 2017. 35(15_suppl): TPS8578-TPS8578.
- Shaw AT, et al: Avelumab (anti-PD-L1) in combinazione con crizotinib o lorlatinib in pazienti con NSCLC avanzato precedentemente trattati: risultati di fase 1b di JAVELIN Lung 101. Journal of Clinical Oncology, 2018. 36(15_suppl): 9008-9008.
- Kim DW, et al: Risultati di sicurezza e attività clinica di uno studio di fase Ib di alectinib più atezolizumab nel NSCLC avanzato ALK+ (aNSCLC). Journal of Clinical Oncology, 2018. 36(15_suppl): 9009-9009.
- Shaw AT, et al: Lorlatinib nel carcinoma polmonare non a piccole cellule ROS1-positivo in fase avanzata: uno studio multicentrico, in aperto, a braccio singolo, di fase 1-2. Lancet Oncol, 2019. 20(12): 1691-1701.
- Ou S, et al: Attività clinica di Lorlatinib nei pazienti con carcinoma polmonare non a piccole cellule avanzato ROS1: coorte di studio di fase 2 EXP-6. Journal of Thoracic Oncology, 2018. 13(10): S322-S323.
- Barlesi F, et al: Entrectinib nel carcinoma polmonare non a piccole cellule (NSCLC) localmente avanzato o metastatico positivo alla fusione ROS1: analisi integrata di ALKA-372-001, STARTRK-1 e STARTRK-2. Ann Oncol., 2019. 30(suppl_2):109O.
InFo ONCOLOGIA & EMATOLOGIA 2020; 8(2): 14-20 (pubblicato il 23.4.20, prima della stampa).