Il carcinoma epatocellulare (HCC) è il tumore primario più comune delle cellule epatiche e, con la sua resistenza intrinseca agli agenti chemioterapici classici, rappresenta una sfida nel trattamento sistemico. Il medico responsabile non deve solo valutare la situazione del tumore con un possibile effetto terapeutico – piuttosto, è necessario un attento bilanciamento tra i benefici del trattamento e il rischio di scompenso epatico.
Il carcinoma epatocellulare (HCC) è il tumore primario più comune delle cellule epatiche e, con la sua resistenza intrinseca agli agenti chemioterapici classici, rappresenta una sfida nel trattamento sistemico [1]. Oltre alle opzioni terapeutiche finora numericamente limitate nel trattamento sistemico, la malattia epatica avanzata è anche prevalentemente decisiva per la prognosi. Non solo i fattori di rischio noti per la cirrosi epatica, come l’epatite virale HBV o HCV, ma anche l’alcol gioca un ruolo. A volte il fegato grasso, che è in aumento nella nostra regione, così come il fegato grasso non alcolico (NAFLD) non è solo un fattore di rischio di HCC. Piuttosto, la ridotta performance epatica associata a questo è anche un fattore prognostico nel trattamento dell’HCC [2]. Il medico responsabile non deve quindi limitarsi a valutare la situazione del tumore con un possibile effetto terapeutico – piuttosto, è necessario un attento bilanciamento tra i benefici del trattamento e il rischio di scompenso epatico. I trattamenti curativi sono riservati agli stadi precoci del carcinoma epatico secondo la classificazione della Barcelona Clinic Liver Cancer (BCLC) per BCLC 0/A e comprendono la chirurgia, le tecniche ablative locali o il trapianto di fegato. Il rischio di recidiva dopo l’intervento chirurgico o l’ablazione nel fegato pre-danneggiato è piuttosto elevato, pari al 65-85%, a seconda degli studi, ed è proprio in questa situazione che si stanno studiando diverse opzioni di trattamento in studi clinicamente controllati [3]. Per i pazienti con HCC “intermedio” o “avanzato”, la terapia specifica è palliativa. La radioembolizzazione transarteriosa (TARE) è un’applicazione spesso usata per lo stadio BCLC-B. Anche in questo caso, esiste un rischio elevato di recidiva o di sviluppo di focolai di HCC de novo nel fegato pre-danneggiato. Pertanto, questo campo terapeutico con la conservazione di una buona funzione epatica è anche un attuale campo di interesse dei trattamenti sistemici adiuvanti. Dopo una scelta molto limitata di opzioni di sistema per l’HCC nel BCLC-C per lungo tempo con gli inibitori multichinasici (MKI) sorafenib in prima linea [4] e regorafenib in seconda linea [5], i trattamenti per l’HCC si sono ampliati negli ultimi 3,5 anni con terapie di combinazione di anticorpi vascolari più inibitori del checkpoint immunitario (ICI) ([6,7]. Inoltre, nel campo dell’HCC “avanzato” (aHCC), c’è attualmente un vivo interesse di studio per ulteriori combinazioni, a volte MKI più ICI. Questi risultati sono molto attesi, perché non solo queste combinazioni vengono studiate nel trattamento di prima linea, ma alcune combinazioni terapeutiche vengono utilizzate anche dopo una precedente immunoterapia. Già alla fine del 2021, la combinazione di cabozantinib più atezolizumab nell’aHCC di prima linea è stata dimostrata al Simposio virtuale ESMO Asia con lo studio COSMIC-312. All’inizio del 2022, al Simposio virtuale ASCO GI è stato presentato uno studio positivo con una combinazione di ICI con lo studio HIMALAYA. Vorrei ora presentare questi dati e le prospettive di ulteriori studi per le terapie combinate in una panoramica semplificata.
Terapie di combinazione nell’aHCC
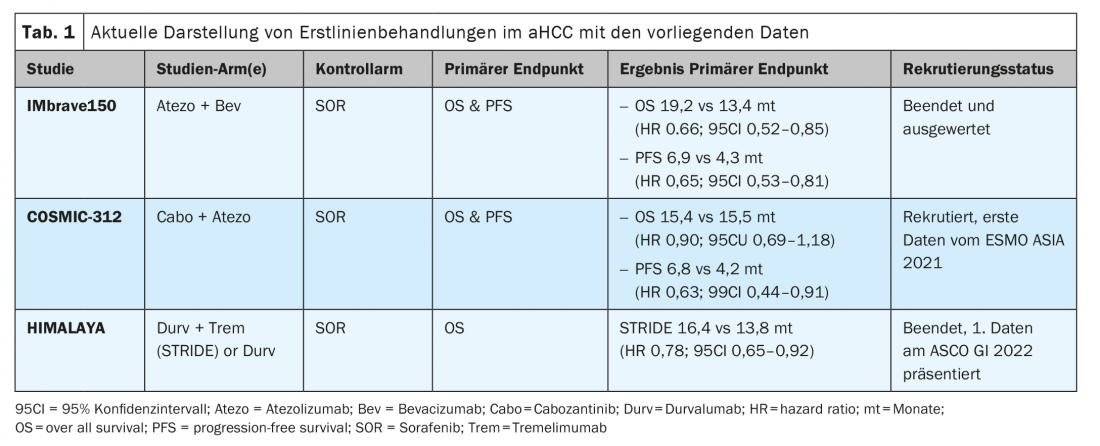
Studio IMbrave 150 – ulteriori risultati a lungo termine dall’ASCO 2021: con lo studio IMbrave 150, è stato raggiunto un nuovo standard terapeutico a livello mondiale nel trattamento di prima linea dell’aHCC nello stadio BCLC C e nell’uso precoce nello stadio BCLC B, a partire dal 2019. [7] Meno di un anno dopo, il 16 novembre 2020, anche SwissMedic ha concesso l’approvazione per questa combinazione nel trattamento di prima linea di atezolizumab più bevacizumab in Svizzera. Questa combinazione ha ottenuto un miglioramento significativo della mOS e della mPFS rispetto a sorafenib. In occasione dell’ASCO GI 2021 virtuale, sono stati presentati i dati attuali con intervalli di follow-up più lunghi [8]. I vantaggi significativi di sopravvivenza prestabiliti nella mOS (19,2 vs 13,4 mesi; HR 0,66; p=0,0009) e anche nella mPFS (6,9 vs 4,3 mesi; HR 0,65; p=0,0001) sono stati confermati nel periodo di osservazione più lungo di oltre 18 mesi. Sono stati raggiunti anche una riduzione del rischio di mortalità del 34% e un beneficio di sopravvivenza globale di 5,8 mesi rispetto a sorafenib, oltre a un miglioramento e a una stabilizzazione della qualità di vita [6,9].
Studio COSMIC-312 – risultati di ESMO Asia 2021: ulteriori e interessanti combinazioni sono costituite da inibitori multichinasici (MKI) e inibitori del checkpoint (ICI). Sorafenib, cabozantinib o lenvatinib in combinazione con gli inibitori di PD-1 sono attualmente in fase di valutazione nei bracci di sperimentazione nell’aHCC. Lo studio COSMIC-312 (NCT03755791) è stato progettato in 3 bracci per il trattamento di prima linea dell’aHCC. L’aspetto interessante è che gli stadi BCLC-B possono già essere inclusi. Un braccio di studio con monoterapia di cabozantinib (Cabo) e un altro braccio di studio nella combinazione di cabozantinib più atezolizumab (Cabo-Atezo) vengono confrontati con il braccio standard sorafenib per il doppio endpoint di mOS e PFS. I primi risultati dello studio su 837 pazienti randomizzati nello studio globale sono stati presentati a ESMO Asia 2021 [10]. Il gruppo Cabo-Atezo ha raggiunto l’endpoint PFS rispetto a sorafenib, ma non c’è stata alcuna differenza nella sopravvivenza globale nei due bracci con progressione della curva identica (Tabella 1) . Anche i dati PFS di Cabo Mono sono risultati significativamente superiori a quelli di sorafenib, ma i dati OS non sono ancora stati dimostrati. È interessante notare che il carcinoma epatocellulare associato all’epatite B (HBV) beneficia in particolare della combinazione Cabo-Atezo, con una PFS HR 0,49 (95% CI 0,29-0,73). Questo sottogruppo HBV ha ottenuto un beneficio in termini di OS con un HR di 0,53 (95% CI 0,33-0,87). Anche il coinvolgimento extraepatico (EHD) e l’invasione macrovascolare (MVI) hanno indicato un beneficio in termini di PFS per la terapia combinata Cabo-Atezo nell’analisi di sottogruppo (HR 0,57; 95% CI 0,41-0,78). Al contrario, il carcinoma epatocellulare non associato al virus e il carcinoma epatocellulare associato all’epatite C (HCV) non sembrano trarre beneficio dalla combinazione. In particolare, gli asiatici hanno beneficiato maggiormente della combinazione rispetto ai pazienti HCC non asiatici, quindi non è chiaro se l’infezione da HBV o l’etnia siano un confonditore nell’analisi. Gli autori hanno concluso con cautela che la combinazione rappresenta una nuova opzione nel trattamento dell’HCC. Tuttavia, occorre attendere le analisi finali.
ORIENT-32 – Dati da ESMO 2021: all’ESMO 2021, sono stati dimostrati i risultati dello studio ORIENT-32, un’altra combinazione con sintilimab (Sin) e bevacizumab (Bev) rispetto a sorafenib [11]. Nella popolazione solo cinese, la combinazione Sin + Bev ha mostrato benefici significativi in termini di OS (NR vs 10,4 mesi) e mPFS (4,6 vs 2,8 mesi). I tassi di effetti collaterali di IMbrave e ORIENT-32 sono stati inferiori rispetto a sorafenib e coerenti con il tipico profilo di effetti collaterali di aVGFR e IO.
Studio HIMALAYA – combinazione di inibitori del checkpoint immunitario in prima linea nell’aHCC: anche le terapie di combinazione ICI vengono studiate più intensamente nell’aHCC. Ad esempio, la combinazione di nivolumab più tremelimumab (Trem) in un carcinoma epatocellulare dopo una precedente terapia con sorafenib è già stata approvata dall’FDA nel 2019. Un’altra combinazione ICI approvata dall’FDA dal gennaio 2021 è devaruzumab più tremelimumab. Entrambe le combinazioni sono applicabili nella terapia di seconda linea, ma non sono supportate né dall’EMA né da Swissmedic. Ora, lo studio HIMALAYA (NCT03298451) è stato recentemente presentato all’ASCO GI 2022 con i dati iniziali. Lo studio a 3 bracci con il braccio STRIDE (tremelimumab più durvalumab) o durvalumab mono (Durv) è stato confrontato con sorafenib come braccio standard. L’endpoint primario OS è stato significativamente superiore nel braccio STRIDE con 16,4 mesi rispetto al braccio sorafenib, anch’esso molto buono, con 13,8 mesi (HR 0,78; p=0,0035). Non ci sono state differenze nella PFS, ma c’è stata un’impressionante DoR (durata della risposta) mediana di 22,34 mesi e una popolazione di pazienti del 65,8% con una risposta Trem+Durv al punto temporale di 12 mesi. Questi risultati sono molto interessanti per la combinazione di inibitori del checkpoint e nelle analisi di sottogruppo condotte finora, quasi tutti i gruppi erano favorevoli all’uso di questa combinazione. La grande discussione sulla popolazione appropriata rispetto al nuovo SoC (standard di cura) atezolizumab più bevacizumab è data e non è facile rispondere. A mio avviso, non esistono biomarcatori chiari per la selezione o l’assegnazione a una delle due combinazioni.
Studi attualmente in fase di reclutamento e previsti nel prossimo futuro
CheckMate 9DW: questo studio di fase 3, NCT04039607, sta confrontando la combinazione di nivolumab (Nivo) più ipilimumab (Ipi) rispetto a sorafenib nel trattamento di prima linea in 728 stadi BCLC-B e BCLC-C di aHCC previsti. L’endpoint primario è la OS e lo studio è attualmente aperto ma non sta reclutando a causa della pandemia COVID 19 (al 28 gennaio 2022 clinicaltrials.gov).
LEAP-002: questo studio di fase 3 (NCT03713593) sta confrontando il SoC lenvatinib con la combinazione lenvatinib più pembrolizumab. Come esito primario, verranno confrontati la PFS e la OS di entrambi i gruppi. Anche questo studio è attivo, ma non è in corso alcun reclutamento (al 28 dicembre 2021 clinicaltrials.gov).
Studi di reclutamento adiuvanti
Non solo il campo dell’aHCC è attualmente oggetto di studi intensivi per l’effetto delle immunoterapie, ma anche le fasi locali dopo l’intervento chirurgico o l’ablazione. In ogni caso, viene utilizzata una terapia placebo come gruppo di controllo. Pembrolizumab è in fase di studio come monoterapia nello studio Keynote-937 (NCT03867084), toripalimab nello studio JUPITER-04 (NCT03859128) o nivolumab nello studio CheckMate 9Dx (NCT03383458) come terapia adiuvante. Lo studio EMERALD-2 (NCT03847428) si concentra su durvalumab o sulla combinazione di durvalumab più bevacizumab nella fase adiuvante. Anche lo studio ImBrave050 (NCT04102098) sta studiando la combinazione di atezolizumab più bevacizumab nei pazienti con HCC ad alto rischio rispetto al placebo dopo l’intervento chirurgico o l’ablazione. Questi risultati sono molto attesi nel complesso, in quanto i risultati positivi degli studi spostano l’uso dell’ICI in una linea precoce. Pertanto, in futuro, non solo l’espansione dell’ICI con diverse combinazioni nell’aHCC comporterà un’intensificazione della discussione sul posizionamento nelle linee guida, ma anche la sequenza in caso di recidiva dopo l’intervento chirurgico o l’ablazione, se l’ICI è stata utilizzata in questo caso.
Prospettive e “bisogni non soddisfatti
Gli studi presentati sono molto attesi sia negli stadi BCLC-B localmente e localmente avanzati di HCC e, se gli endpoint saranno soddisfatti, stabiliranno un nuovo standard di cura. Anche per quanto riguarda l’aHCC con stadi BCLC B o C, si prevedono attualmente molte prospettive di studio con segnali positivi. Pertanto, possiamo sperare in una varietà di nuove combinazioni terapeutiche nel prossimo futuro. Oltre a questa prospettiva positiva, ci sono anche problemi diretti e indiretti con requisiti attualmente (ancora) non risolti. Questo si riferisce da un lato alla sequenza terapeutica ottimale di un paziente con HCC e dall’altro alla questione delle diverse terapie a seconda dell’epatopatia di base. Al contrario, la questione dei biomarcatori adatti per la prognosi e la predizione è ancora insoddisfacente e rappresenta anche un punto di vista delle attuali domande di ricerca. In particolare, l’analisi della resistenza intrinseca o acquisita alla terapia ICI (inibizione del checkpoint immunitario) svolge un ruolo centrale. Per l’applicazione clinica, sono importanti anche la sicurezza e l’efficacia delle terapie nei pazienti CHILD-Pugh B e nei pazienti post-trapianto, che non sono stati inclusi negli studi precedenti. Da queste domande aperte nasce la necessità di sviluppare e definire punteggi clinici e diagnostici per selezionare i pazienti ottimali per la migliore terapia combinata possibile.
Messaggi da portare a casa
- Il campo di trattamento del carcinoma epatocellulare di stadio C BCLC si è notevolmente ampliato, compresa la combinazione di atezolizumab più bevacizumab attualmente approvata in Svizzera.
- La funzionalità epatica e un buon punteggio Child-Pugh sono fondamentali per l’uso di terapie sistemiche nell’HCC.
- I pazienti con HCC dovrebbero essere valutati congiuntamente da un epatologo e da un oncologo medico in una fase precoce, in modo che la valutazione per la terapia sistemica venga effettuata anche per la funzionalità epatica.
- Il campo di trattamento del carcinoma epatocellulare si sta espandendo anche nelle fasi iniziali del BCLC. Se possibile, i pazienti devono essere inclusi negli studi.
Letteratura:
- Fulgenzi CAM, et al; Immunoterapia nel carcinoma epatocellulare. Curr Treat Options Oncol 2021, 22(10): 87.
- Galati G, et al.: Opzioni terapeutiche attuali per il carcinoma epatocellulare: dalla farmacocinetica all’efficacia e agli eventi avversi nella cirrosi epatica. Curr Drug Metab 2020, 21(11): 866-884.
- Llovet JM, et al: Terapie locoregionali nell’era dei trattamenti molecolari e immunitari per il carcinoma epatocellulare. Nat Rev Gastroenterol Hepatol 2021, 18(5): 293-313.
- Llovet JM, et al: Sorafenib nel carcinoma epatocellulare avanzato. N Engl J Med 2008, 359(4): 378-390.
- Bruix J, et al: Regorafenib per i pazienti con carcinoma epatocellulare che sono progrediti con il trattamento con sorafenib (RESORCE): uno studio di fase 3, randomizzato, in doppio cieco, controllato con placebo. Lancet 2017, 389(10064): 56-66.
- Casak SJ, et al: Riassunto dell’approvazione FDA: Atezolizumab più Bevacizumab per il trattamento dei pazienti con carcinoma epatocellulare avanzato non resecabile o metastatico. Clin Cancer Res 2021. 27(7): 1836-1841.
- Finn RS, et al: Atezolizumab più Bevacizumab nel carcinoma epatocellulare non resecabile. N Engl J Med 2020, 382(20): 1894-1905.
- Finn R, QS, Ikeda M, et al.: IMbrave150: dati aggiornati sulla sopravvivenza globale di uno studio globale, randomizzato, in aperto di fase III di atezolizumab + bevacizumab vs sorafenib in pazienti con carcinoma epatocellulare non resecabile. Journal of Clinical Oncology 39, n. 3_suppl (20 gennaio 2021) 267-267, 2021.
- Gordan JD, et al: Terapia sistemica per il carcinoma epatocellulare avanzato: linea guida ASCO. J Clin Oncol 2020, 38(36): 4317-4345.
- Kelley RK, et al: VP10-2021: Cabozantinib (C) più atezolizumab (A) rispetto a sorafenib (S) come trattamento sistemico di prima linea per il carcinoma epatocellulare avanzato (aHCC): Risultati dello studio randomizzato di fase III COSMIC-312. Annali di Oncologia 2021 ESMO VIRTUAL PLENARY ABSTRACT VOLUME 33, ISSUE 1, P114-116.
- Ren Z, et al: Sintilimab più un biosimilare di bevacizumab (IBI305) rispetto a sorafenib nel carcinoma epatocellulare non resecabile (ORIENT-32): studio randomizzato, in aperto, di fase 2-3. Lancet Oncol 2021, 22(7): 977-990.
InFo ONcOLOGIA & EMATOLOGIA 2022; 10(2): 6-8











