Gli inibitori del checkpoint immunitario stanno trovando un impiego sempre più diffuso in oncologia, con alcuni successi rivoluzionari. Tuttavia, l’attivazione del sistema immunitario provoca anche un’ampia gamma di effetti collaterali. Si osservano anche effetti collaterali neurologici – rari, ma potenzialmente gravi. Allora è necessaria una buona gestione.
Nella terapia oncologica, i cosiddetti inibitori del checkpoint immunitario (ICI) sono stati utilizzati sempre di più negli ultimi anni e hanno portato a una svolta nella terapia di vari tumori maligni, a volte con remissioni durature o permanenti. Le indicazioni vengono costantemente ampliate e vengono approvate nuove sostanze, per cui gli ICI vengono utilizzati nella terapia di un numero crescente di tipi di tumore (Tabella 1).
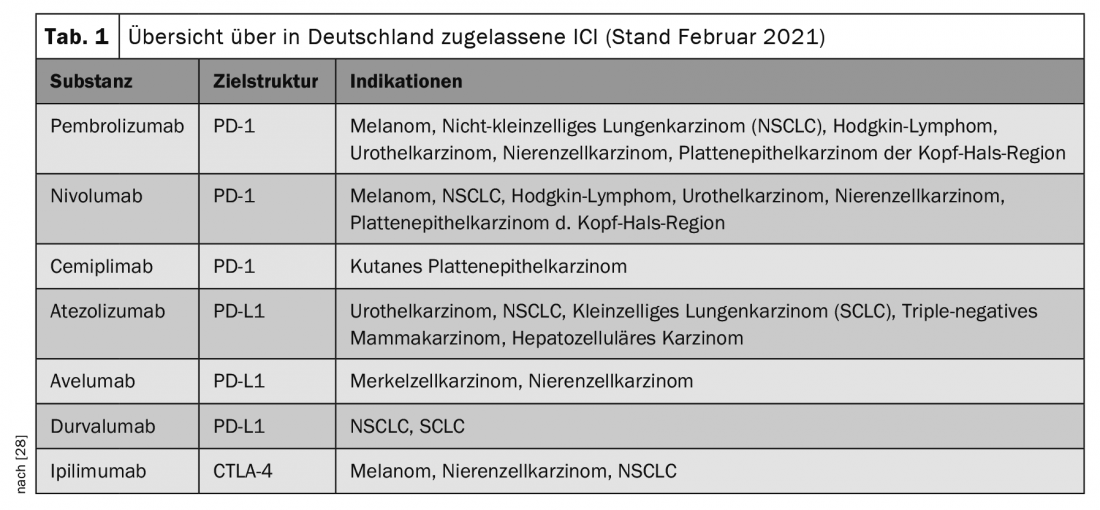
Gli ICI sono anticorpi specifici diretti contro i checkpoint immunitari. Esempi di tali molecole di checkpoint sono il recettore 1 della morte cellulare programmata (PD-1), il ligando PD-1 (PD-L1) o l’antigene 4 dei linfociti T citotossici (CTLA-4) [1].
In condizioni fisiologiche, i checkpoint immunitari nella maturazione delle cellule T e B occupano una posizione chiave per l’auto-tolleranza e la modulazione del sistema immunitario. Quindi, CTLA-4 ha principalmente una funzione inibitoria nel priming delle cellule T, mentre PD-1 e PD-L1, come coppia recettore/ligando, svolgono un ruolo inibitorio nella fase effettrice, cioè nell’attacco della cellula T con un recettore già specifico sulla cellula tumorale [2]. Le cellule tumorali utilizzano queste molecole di checkpoint per l’invasione immunitaria, attivandole per inibire il sistema immunitario dell’organismo diretto contro di loro. Ad esempio, molte cellule tumorali esprimono PD-L1 e possono utilizzare questo meccanismo per inibire le cellule T specifiche dirette contro le cellule tumorali, legandosi al loro recettore PD-1 e sfuggendo alla distruzione da parte del sistema immunitario dell’organismo. Questa evasione immunitaria dovrebbe essere evitata bloccando i suddetti recettori con l’ICI, promuovendo così la risposta immunitaria antitumorale.
Attualmente sono in corso ricerche sulle combinazioni di chemioterapia convenzionale, inibitori della tirosin-chinasi, radioterapia e ICI, nonché su altri checkpoint come bersagli o sulla combinazione di diversi ICI. Gli studi hanno mostrato l’evidenza di un effetto sinergico della radioterapia locale seguita dalla somministrazione sistemica di ICI. Si presume che il tessuto tumorale disintegrato dalla radioterapia, con gli antigeni rilasciati e i neoantigeni specifici del tumore, promuova il priming delle cellule T e possa quindi provocare una risposta antitumorale più forte a livello sistemico [2].
Tuttavia, a causa dell’attivazione del sistema immunitario mediata dalle ICI, non sorprende che si possa innescare un’ampia gamma di fenomeni autoimmuni (evento avverso immuno-correlato; irAE) o che si possano scatenare, come effetti collaterali, malattie autoimmuni e paraneoplastiche già esistenti. A seconda del checkpoint inibito, sono stati osservati irAEs nel 70-90%, la maggior parte dei quali di gravità lieve (grado 1 o 2 secondo i CTCAE (Common Terminology Criteria for Adverse Events)) [1]. Gli organi più comunemente colpiti dall’irAE sono l’intestino, la pelle, i polmoni, il fegato e gli organi endocrini. Gli irAE neurologici (nirAE), invece, che possono interessare il sistema nervoso centrale e periferico, la placca terminale neuromuscolare e la muscolatura, sono rari [3]. A causa del crescente utilizzo degli ICI, le conoscenze sui nirAE sono in continuo aumento, anche se la maggior parte delle prove finora è stata generata principalmente attraverso rapporti di casi, serie di casi retrospettivi e meta-analisi; mancano finora grandi studi prospettici sugli effetti collaterali. Pertanto, le frequenze riportate di nirAE differiscono notevolmente. I nirAE di grado 1-2 sono stati osservati nel 6-12%, quelli di grado 3-4 nello 0,1-1% dei pazienti trattati [4]. La malattia autoimmune preesistente non sembra comportare un rischio significativamente maggiore di sviluppare nuovi irAE con la terapia ICI [5]. Tuttavia, questo aspetto è discusso in modo controverso a causa dei dati ancora molto limitati disponibili. Gli irAEs in terapia con ICI si verificano in media entro le prime 12 settimane dall’inizio della terapia ICI [6]. Nei singoli casi, tuttavia, la durata può variare notevolmente, da pochi giorni dopo la prima somministrazione di ICI a più di un anno dopo l’inizio della terapia o addirittura dopo la fine della somministrazione di ICI.
Naturalmente, altre diagnosi differenziali neurologiche devono essere escluse con mezzi diagnostici appropriati. I possibili nirAE devono essere individuati e trattati precocemente, in quanto sono rari ma talvolta associati a un’elevata morbilità e mortalità [7,8].
In questa sede verrà fornita una panoramica dei nirAE attualmente conosciuti. Le malattie associate all’ICI imitano in parte i quadri clinici neurologici noti, ma si presentano in combinazioni insolite o rappresentano un nuovo tipo di fenomeno. Tuttavia, la gravità, la gestione terapeutica e il decorso differiscono notevolmente dai classici quadri clinici neurologici.
Sistema nervoso periferico
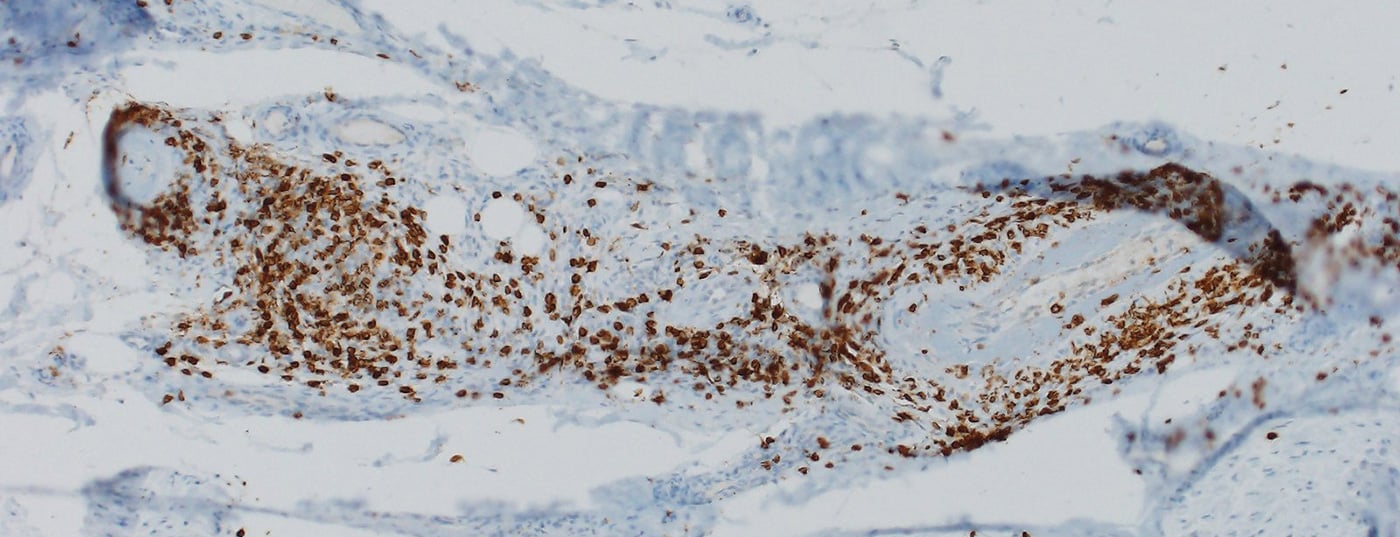
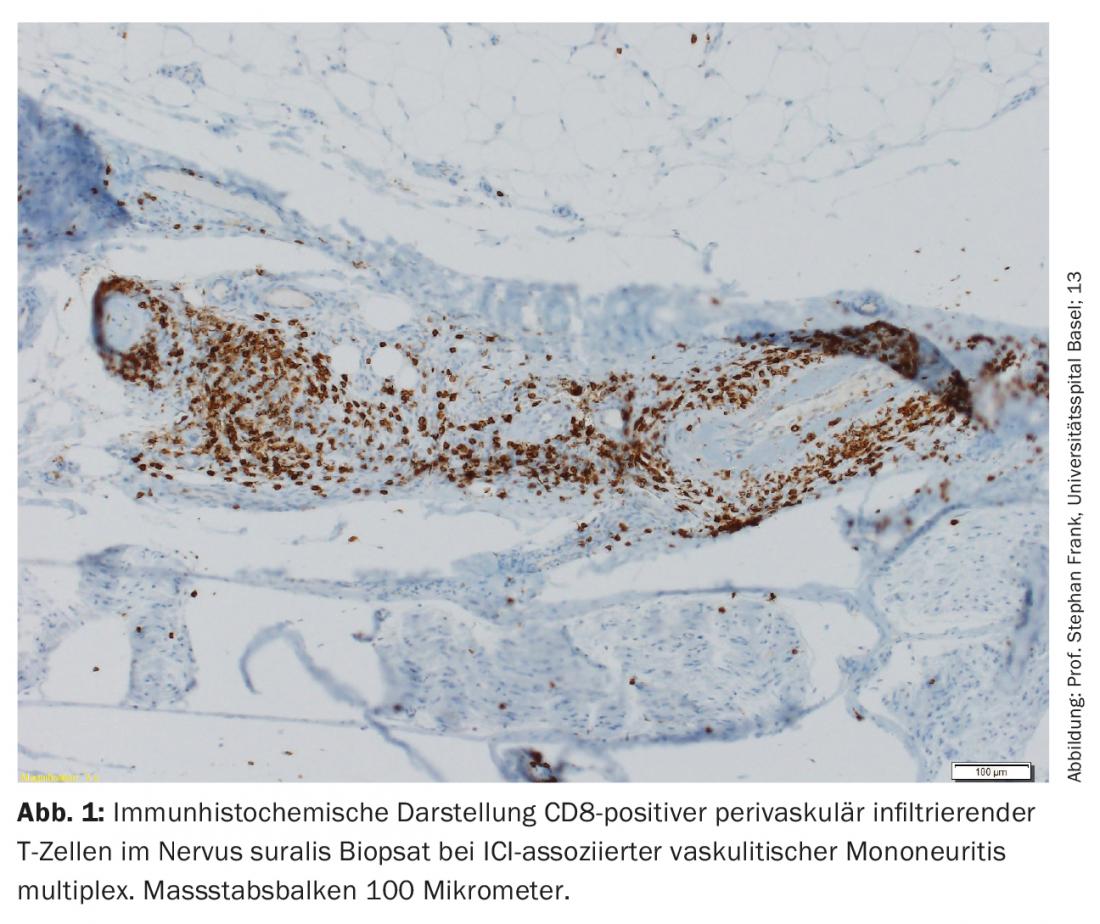
La maggior parte dei nirAE colpisce il sistema nervoso periferico [9]. Le polineuropatie sono state osservate in circa il 3% dei pazienti trattati con ICI. Le neuropatie associate all’ICI possono essere sia assonali che demielinizzanti e hanno diversi modelli di distribuzione, tra cui la mononeuropatia, la mononeurite multipla, la polineuropatia simmetrica, la neuropatia delle piccole fibre, la neuropatia autonomica, l’amiotrofia nevralgica, la meningoradicolite e il coinvolgimento dei nervi cranici [10,11]. Sono state descritte anche polineuropatie periferiche vasculitiche e mononeurite multipla p-ANCA-positiva ( Fig. 1) [12,13]. A seconda della gravità, si deve prendere in considerazione la sospensione dell’ICI, la somministrazione di steroidi e/o la separazione del plasma (per rimuovere gli anticorpi ancora terapeuticamente efficaci). Tuttavia, spesso ci sono solo sintomi lievi, per cui la terapia ICI può essere continuata a seconda del contesto generale [9,10]. La risposta delle neuropatie associate all’ICI agli steroidi è buona.
Il paradigma è una polineuropatia demielinizzante infiammatoria acuta (AIDP), in cui il quadro classico di una dissociazione citotalbuminosa con proteine elevate e basso numero di cellule è meno evidente nel liquor, ma una lieve pleocitosi (fino a 15 cellule/μl) è caratteristica in aggiunta all’aumento delle proteine [9]. Un decorso cronico (CIDP) è raro. In caso di AIDP (sindrome di Guillain-Barré), la somministrazione di ICI deve essere interrotta in modo permanente e deve essere avviata la somministrazione di steroidi ad alte dosi in combinazione con immunoglobuline per via endovenosa (IVIG) o plasmaferesi, in considerazione del potenziale pericolo di vita [14].
È stata descritta anche una miosite dolorosa con paresi troncale come sintomo principale, soprattutto con le terapie anti-PD-1 [15]. A volte si presentano in modo isolato, ma spesso in combinazione con la sindrome miastenica o una condizione simile all’AIDP. La miocardite concomitante è comune e deve essere sempre presa in considerazione, poiché ha un’alta mortalità (circa 1/3 dei casi) [16]. Sono note sia la dermatomiosite, la polimiosite e la miosite necrotizzante acuta con un fenotipo istopatologico caratteristico [9]. Finora non sono stati rilevati anticorpi paraneoplastici o autoimmuni specifici. Nella maggior parte dei casi, il miglioramento dei sintomi si è verificato dopo l’interruzione della somministrazione di ICI e dell’immunosoppressione.
La miastenia grave, nel 60% dei casi con anticorpi anti-AChR positivi, è stata diagnosticata in circa lo 0,1-0,2% dei pazienti in terapia con ICI [17]. Sono state colpite soprattutto le regioni oculari e bulbari, seguite dalle estremità prossimali. In una grande percentuale, la creatina chinasi (CK) era elevata come segno di una (cardio)miosite concomitante [15]. Il decorso era spesso grave con un’elevata mortalità. Di conseguenza, si raccomanda l’interruzione permanente dell’ICI e della terapia immunosoppressiva. A differenza della miastenia gravis classica, l’uso precoce (ben monitorato) di steroidi ad alte dosi è raccomandato anche in questo caso a causa della buona risposta [14]. Poiché gli steroidi possono portare a un peggioramento temporaneo della debolezza muscolare con il rischio di insufficienza respiratoria, si dovrebbe prendere in considerazione la somministrazione di IVIG o la plasmaferesi prima degli steroidi [3]. La risposta alla terapia sintomatica con, ad esempio, piridostigmina varia.
Sistema nervoso centrale
L’encefalite associata è stata osservata nello 0,1-0,2% dei pazienti trattati con ICI. Gli anticorpi paraneoplastici come gli anticorpi anti-Ma-2, anti-Hu, anti-CASPR2 o anti-recettore NMDA sono stati trovati frequentemente [18,19]. I risultati patologici del liquor con pleocitosi linfocitaria sono tipici, mentre i risultati della risonanza magnetica variano da non significativi a iperintensità T2 fino a casi isolati con captazione regionale del contrasto nel neurocranio [20]. Il decorso è solitamente favorevole quando si interrompe la somministrazione di ICI e si utilizzano gli steroidi, anche se sono stati riportati casi fatali [21,22].
I disturbi endocrinologici vengono diagnosticati nel 4,9-17% nel contesto dell’ipofisite, soprattutto durante la terapia con l’anticorpo anti-CTLA-4 ipililumab a un dosaggio superiore a 3 mg/kg. A dosi inferiori, l’incidenza è significativamente più bassa [23]. Poiché la reazione immunitaria danneggia rapidamente l’ipofisi in modo irreversibile, di solito è necessaria una sostituzione ormonale a lungo termine. Di conseguenza, l’attuale raccomandazione terapeutica è di sostituire gli ormoni corrispondenti, di passare all’ICI e di somministrare steroidi solo in casi individuali, poiché raramente questo porta a un miglioramento rilevante [24].
Soprattutto con l’inibizione del CTLA-4, la meningite asettica è stata osservata nello 0,1-0,2% dei pazienti. Oltre all’aumento del numero di cellule, nel liquor è stato spesso riscontrato un aumento delle proteine, in assenza di rilevamento di agenti patogeni. Con la terapia steroidea e l’interruzione della somministrazione di ICI, i sintomi di solito regrediscono [3].
Le esacerbazioni associate all’ICI di malattie infiammatorie preesistenti del SNC, come la sclerosi multipla, sono state descritte in singoli casi, così come lo sviluppo de novo della sclerosi multipla. Tuttavia, la terapia può essere eseguita sotto stretto monitoraggio neurologico nella sclerosi multipla [25,26]. Sono stati riportati anche casi di neuromielite optica mediata da anticorpi dell’Aquaporina-4 e di mielite trasversa sieronegativa. Sono stati descritti anche casi individuali di sindrome di Tolosa-Hunt associata all’ICI, neurosarcoidosi, sindromi simili a PRES o vasculite del SNC [27,28].
Raccomandazione di terapia riassuntiva
A causa della mancanza di dati prospettici, le raccomandazioni terapeutiche si basano sull’esperienza di esperti e su rapporti di casi. Come regola generale, la terapia ICI deve essere sospesa immediatamente nei casi di irAE grave. Per le irAE più lievi (grado 1-2), la somministrazione di ICI può spesso essere ripresa. Si tratta per lo più di decisioni prese caso per caso, valutando la gravità dei nirAE e il rischio di progressione del tumore se si interrompe l’ICI. Negli irAE non neurologici, per i quali sono disponibili più dati a causa della maggiore frequenza, la risposta agli steroidi è solitamente buona. Questo vale anche per nirAE. La misura in cui una combinazione con le immunoglobuline e/o la separazione del plasma è utile dipende dalla gravità del nirAE e dal tipo di ICI (ad esempio, monoterapia o terapia combinata). È notevole che le AIDP associate all’ICI spesso rispondano bene agli steroidi, a differenza della classica sindrome di Guillain-Barré. A causa della lunga emivita dell’ICI, pari a 2-4 settimane a seconda della preparazione, si raccomanda di somministrare prednisolone a 0,5-2 mg/kgKG, a seconda della gravità del nirAE, per 2-4 settimane e poi rastremare lentamente la dose di steroidi. Le recidive di irAE in seguito alla riduzione degli steroidi sono comuni, per cui questi dovrebbero essere ridotti solo lentamente, nell’arco di alcune settimane [24]. Se i sintomi non sono sensibili agli steroidi, si può ricorrere alle immunoglobuline per via endovenosa (IVIG) o alla plasmaferesi [3]. Sono necessari studi prospettici per ottimizzare i regimi di trattamento e per selezionare i pazienti per le diverse opzioni di trattamento (monoterapia rispetto alla terapia di combinazione). Un contributo essenziale alla sicurezza terapeutica di questi pazienti spesso molto complessi e multimorbidi è la collaborazione interdisciplinare di neurologi e oncologi. Qui devono essere definite delle persone di contatto concrete.
Messaggi da portare a casa
- nirAEs come complicazioni rare ma potenzialmente gravi della terapia ICI.
- Qualsiasi tipo di malattia autoimmune possibile come nirAE, più spesso colpisce il sistema nervoso periferico.
- A seconda della gravità, l’interruzione terapeutica dell’ICI e/o degli steroidi come terapia primaria.
Letteratura:
- Heinzerling L, De Toni E, Schett G, et al. (2019): Inibitori del checkpoint. Dtsch. Arztebl. Int. 116: 119-126
- Riggenbach E, Ermiş E, Elicin O, et al. (2021): Combinazione di radio e immunoterapia. Swiss Med Forum 21(5-6): 78-82.
- Astaras C, de Micheli R, Moura B, et al. (2018): Eventi avversi neurologici associati agli inibitori del checkpoint immunitario: diagnosi e gestione. Curr. Neurol. Neurosci. Rep. 18
- Martins F, Sofiya L, Sykiotis GP, et al. (2019): Effetti avversi degli inibitori del checkpoint immunitario: epidemiologia, gestione e sorveglianza. Nat. Rev. Clin. Oncol. 16: 563-580
- Menzies AM, Johnson DB, Ramanujam S, et al. (2017): Terapia anti-PD-1 in pazienti con melanoma avanzato e disturbi autoimmuni preesistenti o tossicità maggiore con ipilimumab. Ann Oncol 28(2): 368-376.
- Weber JS, Hodi FS, Wolchok JD, et al. (2017): Profilo di sicurezza della monoterapia con nivolumab: un’analisi in pool di pazienti con melanoma avanzato. J Clin Oncol 35(7): 785-792.
- Hottinger AF (2016): Complicazioni neurologiche degli inibitori del checkpoint immunitario. Curr. Opinione. Neurol. 29: 806-812
- Kao JC, Liao B, Markovic SN, et al. (2017): Complicazioni neurologiche associate agli anticorpi anti-morte programmata 1 (PD-1). JAMA Neurol 74(10): 1216-1222.
- Harrison RA, Tummala S, de Groot J (2020) Tossicità neurologiche delle immunoterapie contro il cancro: una revisione. Curr. Neurol. Neurosci. Rep. 20
- Gu Y, Menzies AM, Long GV, et al (2017): Neuropatia immunomediata dopo l’immunoterapia di checkpoint. J. Clin. Neurosci. 45: 14-17
- McNeill CJ, Fehmi J, Gladwin J, Price C (2019): Un raro caso di variante Miller Fisher della sindrome di Guillain-Barr é (GBS) indotta da un inibitore del checkpoint. BMJ Case Rep 12(8).
- Daxini A, Cronin K, Sreih AG: Vasculite associata agli inibitori del checkpoint immunitario – una revisione sistematica. Reumatologia clinica 2018; 37: 2579-2584.
- Baldauf MC, Kapauer M, Joerger et al. (in stampa, accettato per la pubblicazione nel febbraio 2021): Mononeurite multipla vasculitica associata a Pembrolizumab in un paziente con mesotelioma. Neurologia: Neuroimmunologia e Neuroinfiammazione.
- Thompson JA, Schneider BJ, Brahmer J, et al. (2020): La gestione delle tossicità legate all’immunoterapia, versione 1.2020, presenta gli aggiornamenti delle linee guida NCCN. JNCCN J Natl Compr Cancer Netw 18(3): 231-241.
- Touat M, Maisonobe T, Knauss S, et al. (2018): Miosite e miocardite correlate agli inibitori del checkpoint immunitario nei pazienti con cancro. Neurologia 91(10): e985-e994.
- Moreira A, Loquai C, Pföhler C, et al. (2019): Miosite ed effetti collaterali neuromuscolari indotti dagli inibitori del checkpoint immunitario. Eur J Cancer 106:12-23.
- Makarious D, Horwood K, Coward JIG (2017): Miastenia grave: una tossicità emergente degli inibitori del checkpoint immunitario. Eur J Cancer 82: 128-136
- Mongay-Ochoa N, Vogrig A, Muñiz-Castrillo S, Honnorat J (2020): Sindromi paraneoplastiche associate all’anti-Hu scatenate dal trattamento con inibitori del checkpoint immunitario. J Neurol 267: 2154-2156
- Nowosielski M, Di Pauli F, Iglseder S, et al. (2020): Encefalomieloneurite e artrite dopo il trattamento con inibitori del checkpoint immunitario. Neurol Neuroimmunol Neuroinflammation 7(4).
- Nishijima H, Suzuki C, Kon T, et al. (2021): Lesioni talamiche bilaterali associate all’encefalite autoimmune indotta da Atezolizumab. Neurologia 96(3): 126-127.
- Touat M, Talmasov D, Ricard D, Psimaras D (2017): Tossicità neurologiche associate agli inibitori del checkpoint immunitario. Curr. Opinione. Neurol. 30: 659-668
- Johnson DB, McDonnell WJ, Gonzalez-Ericsson PI, et al. (2019): Un caso di attivazione clonale di cellule T CD4+ di memoria simile all’EBV in un’encefalite fatale indotta da inibitori del checkpoint. Nat Med 25(8): 1243-1250.
- Maker AV, Yang JC, Sherry RM, et al. (2006): Escalation della dose intrapaziente dell’anticorpo anti-CTLA-4 nei pazienti con melanoma metastatico. J Immunother 29(4):455-463.
- Haanen JBAG, Carbonnel F, Robert C, et al. (2017): Gestione delle tossicità da immunoterapia: Linee guida di pratica clinica ESMO per la diagnosi, il trattamento e il follow-up. Ann Oncol 28(suppl_4): iv119-iv142.
- Donia M, Pedersen M, Svane IM (2017): Immunoterapia del cancro nei pazienti con disturbi autoimmuni preesistenti. Semin. Immunopatologia. 39: 333-337.
- Hasan Ali O, Berner F, Ackermann CJ, et al. (2020): Fingolimod e linfociti infiltranti il tumore nei pazienti oncologici trattati con inibitori del checkpoint. Cancer Immunol Immunother 70(2).
- Narumi Y, Yoshida R, Minami Y, et al. (2018): Disturbo dello spettro della neuromielite optica secondario al trattamento con l’anticorpo anti-PD-1 nivolumab: il primo rapporto. BMC Cancer 18(1).
- Fan S, Ren H, Zhao L, et al. (2020): Eventi avversi neurologici immuno-correlati associati agli inibitori del checkpoint immunitario: una revisione della letteratura. Asia Pac J Clin Oncol. 16: 291-298.
- Rote Liste® Service GmbH Lista Rossa. www.rote-liste.de. Accesso al 27 febbraio 2021
InFo NEUROLOGIA & PSICHIATRIA 2021; 19(2): 6-9.