“Plasmare il futuro insieme” è stato il motto del congresso di urologia di quest’anno. Perché l’assistenza sanitaria deve continuare a svilupparsi. Non sono solo i colleghi del settore urologico ad essere richiesti. La gestione interdisciplinare è indicata per sfidare le sfide delle malattie e per concentrarsi maggiormente sull’individualizzazione, soprattutto nel campo dell’uro-oncologia.
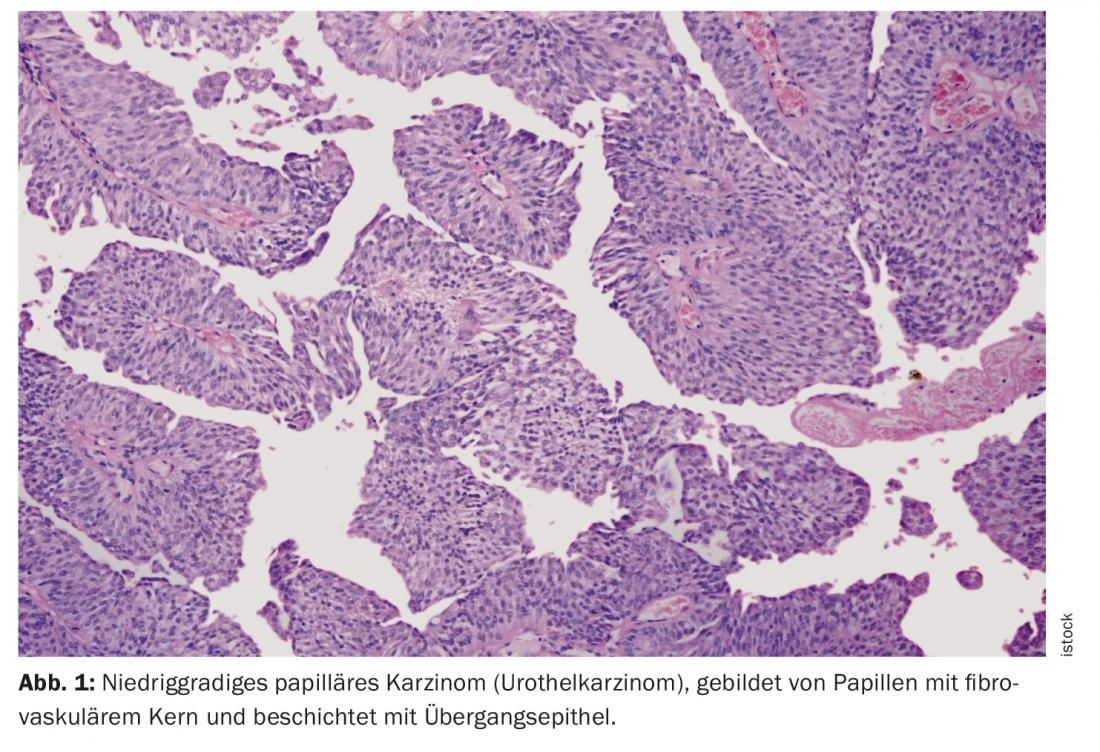
Uno dei temi della DGU riguardava la crescente individualizzazione della terapia dei pazienti, soprattutto nel campo dell’uro-oncologia. In questo caso, per ottimizzare l’assistenza al paziente è necessaria l’azione congiunta di team interdisciplinari di urologi, oncologi, radioterapisti, radiologi, patologi e, se necessario, altre discipline specialistiche. Il carcinoma uroteliale (UC) avanzato, in particolare, continua a porre grandi sfide ai medici. L’UC è una forma di cancro alla vescica. Il carcinoma ha origine nell’urotelio, lo strato epiteliale che riveste il tratto urinario. Oltre il 90% di tutti i carcinomi uroteliali colpisce la vescica urinaria. Può anche verificarsi nella pelvi renale, nell’uretere o nell’uretra.
Il principale fattore di rischio per lo sviluppo del cancro alla vescica è il fumo attivo e passivo [1]. Il rischio di malattia aumenta con la durata e la quantità dell’esposizione. Inoltre, le ammine aromatiche hanno un effetto cancerogeno [2]. L’esposizione professionale svolgeva un ruolo importante, soprattutto nell’industria chimica, nell’edilizia e nei servizi sanitari. Oggi, tali sostanze sono state ampiamente eliminate dalla vita lavorativa quotidiana. Tuttavia, poiché il periodo di latenza tra l’esposizione e la diagnosi è in media di circa 38 anni, esistono ancora oggi casi con questa eziologia. Inoltre, la radioterapia locale, il farmaco antidiabetico pioglitazone e alcuni inquinanti dell’aria e dell’acqua possono aumentare il rischio di malattia [1].
Trattamento del carcinoma uroteliale
I tumori superficiali possono essere resecati per via transuretrale (TUR), talvolta richiedendo una resezione per rimuovere tutto il tessuto tumorale [2]. A seconda della classificazione del tumore e della classificazione del rischio di crescita aggressiva, si raccomandano ulteriori instillazioni di Bacillus Calmette-Guérin (BCG) o agenti chemioterapici per la profilassi delle recidive. I tumori a crescita invasiva devono essere sottoposti a cistectomia. Se necessario, vengono somministrate ulteriori radiazioni e/o chemioterapia neoadiuvante o adiuvante [2]. Nello stadio metastatizzato, la cistectomia di solito non viene eseguita – lo standard di cura nella prima linea di trattamento è la chemioterapia contenente cisplatino. Ma le chemioterapie a base di platino raggiungono spesso i loro limiti. Da un lato, il 30-50% dei pazienti non è adatto a questo tipo di trattamento. D’altra parte, nonostante gli alti tassi di risposta, di solito ottengono solo una limitata sopravvivenza globale (OS). La OS mediana con cisplatino/gemcitabina è di 7,7 mesi e con carboplatino/gemcitabina di 5,8 mesi [3–5]. Anche l’opzione con gli inibitori del checkpoint non porta al risultato desiderato. La OS mediana dopo l’immunoterapia è di 15,9 mesi [2,6]. Di conseguenza, l’immunoterapia di solito non è efficace nel contesto di prima linea, e di solito è troppo tardi per i malati per passare a un contesto di seconda linea in cui l’immunoterapia potrebbe essere utilizzata. Solo circa un terzo dei pazienti riceve un trattamento di seconda linea [7–9]. È quindi indicata una terapia di mantenimento efficace.
Terapia di mantenimento di prima linea con lo standard di cura
Se il tumore non è progredito dopo la chemioterapia a base di platino, l’inibitore di PD-L1 avelumab è disponibile per la terapia di mantenimento di prima linea. In combinazione con la migliore terapia di supporto (BSC), il trattamento porta a un prolungamento della OS e della sopravvivenza libera da progressione (PFS) – anche a lungo termine, come dimostrano i risultati di un recente follow-up a lungo termine dello studio JAVELIN Bladder 100 [10,11]. Lo studio multicentrico, multinazionale, randomizzato, in aperto, di fase III, ha incluso 700 pazienti con carcinoma uroteliale non resecabile localmente avanzato o metastatico, dopo una chemioterapia contenente platino. Randomizzati in un rapporto 1:1, hanno ricevuto avelumab 10 mg/kg IV ogni due settimane e BSC o solo BSC. Dopo due anni, i tassi di OS erano del 49,8% nel gruppo di combinazione rispetto al 38,4% nel gruppo di sola BSC. I tassi di PFS a 2 anni sono stati del 23,4% contro il 7,1%. La risposta dei pazienti alla chemioterapia precedente non ha influito sull’effetto della terapia di mantenimento. Gli eventi avversi correlati al trattamento (TEAE) più comuni sono stati infezioni del tratto urinario, diarrea e dolori articolari. Tuttavia, questi hanno portato all’interruzione della terapia solo in un piccolo numero di persone colpite. Il profilo di sicurezza accettabile e l’efficacia del trattamento con avelumab sono stati confermati dai risultati iniziali della pratica quotidiana [12]. Dopo un periodo di osservazione mediano di 13,5 mesi, i primi risultati dello studio non interventistico AVENANCE dimostrano l’attività clinica e la sicurezza anche in una popolazione di pazienti eterogenea. Sono stati osservati tassi di OS del 66,9% e di PFS del 36,9%.
Carcinoma della prostata – prognosi e previsione
Secondo le linee guida di pratica clinica del National Comprehensive Cancer Network (NCCN), i pazienti con tumore alla prostata localizzato possono essere classificati come a basso, intermedio e alto rischio in base ai loro esiti clinici. I pazienti a rischio intermedio e alto con carcinoma prostatico localizzato sono spesso trattati con la radioterapia definitiva a fasci esterni (EBRT) in combinazione con la terapia di deprivazione di androgeni (ADT). Numerosi studi di fase III di ampia coorte hanno dimostrato che la combinazione di ADT ed EBRT può migliorare significativamente i tassi di mortalità specifica per cancro alla prostata (PCSM), di metastasi a distanza (DM) e di recidiva biochimica (BR). La misurazione dei livelli sierici dell’antigene prostatico specifico (PSA) è un metodo biochimico prezioso per lo screening del cancro alla prostata, il monitoraggio della risposta al trattamento e la rilevazione della recidiva della malattia. Il livello nadir dell’antigene prostatico specifico (nPSA) ha dimostrato di predire BR, DM, mortalità causa-specifica (CSM) e mortalità per tutte le cause (OM) dopo la radioterapia (RT). Inoltre, vi è una crescente evidenza che le misurazioni del PSA limitate nel tempo nei pazienti sottoposti a EBRT definitiva sono predittori precoci indipendenti di BR e DM. Tuttavia, il valore prognostico del nPSA nei pazienti con carcinoma prostatico trattati contemporaneamente con ADT ed EBRT rimane poco chiaro. Lo scopo di uno studio è stato quello di determinare se una soglia di nPSA di 0,06 ng/ml 12 mesi dopo il trattamento può servire come predittore precoce della sopravvivenza libera da recidiva biochimica (BRFS), del PCSM e della sopravvivenza globale (OS) nei pazienti con cancro alla prostata trattati con ADT e EBRT concomitanti.
In modo retrospettivo, sono stati valutati i dati clinici di 338 pazienti con cancro alla prostata a rischio intermedio e alto. La dose mediana di radiazioni era di 76 Gy, il livello mediano di PSA al basale era di 17 ng/ml (range 1-228 ng/ml) e la durata mediana dell’ADT era di 24 mesi (range 6-167 mesi). Il livello mediano di PSA 1 mese dopo la EBRT era di 0,06 ng/ml (range 0-25,6 ng/ml). Il tempo di follow-up mediano è stato di 5 anni. L’analisi multivariata ha mostrato che il nPSA era un fattore indipendente e significativo associato a OS, PCSM e BRFS. Inoltre, il tempo al nPSA12 era un predittore indipendente di PCSM e BRFS. L’irradiazione pelvica era anche significativamente associata a una peggiore OS e PCSM. Inoltre, l’età (≤70 o >70 anni) e la durata della terapia ormonale (6 mesi, 1-3 anni o >3 anni) erano significativamente associate alla OS e alla PCSM, rispettivamente. Ad alto rischio, nPSA e nPSA12 erano predittori indipendenti di BRFS. Un livello di nPSA12 >0,06 ng/ml può predire in modo indipendente una PCSM e una BRFS peggiori nei pazienti con carcinoma prostatico a rischio intermedio e alto sottoposti a EBRT e ADT. Ad alto rischio, nPSA >0,06 ng/mL e nPSA12 >0,06 ng/mL possono predire in modo indipendente una BRFS peggiore [13].
Cancro del rene – benefici per la sopravvivenza grazie all’inibizione del checkpoint immunitario
Il cancro al rene è una neoplasia comune, con oltre 430.000 nuovi casi in tutto il mondo nel 2020 e circa 180.000 decessi. Il carcinoma a cellule renali (RCC) rappresenta la maggior parte dei tumori renali (90-95%), con il RCC a cellule chiare come sottotipo istologico più comune. Circa il 30% dei casi di RCC viene diagnosticato in uno stadio avanzato o metastatico e quasi l’80% di questi pazienti ha un rischio intermedio o scarso secondo i criteri dell’International Metastatic renal cell carcinoma Database Consortium (IMDC). Il carcinoma a cellule renali è caratterizzato dall’inattivazione del gene soppressore del tumore von Hippel-Lindau, che porta ad un’elevata espressione del fattore di crescita endoteliale vascolare proangiogenico (VEGF).
Fino a poco tempo fa, la terapia di prima linea per il RCC avanzato consisteva principalmente nell’uso di inibitori della tirosin-chinasi (TKI). Questi mirano al recettore del fattore di crescita endoteliale vascolare (VEGF), tra gli altri. L’esplorazione di nuovi regimi terapeutici si è concentrata sull’uso di più TKI in combinazione con anticorpi monoclonali che inibiscono direttamente il VEGF e agiscono come inibitori del Mammalian Target of Rapamycin. Si ritiene che gli inibitori del VEGF e del recettore del VEGF abbiano effetti immunomodulatori e promuovano anche l’infiltrazione di cellule immunitarie grazie al loro effetto sui vasi tumorali. Mentre la terapia con agente singolo mirata al fattore di crescita endoteliale vascolare è stata un pilastro del trattamento, i dati di diversi studi di fase III che hanno esaminato le combinazioni di inibitori del checkpoint immunitario (ICI) come trattamento di prima linea hanno mostrato un significativo beneficio in termini di sopravvivenza. In una revisione, sei studi di fase III hanno mostrato benefici significativi per le combinazioni di ICI rispetto a sunitinib. Nivolumab più ipilimumab ha migliorato significativamente la sopravvivenza globale (mediana 47,0 contro 26,6 mesi) e la sopravvivenza libera da progressione (mediana 11,6 contro 8,3 mesi) nei pazienti a rischio intermedio e scarso dell’International Metastatic Renal Cell Carcinoma Database Consortium. Anche la sopravvivenza globale è stata significativamente migliorata con le combinazioni di ICI e inibitori della tirosin-chinasi, indipendentemente dal rischio, tra cui pembrolizumab più axitinib o lenvatinib e nivolumab più cabozantinib. Non sono stati rilevati nuovi segnali di sicurezza [14].
Congresso: 74° Congresso della Società tedesca di urologia (DGU)
Letteratura:
- Istituto Robert Koch, Cancro in Germania per il 2017/2018. 13a edizione, capitolo 3.25 Vescica urinaria.
- Linea guida S3 Rilevazione precoce, diagnosi, terapia e follow-up del cancro della vescica urinaria 2020. Disponibile online su www.awmf.org/leitlinien/detail/ll/032-038OL.html.
- Von der Maasse H, et al: J Clin Oncol 2000; 18(17): 3068-3077.
- Von der Maasse H, et al: J Clin Oncol 2005; 23(21): 4502-4608.
- De Santis M e altri. J Clin Oncol 2012; 30(2): 191-199.
- Linea guida DGHO Carcinoma della vescica (carcinoma uroteliale). Disponibile online all’indirizzo www.onkopedia.com/de/onkopedia/guidelines/blasenkarzinom-urothelkarzinom/@@guideline/html/index.html.
- Aly A, et al: J Med Econ 2019; 22(7): 662-670.
- Cheeseman S, et al: Front Oncol 2020; 10: 167.
- Niegisch G, et al: J Cancer 2018; 9(8): 1337-1348.
- Powles T, et al: Abstract 487. Presentato a ASCO GU 2022
- Powels T, et al: N Engl J Med 2020; 383: 1218-1230.
- Barthělěmy P, et al: Poster 1757P. Presentato al Congresso ESMO 2022.
- Cetin IA, Akay SU, Sengoz M: Il nadir dell’antigene prostatico specifico entro 1 anno dalla radioterapia combinata con la terapia ormonale predice la mortalità cancro-specifica e la sopravvivenza libera da recidiva biochimica nei pazienti con cancro alla prostata. BMC Urol 2022; 22(1): 182.
- Lalani AKA, Heng DYC, Basappa NS, et al: Il panorama in evoluzione della terapia combinata di prima linea nel carcinoma renale avanzato: una revisione sistematica. Ther Adv Med Oncol 2022; 14: 17588359221108685.