La strategia di trattamento viene determinata in base all’età e alle condizioni generali del paziente. I pazienti più giovani e in forma ricevono un trattamento intensivo con una terapia di induzione (almeno quattro cicli), seguita da una chemioterapia ad alto dosaggio/trapianto di cellule staminali autologhe (pianificazione precoce!) e, se necessario, da una terapia di consolidamento breve o di mantenimento più lunga. I pazienti più anziani ricevono un trattamento combinato che include una nuova sostanza per un periodo di 12-18 mesi. In caso di ricaduta, si possono usare nuove sostanze. Nei pazienti giovani, si può discutere di ripetere il trapianto di cellule staminali autologhe o, in casi selezionati, allogeniche. I pazienti devono essere monitorati per gli effetti collaterali dei farmaci e la terapia deve essere adattata in tempo.
Le raccomandazioni del Gruppo di lavoro internazionale sul mieloma (IMWG) per la diagnosi delle malattie delle plasmacellule sono state adattate lo scorso anno [1].
I pazienti con mieloma plasmacellulare ad alto rischio, precedentemente asintomatici (la progressione a uno stadio sintomatico entro meno di due anni è molto probabile), vengono ora valutati come richiedenti la terapia (Tab. 1).

In pratica, questo significa, tra l’altro, che per i pazienti senza danni agli organi finali (criteri CRAB), ma con il 10-60% di plasmacellule e un quoziente di catene leggere di <100, si raccomanda una risonanza magnetica dell’intero corpo ( Fig. 1). Vale la pena chiedere al reparto di radiologia locale se questo esame è possibile. Come si può vedere dall’illustrazione, i pazienti devono essere preparati di conseguenza per l’esame.
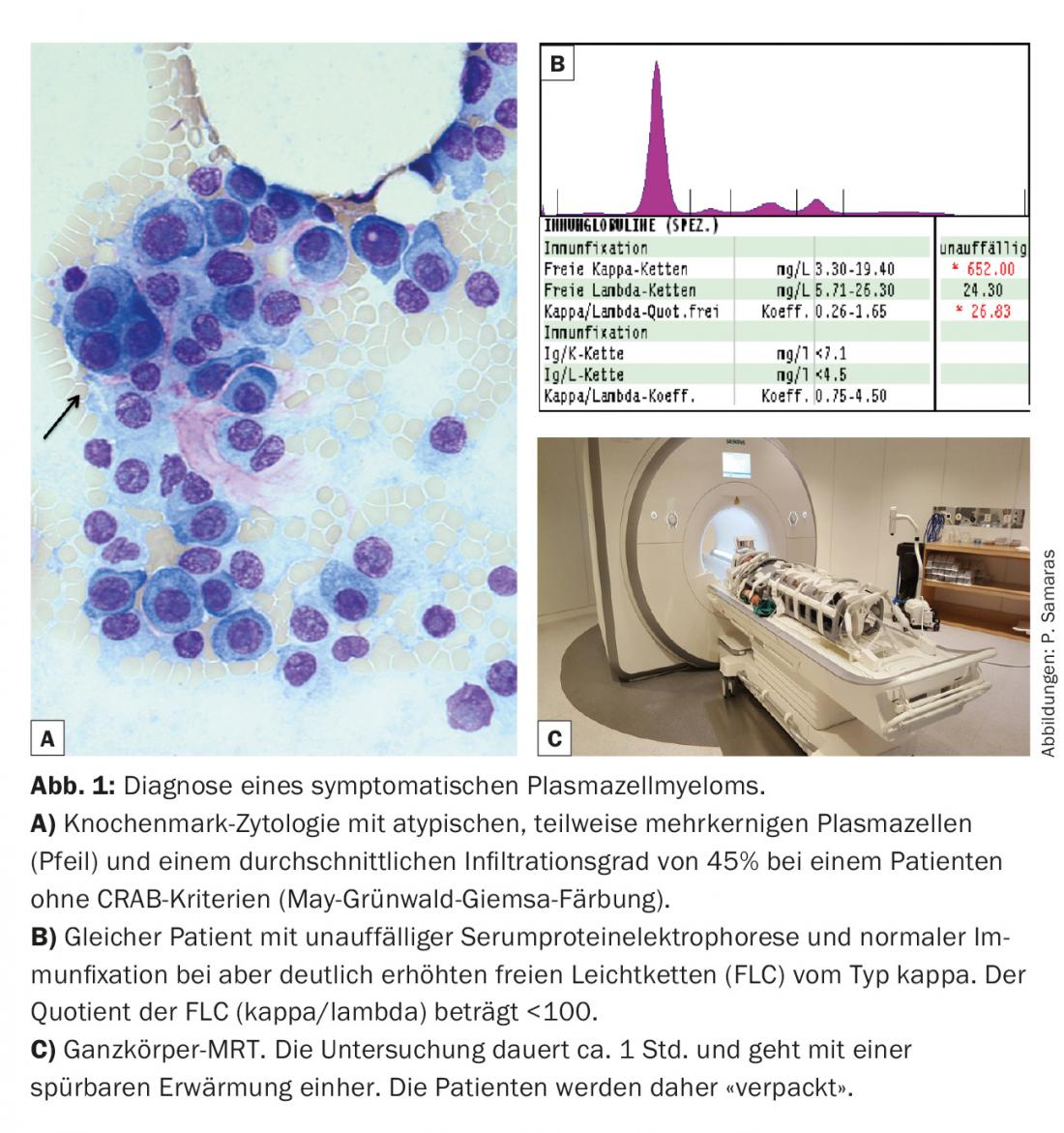
Anche il valore diagnostico della concentrazione di catene leggere libere (FLC) nel siero è stato rafforzato (tab. 1). Negli studi, finora le FLC sono state misurate esclusivamente con il test FreeliteTM (The Binding Site). Per quanto riguarda i criteri CRAB, la compromissione della funzione renale è stata integrata dalla specificazione di una clearance minima della creatinina. Formalmente, solo l’alterazione della funzione renale dovuta alla nefropatia castale è definibile come mieloma, ma non l’alterazione della funzione renale dovuta, ad esempio, all’amiloidosi AL o alla malattia da deposito di catene leggere (LCDD).
La TAC e la PET-CT sono state aggiunte di recente come possibili strumenti diagnostici per chiarire le osteolisi. La TAC è attualmente il metodo di scelta come metodo di screening per l’osteolisi.
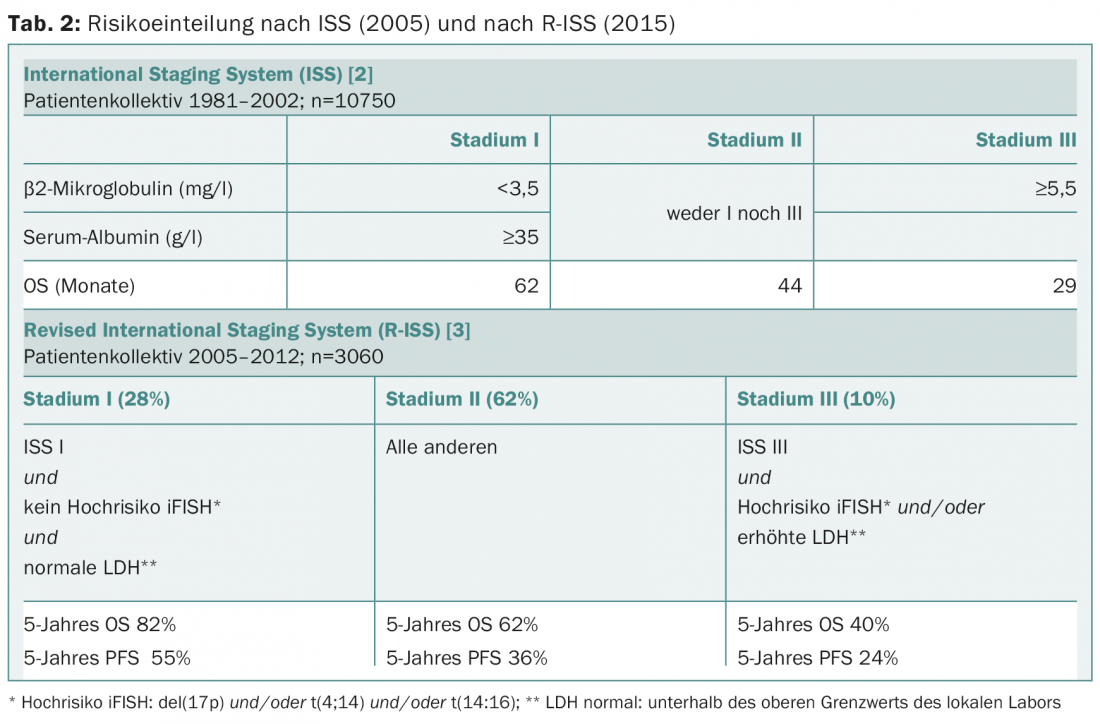
Anche la stratificazione del rischio è stata modificata quest’anno, poiché la risposta al trattamento è migliorata da quando il punteggio ISS è stato pubblicato dieci anni fa [2]. Il punteggio ISS rivisto (R-ISS) ora include anche l’analisi iFISH e l’aumento della LDH (Tab. 2) [3]. L’R-ISS è applicabile a tutti i pazienti, compresi gli anziani (>65 anni) e quelli non sottoposti a chemioterapia ad alto dosaggio. L’R-ISS non è ancora stato convalidato in un’altra popolazione di pazienti e il follow-up mediano è stato di poco inferiore ai quattro anni.
La fragilità è un fattore importante nella valutazione della capacità di trattamento, dell’adattamento e della prognosi. Nella pratica clinica quotidiana, utilizziamo per lo più la nostra esperienza clinica per stimare la fragilità, ma può anche essere valutata sistematicamente, ad esempio in modo analogo alla raccomandazione IMW, con l’aiuto di uno strumento online (www.myelomafrailtyscorecalculator.net) [4]. Esistono anche raccomandazioni per la gestione della terapia in base alla forma fisica, anche se questo approccio è basato su esperti e non è ancora stato indagato prospetticamente negli studi [5].
Ulteriori informazioni importanti sulla prognosi si ottengono solo nel corso della terapia. Per esempio, il raggiungimento di una risposta completa nei pazienti di qualsiasi età è associato a un miglioramento della sopravvivenza globale e della sopravvivenza libera da progressione.
Trattamento di prima linea con trapianto di cellule staminali autologhe
Se esiste un’indicazione alla terapia, la prima cosa da chiarire è se il trattamento intensivo con chemioterapia ad alte dosi e trapianto autologo di cellule staminali (HDCT/ASZT) sia un’opzione per il paziente.
I pazienti che si qualificano per questa strategia di terapia intensiva hanno un’età inferiore ai 65-75 anni e non hanno comorbidità gravi. Oltre all’età, per valutare l’idoneità al trapianto si possono consultare vari punteggi di comorbilità clinicamente orientati. La terapia consiste solitamente in almeno quattro, fino a un massimo di sei cicli di trattamento di induzione, seguiti da HDCT/ASZT e, a seconda della risposta, da una successiva terapia di consolidamento più breve e/o di mantenimento più lunga.
L’induzione deve contenere l’inibitore del proteasoma bortezomib e consiste in un totale di tre sostanze. Le combinazioni comuni in Europa sono bortezomib/ciclofosfamide/desametasone (VCD) o bortezomib/talidomide/desametasone (VTD) e negli Stati Uniti bortezomib/lenalidomide/desametasone (VRD). Se ci sono controindicazioni all’uso del bortezomib, al suo posto può essere utilizzata la lenalidomide, un immunomodulatore di seconda generazione (IMiD) e un ulteriore sviluppo della talidomide, anche in combinazione con il desametasone (Rd) e possibilmente in aggiunta alla ciclofosfamide come terza sostanza (RCD). Poiché la lenalidomide non è ancora approvata per la terapia di prima linea in Svizzera, il costo deve essere preventivamente coperto dall’assicurazione sanitaria. È importante contattare tempestivamente il centro trapianti, subito prima o poco dopo l’inizio del trattamento di induzione, per poter pianificare per tempo la raccolta delle cellule staminali e il trapianto.
La HDCT/ASCT è stata considerata la terapia standard per i pazienti giovani e in forma fin dagli anni ’90 [6]. La sostanza alchilante melfalan viene somministrata in una dose di 200 mg/m2 (MEL200). Nei pazienti di età superiore ai 65 anni e/o con limitazioni fisiche come l’insufficienza renale, la dose viene solitamente ridotta a 100 o 140 mg/m2 (MEL100 o MEL140). Poiché oggi il trattamento si adatta principalmente all’età biologica e meno all’età anagrafica, i pazienti in forma di 65-70 anni possono ancora ricevere dosi complete di MEL200, a condizione che non vi siano limitazioni fisiche. In caso di risposta insufficiente dopo la HDCT/ASCT o nei pazienti con un profilo di rischio citogenetico molto sfavorevole (t(4;14), t(14;16) o del(17p), si può effettuare un’ulteriore HDCT/ASCT con melfalan, nel senso di un cosiddetto trapianto tandem a intervalli di tre mesi, a condizione che il primo sia stato ben tollerato dal paziente.
Nei pazienti che non hanno ottenuto una risposta completa dopo la HDCT/ASZT, si possono somministrare altri due cicli di terapia come terapia di consolidamento. Nella maggior parte dei casi, si utilizza la stessa combinazione di farmaci utilizzata per l’induzione, ma è possibile anche l’uso di una nuova classe di sostanze. L’indicazione per una terapia di mantenimento con un inibitore del proteasoma o un IMiD per diversi anni o fino alla progressione deve essere fatta su base individuale. A causa dell’aggressività della malattia, i pazienti con citogenetica ad alto rischio sono certamente idonei. Attualmente, l’efficacia di un inibitore orale del preoteasoma di terza generazione, ixazomib, come terapia di mantenimento dopo l’ASZT è in fase di sperimentazione in un ampio studio internazionale a cui partecipa anche l’Ospedale Universitario di Zurigo (https://clinicaltrials.gov: NCT02181413).
Trattamento di prima linea senza trapianto di cellule staminali
Nei pazienti anziani che non possono essere sottoposti a HDCT/ASCT, deve essere somministrata una terapia a base di bortezomib o lenalidomide con una combinazione di due o tre farmaci. Le combinazioni di farmaci più comuni sono bortezomib/melphalan/prednisone (VMP), lenalidomide/desametasone (Rd) e bortezomib/desametasone (Vd). La durata della terapia è fondamentale per ottenere una risposta profonda e quindi duratura. Deve essere mantenuto per un periodo da 12 (VMP) ad almeno 18 (Rd) mesi. È importante tenere sotto controllo gli effetti collaterali che limitano la terapia, come la polineuropatia o l’affaticamento, in modo da poter adattare la dose del farmaco in tempo o sospendere il trattamento, se necessario. In generale, il bortezomib deve essere somministrato solo una volta alla settimana e per via sottocutanea, e la dose di desametasone deve essere limitata a un massimo di 1 mg alla settimana. 40 mg a settimana può essere ridotto. In questo modo, si può evitare l’interruzione precoce della terapia e quindi aumentare l’efficacia del trattamento [7].
Una panoramica degli effetti collaterali più comuni si trova nella tabella 3. I consigli sull’aggiustamento della dose nei pazienti anziani si trovano in letteratura [8].
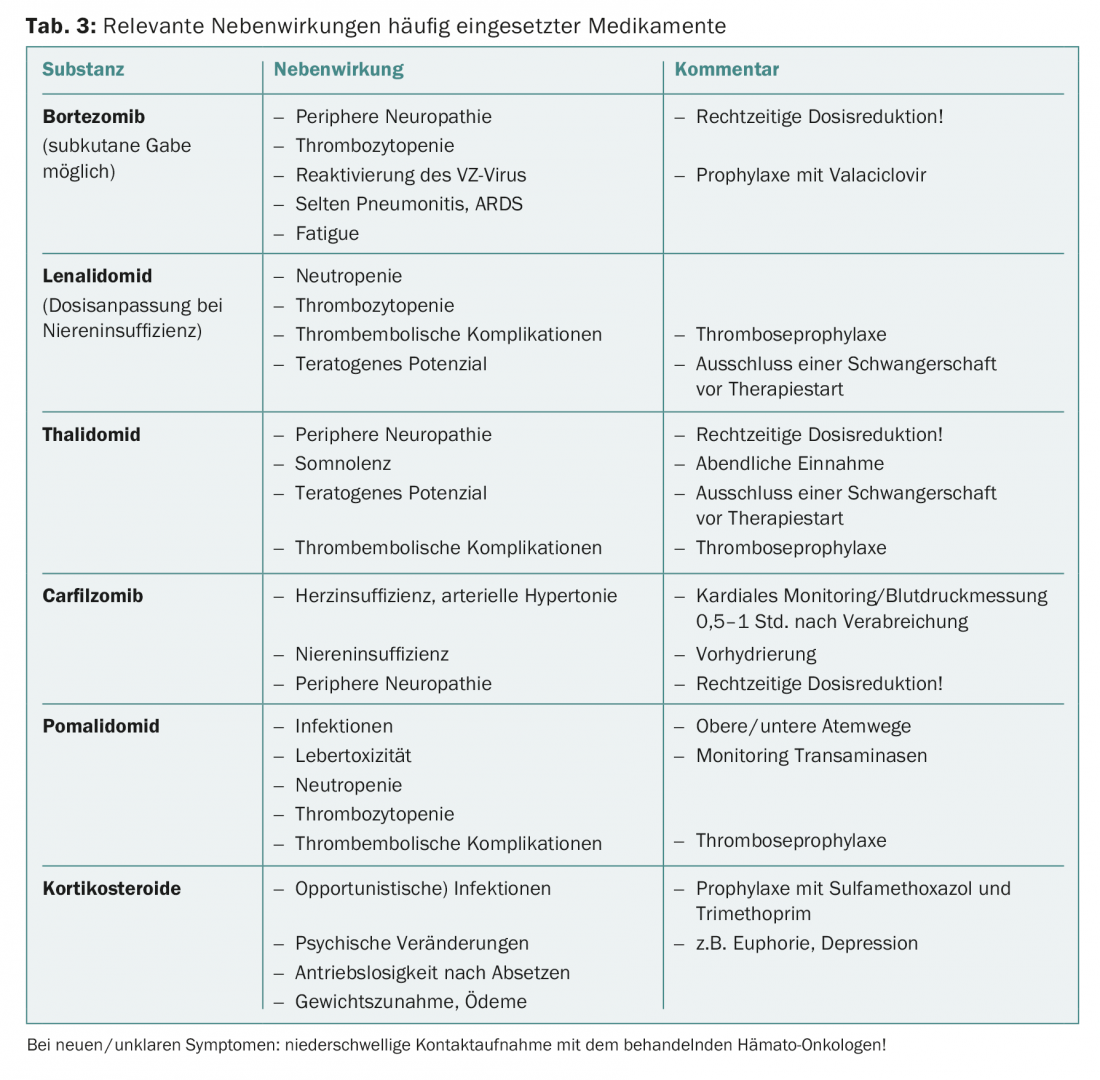
Tutti i pazienti con diagnosi di mieloma plasmacellulare che necessitano di un trattamento dovrebbero ricevere anche una terapia antiriassorbente con acido zoledronico, poiché è stato documentato che questo migliora la sopravvivenza globale [9].
Seconda e successiva linea di terapia
In caso di progressione sintomatica della malattia, è ancora una volta importante controllarla con una terapia efficace per un periodo più lungo possibile. Ai pazienti più giovani eleggibili al trapianto che non hanno ricevuto una HDCT/ASCT come parte del trattamento di prima linea, dovrebbe essere offerta in caso di recidiva. Nei pazienti che sono rimasti liberi da progressione per almeno 18 mesi dopo la HDCT/ASCT, si può discutere di una seconda HDCT/ASCT come terapia di salvataggio dopo una nuova terapia di induzione. Un regime di induzione adatto è, per esempio, la tripla combinazione bortezomib/doxorubicina/desamatasone (PAD). Nei pazienti giovani con ricaduta precoce dopo HDCT/ASCT (<18 mesi) e/o profilo di rischio citogenetico sfavorevole, la possibilità di un trapianto di cellule staminali allogeniche può essere discussa con il centro trapianti nella situazione di ricaduta [10].
Nei pazienti non trapiantabili, se c’è una buona risposta alla terapia di prima linea e un lungo intervallo libero da progressione, le stesse sostanze possono essere utilizzate nel senso di un “re-challenge”. Se l’intervallo libero da progressione è più breve, si devono utilizzare nuove classi di sostanze, perché altrimenti non ci si può aspettare una risposta tumorale sostenuta. I pazienti che hanno ricevuto inizialmente bortezomib devono essere trattati con lenalidomide in seconda linea e viceversa. Per le linee successive, si possono utilizzare anche altre sostanze disponibili di recente, ad esempio bendamustina, pomalidomide (IMiD di terza generazione ) o carfilzomib (inibitore del proteasoma di seconda generazione ). Promettenti sono anche i risultati ottenuti con elotuzumab, il primo anticorpo monoclonale disponibile in commercio per la terapia del mieloma, in combinazione con lenalidomide e desametasone.
Gli studi sperimentali hanno dimostrato che l’inibitore della proteasi dell’HIV, il renfinavir, può risensibilizzare le cellule di mieloma resistenti alle sostanze già somministrate. L’Associazione svizzera per la ricerca clinica sul cancro (SAKK) sta attualmente testando questo approccio in due studi multicentrici su pazienti con mieloma plasmacellulare recidivato o refrattario. Il nelfinavir è combinato con lenalidomide/desametasone in uno studio (SAKK 39/10; https://clinicaltrials.gov: NCT01555281) e con bortezomib/desametasone nell’altro (SAKK 39/13; https://clinicaltrials.gov: NCT02188537). Per informazioni più dettagliate sui risultati degli studi disponibili e sulle attuali raccomandazioni terapeutiche per la Svizzera, rimandiamo anche a un documento di revisione pubblicato di recente [11].
Prospettive per i nuovi farmaci
Recentemente, nei congressi si è parlato sempre più spesso della prospettiva di una cura per i pazienti affetti da mieloma plasmacellulare. Immunoterapie di vario tipo (IMiDe, terapie con anticorpi, inibitori del checkpoint, cellule CAR-T, “vaccinazioni”, ecc. Oggi, un discreto controllo a lungo termine della malattia è già una realtà e numerosi farmaci, alcuni con nuovi meccanismi d’azione, sono già stati approvati dalla FDA e dall’EMA o sono almeno in una fase avanzata di sperimentazione clinica. Questo vale per il trattamento di prima linea del mieloma plasmacellulare di nuova diagnosi (NDMM), nonché per il mieloma plasmacellulare recidivato o refrattario (RRMM) e per il mieloma smoldering ad alto rischio.
Nuovi inibitori del proteasoma e IMiDe: Quattro nuovi inibitori del proteasoma per via endovenosa e orale sono attualmente in fase di studio nella NDMM e nella RRMM. Di questi, sono già disponibili dati di fase III per carfilzomib (i.v.) (ASPIRE), con altri che seguiranno, e sono attualmente in corso anche studi di fase III per ixazomib (p.o.) (TOURMALINE-MM1, -MM2, -MM3). La pomalidomide viene studiata anche in nuove terapie di combinazione efficaci.
Terapie con anticorpi: Gli antigeni target più comuni sono CD38, SLAMF7 (CS1), CD138 e BCMA. L’anticorpo anti-CD38 daratumumab e soprattutto l’anticorpo anti-CS1 elotuzumab sono già stati molto studiati. Sono disponibili dati di Fase III per elotuzumab, che deve essere combinato con altri farmaci per ottenere l’efficacia, nella RRMM (ELOQUENT-2). Gli stessi epitopi sulle plasmacellule possono essere utilizzati anche per le immunotossine (coniugati anticorpo-farmaco, ad esempio indatuximab ravtansine) o per le cellule CAR-T.
Altre classi di sostanze: Sono disponibili dati di Fase III sull’inibitore HDAC panobinostat nella RRMM (PANORAMA1). Sono in corso studi su inibitori specifici di HDAC6 (ricolinostat). Gli inibitori del checkpoint (PD-1 e PD-L1) sono in fase di studio, in combinazione con altre immunoterapie stimolanti le cellule T; l’efficacia in monoterapia non è stata riscontrata. A causa della frequenza della deregolazione di ciclinaD nel mieloma, si stanno studiando sostanze che interferiscono specificamente con il ciclo cellulare, come gli inibitori di CDK (seliciclib), gli inibitori del trasporto nucleo-citoplasmatico (inibitori di SINE, ad esempio selinexor) e i farmaci che attaccano la proteina del fuso della chinesina (ad esempio filanesib/Arry-520); per quest’ultimo esiste anche un biomarcatore (AAG). Inoltre, come in altre aree dell’ematologia e dell’oncologia, esistono approcci per intervenire sulla trasduzione del segnale (PI3K/AKT/mTOR, RAF/MEK/ERK, JAK/STAT, NFkB) e per inibire le proteine anti-apoptotiche (Bcl-2, Bcl-xL) (ad esempio, utilizzando ABT-199).
A causa dell’abbondanza di opzioni terapeutiche, in futuro sarà fondamentale trovare la giusta combinazione e sequenza di terapie per il paziente giusto.
Letteratura:
- Rajkumar SV, et al: Criteri aggiornati dell’International Myeloma Working Group per la diagnosi di mieloma multiplo. Lancet Oncol 2014; (12): e538-548.
- Greipp PR, et al: Sistema di stadiazione internazionale per il mieloma multiplo. J Clin Oncol 2005; 23(15): 3412-3420.
- Palumbo A, et al: Sistema di stadiazione internazionale rivisto per il mieloma multiplo: un rapporto del Gruppo di lavoro internazionale sul mieloma. J Clin Oncol 2015; 33(26): 2863-2869.
- Palumbo A. et al: La valutazione geriatrica predice la sopravvivenza e le tossicità nei pazienti anziani affetti da mieloma: un rapporto dell’International Myeloma Working Group. Sangue 2015; 125(13): 2068-2074.
- Larocca A, Palumbo A: Come tratto i pazienti con mieloma fragile. Sangue 2015.
- Attal M, et al: Uno studio prospettico e randomizzato di trapianto autologo di midollo osseo e chemioterapia nel mieloma multiplo. Intergroupe Francais du Myelome. N Engl J Med 1996; 335(2): 91-97.
- Palumbo A, et al: Trapianto autologo e terapia di mantenimento nel mieloma multiplo. N Engl J Med 2014; 371(10): 895-905.
- Wildes TM, et al: Mieloma multiplo nell’adulto anziano: migliori prospettive, maggiori sfide. J Clin Oncol 2014; 32(24): 2531-2540.
- Terpos E, et al: Raccomandazioni dell’International Myeloma Working Group per il trattamento della malattia ossea correlata al mieloma multiplo. J Clin Oncol 2013; 31(18): 2347-2357.
- Giralt S, et al.: Società Americana di Trapianto di Sangue e Midollo, Società Europea di Trapianto di Sangue e Midollo, Rete di Studi Clinici sul Trapianto di Sangue e Midollo e Gruppo di Lavoro Internazionale sul Mieloma Conferenza di Consenso sul Trapianto di Cellule Ematopoietiche di Salvataggio in Pazienti con Mieloma Multiplo Recidivato. Biol Blood Marrow Transplant 2015.
- Samaras P, et al.: Stato attuale e raccomandazioni aggiornate per la diagnosi e il trattamento del mieloma plasmacellulare in Svizzera. Swiss Med Wkly 2015: 145: w14100.
InFo ONCOLOGIA & EMATOLOGIA 2016; 4(1): 24-29