Il trattamento con levodopa nella malattia di Prakinson spesso porta a fluttuazioni motorie e discinesie. Per alcuni pazienti selezionati in fase avanzata, la stimolazione cerebrale profonda, che funziona applicando impulsi ad alta frequenza a specifiche aree del cervello, si è rivelata il gold standard. In particolare, le fluttuazioni possono essere trattate bene in questo modo, ma anche i sintomi non motori, come il dolore responsivo alla levodopa. Nel complesso, la stimolazione cerebrale profonda, che viene offerta solo da alcuni centri in Svizzera come parte di una medicina altamente specializzata, dovrebbe essere presa in considerazione per i pazienti con PD che non possono essere trattati in modo sufficientemente efficace con metodi di terapia farmacologica, cioè per i quali i sintomi motori o la qualità della vita non possono essere migliorati in modo soddisfacente con le terapie orali. L’indicazione deve essere controllata non appena si verificano le prime fluttuazioni dell’effetto, poiché il rapporto rischio-rendimento peggiora con il progredire della malattia.
Insieme al morbo di Alzheimer, la malattia di Parkinson (o: sindrome di Parkinson idiopatica) è una delle malattie neurodegenerative più comuni; gli sviluppi demografici e il fatto che le persone invecchiano sempre di più contribuiscono in modo significativo al fatto che la prevalenza continua ad aumentare. La malattia di Parkinson si manifesta non solo con sintomi motori, ma anche con una serie di sintomi non motori.
Il trattamento dei classici sintomi motori di bradicinesia, rigidità e tremore si basa principalmente sulla sostituzione di sostanze che hanno come bersaglio i recettori striatali della dopamina, portando a una parziale ricostituzione della normale funzione dei gangli basali. All’inizio della terapia, questa strategia porta a un ottimo controllo dei sintomi nella maggior parte dei pazienti con PD, anche se il tremore – se presente – non risponde ai farmaci dopaminergici in tutti i pazienti. A lungo termine, il trattamento con sostanze dopaminergiche, ma soprattutto con preparati a base di levodopa, spesso porta a fluttuazioni motorie e discinesie. Questo porta a un deterioramento dell’indipendenza e della qualità di vita delle persone colpite.
Oggi esistono diverse escalation di trattamento possibili per questi pazienti in fase avanzata e la stimolazione cerebrale profonda si è affermata come un eccellente gold standard basato sull’evidenza per i pazienti accuratamente selezionati (Tabelle 1 e 2).


Già nel 1987 è stato dimostrato che la modulazione elettrica ad alta frequenza dell’attività neuronale nel nucleo subtalamico porta a un miglioramento reversibile dei sintomi del Parkinson, confermato dai primi studi clinici [1–3]. Nel frattempo, esistono ampi studi randomizzati che hanno testato l’efficacia della stimolazione cerebrale profonda rispetto al miglior trattamento farmacologico [4, 5]. L’efficacia è quindi chiaramente dimostrata, così come l’influenza positiva sulla qualità della vita, il che spiega perché ad oggi più di 100.000 pazienti sono stati trattati con questo metodo in tutto il mondo.
Funzione ed effetto
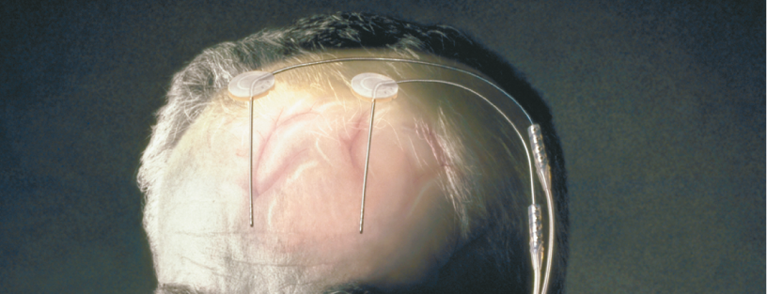
La stimolazione cerebrale profonda funziona applicando impulsi ad alta frequenza in aree cerebrali definite, dove gli elettrodi sono collegati allo stimolatore vero e proprio (“pacemaker cerebrale”) mediante cavi sottocutanei e modulano la funzione dei neuroni, le loro connessioni e quindi la trasmissione del segnale nei gangli della base nell’area target nervosa centrale corrispondente (Fig. 1).
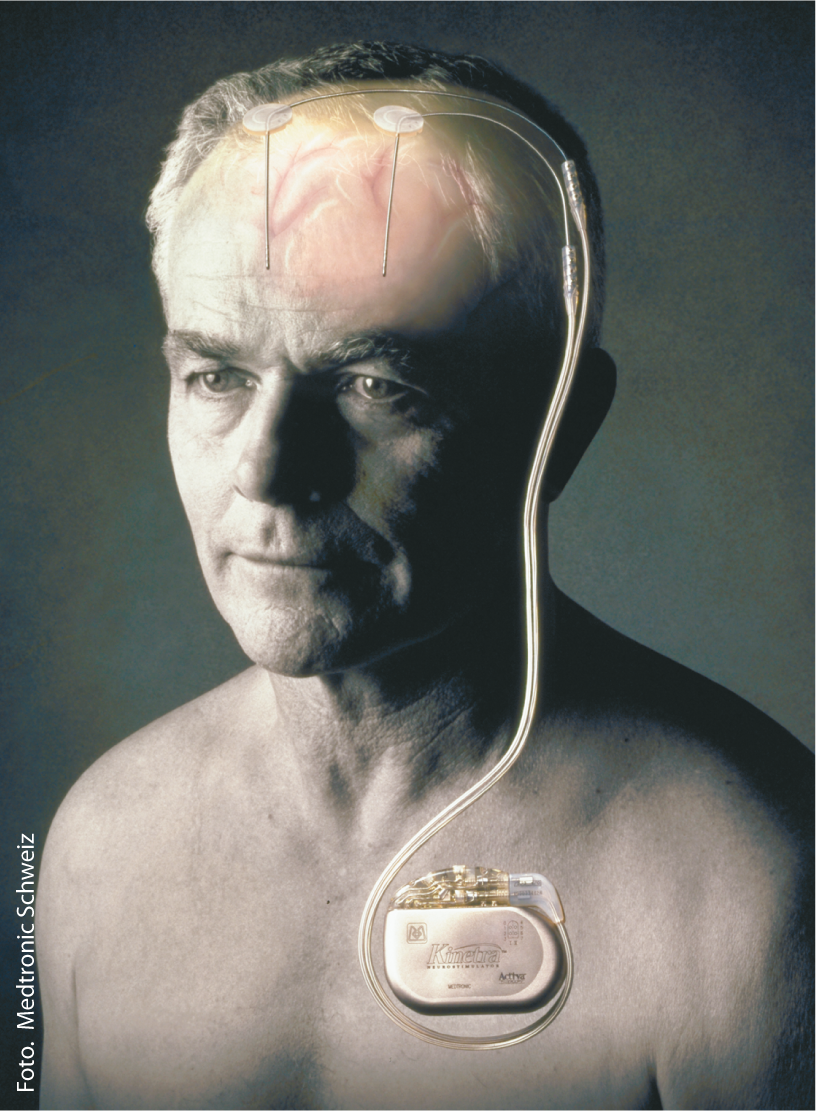
Fig. 1: Elettrodi e stimolatore
La terapia migliora sia i sintomi motori che, soprattutto, le fluttuazioni: I pazienti rimangono in un buono stato motorio più a lungo e sono meno ipo- o discinetici [4, 5]. In linea di principio, migliore è la risposta di rigidità e bradicinesia alla levodopa, maggiore è l’efficacia della stimolazione. Anche il tremore risponde, anche in questo caso in assenza di risposta ai farmaci dopaminergici. I sintomi assiali come l’instabilità posturale o la disfunzione posturale, invece, non rispondono ai farmaci o alla stimolazione cerebrale profonda. L’effetto dura per anni, anche se è possibile un decadimento parziale con la stimolazione del globus pallidus. Con la stimolazione subtalamica, i farmaci possono essere ridotti dopo l’intervento.
La stimolazione cerebrale profonda ha anche effetti terapeutici sui sintomi non motori, soprattutto sul dolore responsivo alla levodopa, che può regredire con la stimolazione subtalamica [6]. Forse a causa della co-stimolazione delle parti limbiche del nucleo subtalamico, può verificarsi un miglioramento dell’umore, fino a uno stato ipomaniacale.
La riduzione della dose giornaliera di farmaco nei pazienti con stimolazione subtalamica può ridurre gli effetti collaterali indotti dal farmaco, come, in particolare, i disturbi del controllo degli impulsi o l’eccessiva sonnolenza diurna. Una riduzione troppo rapida dei farmaci dopaminergici, invece, può portare all’apatia e alla depressione.
Effetti collaterali e complicazioni
Gli effetti collaterali, come i disturbi della deambulazione, la disartria, l’ipomania, i disturbi oculomotori o la discinesia, possono verificarsi a seconda del sito di stimolazione e dell’intensità e possono essere ridotti al minimo, per quanto possibile, da un lato con test in sala operatoria su pazienti svegli e dall’altro regolando la stimolazione nelle prime settimane o nei primi mesi dopo l’intervento, ma non possono essere sempre evitati. Le complicazioni specifiche del dispositivo, come la rottura del cavo o la dislocazione, si verificano occasionalmente, ma soprattutto dopo un trauma.
I rischi chirurgici sono ridotti, ma l’emorragia intracranica e le infezioni non possono essere completamente escluse anche con la migliore preparazione ed esecuzione possibile. La durata della batteria è di 2-7 anni, a seconda dell’intensità della stimolazione, e la sostituzione della batteria stessa è semplice.
Quale punto di riferimento nel cervello?
L’argomento di discussione è la questione di quale punto bersaglio nel cervello sia più efficace e meglio tollerato per i pazienti con Parkinson. Sia il nucleo subtalamico che il globus pallidus interno sono regolarmente utilizzati come bersagli, con la maggior parte degli esperti che interpretano il nucleo subtalamico come la struttura bersaglio più efficace, anche se questa discussione non può essere considerata chiusa [7, 8]. D’altra parte, la stimolazione nel globus pallidus presenta dei vantaggi per quanto riguarda la tolleranza neuropsichiatrica, motivo per cui la procedura ottimale deve essere decisa separatamente per i singoli pazienti. Altre possibili aree target sono attualmente discusse in letteratura, ma non possono essere trattate in questa breve panoramica.
Ora di inizio della terapia
Fino a poco tempo fa, le persone tendevano ad aspettare troppo a lungo prima di utilizzare la stimolazione cerebrale profonda. Spesso i pazienti venivano operati solo quando i sintomi non motori avevano già compromesso in modo massiccio la qualità della vita. Uno studio franco-tedesco pubblicato di recente ha dimostrato che la stimolazione cerebrale profonda è superiore al trattamento farmacologico anche nel decorso precoce della malattia [9]. In questo studio, l’età media dei pazienti era di 52 anni e il decorso medio della malattia era di sette anni e mezzo. Per analogia, l’analisi (non pubblicata) dei nostri dati ha dimostrato che i pazienti con il decorso più breve della malattia hanno risposto in modo più evidente non solo in termini di qualità di vita, ma anche di riduzione dei sintomi motori.
Letteratura:
- Bergman H, Wichmann T, DeLong MR: Inversione del parkinsonismo sperimentale mediante lesioni del nucleo subtalamico. Science 1990; 249: 1436-1438.
- Benabid AL, et al: Effetti acuti e a lungo termine della stimolazione del nucleo subtalamico nella malattia di Parkinson. Stereotact Funct Neurosurg 1994; 62: 76-84.
- Limousin P, et al: Effetto dei segni e dei sintomi parkinsoniani della stimolazione bilaterale del nucleo subtalamico. Lancet 1995; 345: 91-95.
- Deuschl G, et al: Uno studio randomizzato sulla stimolazione cerebrale profonda per la malattia di Parkinson. N Engl J Med 2006; 355: 896-908.
- Weaver FM, et al: Stimolazione cerebrale profonda bilaterale rispetto alla migliore terapia medica per i pazienti con malattia di Parkinson avanzata: uno studio randomizzato controllato. JAMA 2009; 301: 63-73.
- Sürücü O, et al: Stimolazione cerebrale profonda subtalamica rispetto alla migliore terapia medica per il dolore responsivo alla l-dopa nella malattia di Parkinson. Dolore 2013; 154: 1477-1479.
- Weaver FM, et al: Studio randomizzato sulla stimolazione cerebrale profonda per la malattia di Parkinson: risultati a trentasei mesi. Neurologia 2012; 79: 55-65.
- Deep-Brain Stimulation for Parkinson’s Disease Study Group: Stimolazione cerebrale profonda del nucleo subtalamico o della pars interna del globo pallido nella malattia di Parkinson. N Engl J Med 2001; 345: 956-963.
- Schuepbach WM, et al: Neurostimolazione per la malattia di Parkinson con complicazioni motorie precoci. N Engl J Med 2013; 368: 610-622.
- Linee guida della Società tedesca di neurologia, www.dgn.org.
- Lhommée E, et al: Stimolazione subtalamica nella malattia di Parkinson: ripristinare l’equilibrio dei comportamenti motivati. Brain 2012; 135: 1463-1477.