La gravità e la prevalenza della carenza di ferro nell’insufficienza renale cronica è parallela al suo stadio ed è di origine multifattoriale. Nei pazienti con insufficienza renale, l’omeostasi del ferro è significativamente alterata, per cui i parametri ottimali del ferro sono definiti in modo diverso rispetto alla salute renale. Questo ha implicazioni sugli aspetti dell’anamnesi, sugli esami da effettuare e sui limiti e gli obiettivi. Questo articolo si occupa di questo e analizza la sostituzione del ferro in forma orale e parenterale.
L’elemento ferro è essenziale e, in termini di quantità, l’oligoelemento più importante per quasi tutti gli organismi viventi. Presente negli animali e negli esseri umani nelle forme divalente e trivalente, il ferro è principalmente coinvolto nel legame con l’ossigeno e nel trasferimento di elettroni. Queste proprietà fisico-chimiche si traducono nelle sue funzioni principali di legante e trasportatore di ossigeno, catalizzatore di reazioni redox nella catena respiratoria cellulare e componente attivo di numerosi enzimi non eme. Tuttavia, la capacità degli ioni di ferro liberi di formare specie di ossigeno altamente reattive (ad esempio, radicali idrossilici) dal perossido di idrogeno (la cosiddetta reazione di Fenton) e di provocare la perossidazione lipidica ha un notevole potenziale citotossico. Per questo motivo, la maggior parte del ferro, sia a livello intracellulare che extracellulare, è presente in forma redox-inattiva legata a proteine specializzate [1].
Omeostasi del ferro
Il corpo umano adulto contiene circa 3,5-5 g di ferro elementare [2]. Questo è presente quasi esclusivamente in forma legata come ferro di deposito e funzionale. Il pool di stoccaggio (0,8-1,2 g) è costituito dal complesso proteico ferritina, una proteina di circa 450 kDa piena di ossido di idrossido di ferro(III), e dall’emosiderina strettamente intracellulare, che è una forma di stoccaggio lenta e difficile da mobilitare della ferritina denaturata. Il fegato, la milza e il midollo osseo sono particolarmente ricchi di ferro di deposito. Sebbene la percentuale di ferritina extracellulare sia relativamente piccola, la sua concentrazione sierica sembra correlarsi bene con la riserva di ferro intracellulare nei casi normali.
Il ferro funzionale comprende l’emoglobina (2,5-3 g), che è la più importante in termini di quantità, la mioglobina (150 mg), il ferro intracellulare (80 mg) e gli enzimi contenenti ferro (10 mg). Il ferro di trasporto circolante (4 mg) legato alla transferrina, una glicoproteina di circa 80 kDa, costituisce relativamente solo una piccola frazione della quantità totale. In questo modo, il ferro rapidamente scambiabile disponibile per la risintesi dell’ema e degli enzimi contenenti ferro (25 mg/giorno) viene riciclato più volte al giorno. Ciò avviene attraverso la scomposizione dei gruppi ematici nel sistema reticoloendoteliale. La saturazione della transferrina, il rapporto tra il ferro sierico e la capacità totale di legare il ferro (transferrina), è una misura indiretta del ferro disponibile [1, 3].
La Figura 1 offre una panoramica della quantità di ferro presente e della sua distribuzione negli adulti sani.
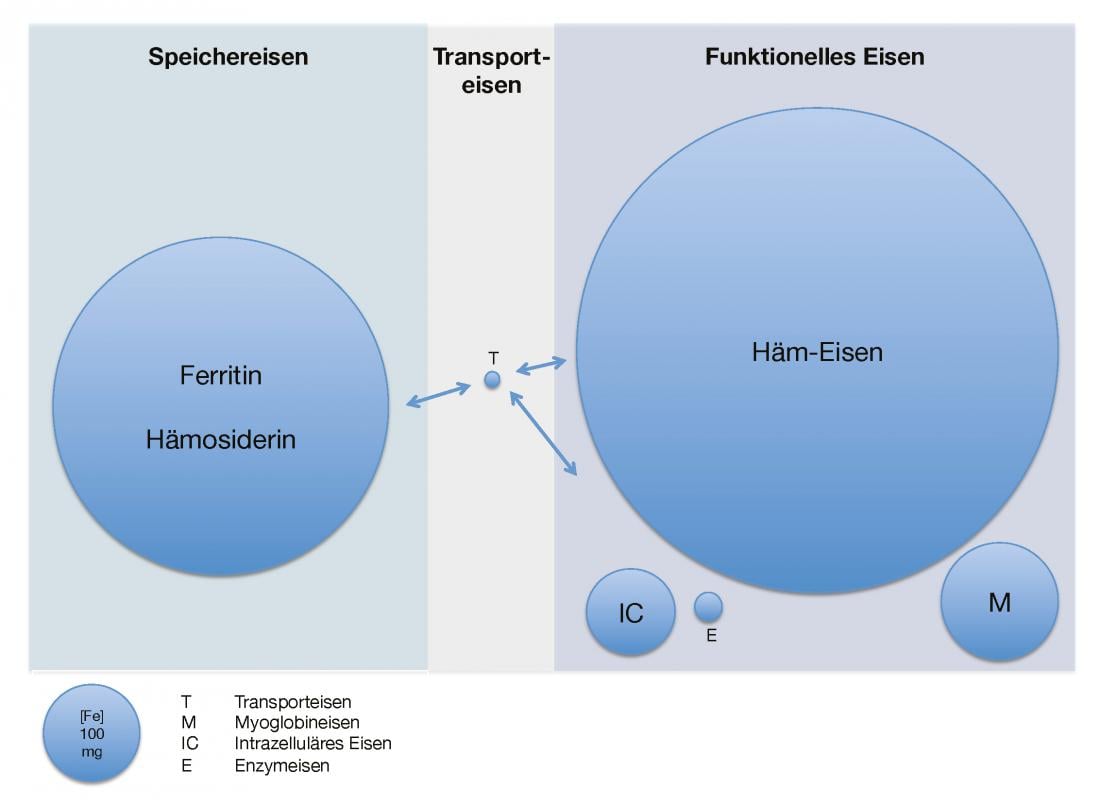
Fig. 1: Quantità e distribuzione del ferro disponibile negli adulti sani
La distribuzione del ferro nell’organismo sotto l’aspetto quantitativo. T sta per ferro legato alla transferrina, M per ferro della mioglobina, IC per ferro intracellulare ed E per ferro contenuto negli enzimi.
A causa della sua duplice proprietà di oligoelemento indispensabile e di tossina altamente potente per organi e cellule, l’equilibrio del ferro e la sua compartimentazione nell’organismo sono strettamente regolati. A differenza dei cationi polivalenti come il calcio, l’omeostasi del ferro è regolata esclusivamente dal riassorbimento, poiché le perdite normali non possono essere controllate e non è possibile un ulteriore aumento dell’escrezione di ferro. Pertanto, negli individui sani in stato stazionario, l’apporto giornaliero di ferro per via enterale (1-2 mg negli uomini, 2-3 mg nelle donne mestruate) copre le perdite naturali attraverso l’esfoliazione delle cellule della pelle e della mucosa, le mestruazioni nelle donne in età fertile e le tracce attraverso le feci e le urine.
Nei mammiferi, il ferro(III) scarsamente assorbibile viene ridotto al ferro(II) più solubile dal citocromo B duodenale nel polo apicale dell’enterocita. Poi, l’assorbimento intracellulare nell’enterocita avviene attraverso il trasportatore di metalli divalenti (DMT1). Il ferro può anche essere assunto con un meccanismo parallelo e molto efficiente come emina, un prodotto di degradazione dell’ema e della mioglobina, abbondante nei prodotti a base di carne, attraverso il trasportatore haem carrier protein 1 (HCP1). Il ferro(II) viene poi esportato dalla ferroportina basolaterale e ossidato direttamente dalla ceruloplasmina in ferro(III), che si lega alla transferrina. Tuttavia, il tasso di riassorbimento del ferro assorbito per via orale è basso, con una media del 6% negli uomini e circa il doppio nelle giovani donne. Un aumento quando il sistema è stimolato al massimo (carenza di ferro) può essere solo del 20%. Un ruolo chiave in questa fine regolazione è svolto dall’ormone peptidico epcidina, che è stato scoperto circa 13 anni fa. Questo lega e induce la degradazione dell’esportatore di ferro ferroportina negli enterociti duodenali, nei macrofagi reticoloendoteliali e negli epatociti e impedisce al ferro di essere rilasciato alla transferrina. Ciò comporta un basso assorbimento di ferro a livello enterico e un ridotto rilascio di ferro dalla ferritina alla transferrina, noto come blocco reticoloendoteliale. Il ferro circolante e i mediatori infiammatori stimolano la produzione di epcidina, mentre l’ipossiemia e la somministrazione di ESA hanno un effetto inibitorio [1, 3-5].
Carenza di ferro nell’insufficienza renale cronica
Una delle caratteristiche più importanti dell’insufficienza renale cronica è l’anemia renale, che è associata a una riduzione della qualità di vita, a un aumento della morbilità cardiovascolare e della mortalità per tutte le cause [6, 7]. Oltre alla carenza relativa di eritropoietina [8, 9], alla resistenza all’eritropoietina uremica [10] e al tempo di sopravvivenza significativamente ridotto degli eritrociti nel milieu uremico [11], la carenza assoluta e funzionale di ferro deve essere menzionata come un importante fattore causale. Entrambi sono anche fattori importanti nella resistenza all’eritropoietina, che è caratterizzata dall’elevata richiesta di agenti stimolanti l’eritropoiesi (ESA) e dalla difficoltà o addirittura dall’impossibilità di raggiungere il target terapeutico senza la necessità di trasfusioni [12, 13].
La prevalenza e la gravità della carenza di ferro nell’insufficienza renale cronica è parallela al suo stadio ed è di origine multifattoriale. L’inappetenza frequentemente osservata in questo collettivo, la restrizione alimentare di fosfati prescritta e l’uso elevato e generalizzato di inibitori della pompa protonica e di leganti del fosfato contenenti calcio portano a una riduzione dell’assunzione e dell’assorbimento di ferro [14, 15]. A causa della trombopatia uremica e della gastrite, ci sono ulteriori perdite gatrointestinali. Parallelamente, con l’aumento dell’insufficienza renale, si verifica un aumento della formazione e dell’accumulo di epcidina a causa dello stato proinfiammatorio associato all’uremia e della diminuzione della clearance degli ormoni peptidici. Questa particolare costellazione spiega la frequente carenza funzionale di ferro di vario grado, caratterizzata da valori elevati di ferritina e valori di saturazione della transferrina da bassi a normali [4, 12, 15, 16]. Di conseguenza, nei pazienti con insufficienza renale, il valore di ferritina per la definizione di carenza di ferro è fissato a 100-200 ng/ml rispetto ai pazienti sani [6, 7, 15, 17]. Una formulazione alternativa potrebbe essere che l’utilizzo ottimale del ferro in questi pazienti avviene a spese di un aumento del ferro di deposito. Quindi, i livelli di ferritina sierica inferiori a 100 ng/ml hanno una risposta subottimale all’ESA e riserve insufficienti [18].
Al contrario, quasi tutti i pazienti con insufficienza renale, compresi i pazienti in emodialisi, hanno riserve di ferro intramidollari sufficienti quando i livelli di ferritina sierica sono superiori a 300 ng/ml [19]. Tuttavia, Mirahmadi et al. decenni fa ha dimostrato biopticamente che a livelli di ferritina sierica superiori a 124 ng/ml alcuni pazienti in emodialisi mostrano già segni di sovraccarico di ferro [20]. L’intera situazione diventa ancora più complessa se si considera il fatto che alcuni pazienti in emodialisi con elevati livelli di ferritina sierica (fino a oltre 1200 ng/ml) continuano a mostrare una risposta positiva alla somministrazione di ferro parenterale, soprattutto quando la saturazione della transferrina è subottimale, inferiore al 20% [21, 22].
Queste cifre dimostrano chiaramente che la valutabilità generale di questi test deve essere messa in prospettiva [23]. In caso di rapida mobilitazione della riserva di ferro, come avviene, ad esempio, nel contesto di una terapia ESA appena iniziata o intensificata, l’apporto di ferro dalle riserve può essere insufficiente, portando alla cosiddetta eritropoiesi limitata al ferro. Può verificarsi indipendentemente dalla carenza funzionale di ferro ed è caratterizzata da un ridotto contenuto di emoglobina negli eritrociti e nei loro precursori. La percentuale di eritrociti ipocromici (% HRC) e il contenuto di emoglobina reticolocitaria (CHr) sono indicatori ben consolidati di carenza funzionale di ferro e di oculopatia limitata al ferro. Un CHr inferiore a 29 pg/cell nei pazienti in terapia con ESA è quindi indicativo di una carenza funzionale di ferro. L’emoglobina equivalente reticolocitaria (Ret-HE) inferiore a 30,6 pg/cell, una controparte della CHr misurata con un metodo alternativo, è di per sé altamente predittiva di una buona risposta alla somministrazione di ferro per via endovenosa nei pazienti emodializzati trattati con ESA. Parametri più recenti e più precisi della carenza funzionale di ferro e dell’eritropoiesi limitata al ferro, come la protoporfirina di zinco eritrocitaria (ZPP) e il recettore solubile della transferrina (sTFR), non sono attualmente raccomandati come test standard nei pazienti con insufficienza renale a causa della disponibilità limitata, dei costi più elevati e dell’esperienza ancora insufficiente [22].
Secondo i criteri sopra menzionati, la prevalenza della carenza di ferro nei pazienti con insufficienza renale non dipendenti dalla dialisi (CKD stadi 3 e 4) è superiore al 50% [15]. La situazione dei pazienti in emodialisi è ancora più critica. Oltre ai fattori già menzionati, si verifica una perdita considerevole di ferro di 1-3 g (con ematocrito normale, 1 ml di sangue contiene circa 0,5 mg di ferro) a causa dei numerosi prelievi di sangue e del sequestro regolare di sangue nel filtro e nelle apparecchiature di dialisi. Questo porta praticamente a una carenza di ferro in tutti i pazienti, se le perdite non vengono rimpiazzate da un’adeguata sostituzione [10].
La carenza di ferro isolata senza anemia (EoA), un’entità sempre più ben definita nei pazienti con competenza renale [24, 25], è rara nei pazienti con insufficienza renale. Si tratta spesso di situazioni iatrogene, in cui i pazienti non ricevono la sostituzione del ferro o addirittura la flebotomia per molto tempo, a causa di valori di ematocrito spontaneamente elevati. Una terapia inadeguata dell’anemia renale con ESA ad alto dosaggio e una sostituzione del ferro mancante o insufficiente possono portare allo stesso quadro. I sintomi generali tipici dell’EoA, come l’affaticamento, il disturbo da deficit di attenzione, la termoregolazione disturbata e la perdita di capelli, sono assenti o mascherati dai sintomi uremici che sono in primo piano. Solo la sindrome delle gambe senza riposo (RLS) sembra essere associata alla carenza funzionale di ferro in questa popolazione, indipendentemente dal grado di anemia [26].
Sostituzione del ferro e monitoraggio nell’insufficienza renale
Tutti i pazienti renali devono essere sottoposti a screening per verificare la presenza di anemia. La prevalenza dell’anemia renale aumenta significativamente a partire dallo stadio 3 della CKD e richiede un work-up appropriato [6, 7, 27]. Oltre a un’anamnesi e a un esame mirato, questo include almeno un emocromo completo con indici eritrocitari e conta assoluta dei reticolociti e un livello sierico di vitamina B12 e folati. Lo stato del ferro deve essere valutato per il ferro di deposito (ferritina sierica) e per il ferro rapidamente mobilizzabile (saturazione della transferrina e/o contenuto di emoglobina reticolocitaria) [6, 7].
La sostituzione del ferro è raccomandata in linea di principio per tutti i pazienti insufficienti renali dializzati e non dializzati con anemia e terapia ESA. Inoltre, la somministrazione di ferro per via parenterale può evitare o almeno ritardare la necessità di una terapia con ESA nei pazienti non dializzati e contribuisce a una riduzione sostanziale della necessità di ESA nei pazienti in emodialisi, il che è associato a vantaggi finanziari e forse anche sanitari [6, 7, 13, 28].
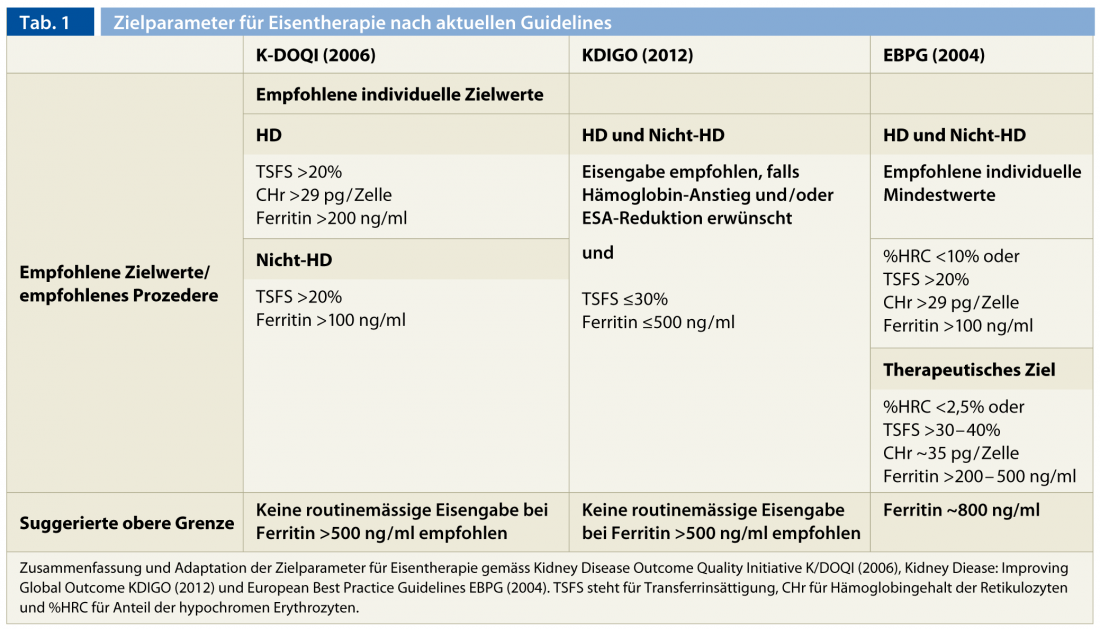
Sebbene non sia stato definito in modo uniforme dai gruppi di esperti, è possibile estrarre un consenso sui valori target. Un valore minimo di 200 ng/ml per la ferritina sierica e il 20% per la saturazione della transferrina sono accettati all’unanimità. In alternativa, oltre alla saturazione della transferrina, vengono definiti dei valori target per CHr (>29 pg/cell) e % HCR (<10%). Questi requisiti minimi non rappresentano di per sé i valori target a livello di popolazione, che sono naturalmente più elevati.
Rimane più complicato fare una dichiarazione chiara sui limiti superiori per quanto riguarda le complicanze immediate e tardive, ancora poco studiate, della terapia con ferro parenterale [29–31]. Nei pazienti in emodialisi con sovraccarico di ferro sono stati osservati segni di tossicità epatica e un aumento della mortalità e della suscettibilità alle infezioni [15, 29, 32]. In generale, l’integrazione di ferro non è raccomandata per livelli di ferritina superiori a 500 ng/ml [6, 7, 17]. Inoltre, in caso di infezioni attive e febbre, la somministrazione parenterale di ferro deve essere evitata a causa degli effetti deleteri sul sistema immunitario e della ridotta capacità di trasporto associata all’infiammazione [7]. Il deficit funzionale persistente di ferro richiede ulteriori chiarimenti su un’infezione criptogenetica o una neoplasia. Se entrambi sono esclusi, si può ricorrere all’ottimizzazione del trattamento emodialitico e alla somministrazione controllata di ferro parenterale per cercare di superare questa condizione. Nel prossimo futuro, si spera di poter trattare il “blocco del ferro uremico” in modo ancora più efficiente attraverso l’uso terapeutico degli inibitori dell’epcidina. La Tabella 1 riassume i parametri target per la terapia con il ferro secondo le linee guida oggi disponibili.
L’effetto terapeutico deve essere regolare per garantire una riserva di ferro ottimale continua e per evitare effetti collaterali tossici dovuti all’accumulo incontrollato di ferro di deposito (da circa 500-800 ng/ml di ferritina) e/o al superamento della capacità di trasporto del siero con un aumento deleterio del ferro libero nel siero (TSFS >60%) [33]. È importante notare che la valutabilità dei parametri del ferro è gravemente compromessa subito dopo la somministrazione di ferro per via parenterale e si deve osservare un intervallo di almeno una settimana tra la somministrazione e la misurazione. Si raccomandano controlli mensili durante le fasi di saturazione o all’inizio della terapia con ESA. Nei casi stabili e nei pazienti senza terapia ESA, sono sufficienti controlli trimestrali.
Sostituzione orale del ferro
Nonostante il prezzo basso e la facilità d’uso, la sostituzione orale del ferro presenta diversi svantaggi. Il ferro assunto per via orale può provocare un danno ossidativo nel tratto gastrointestinale, che può manifestarsi clinicamente con vomito, dispepsia e diarrea. La scarsa compliance che ne deriva può essere significativa, arrivando fino al 70% in alcuni collettivi [34]. Inoltre, l’efficacia della sostituzione orale del ferro rimane molto bassa per i motivi già citati.
Una reintegrazione più efficace delle riserve di ferro e una migliore risposta all’ESA possono essere ottenute solo con la forma parenterale [14]. Anche con riserve di ferro precedentemente normalizzate, la somministrazione perorale non è stata in grado di mantenere sufficienti riserve di ferro a lungo termine [35]. Quando si utilizzano preparazioni contenenti sali di ferro ad alte dosi (ferro[II]-anion), la diffusione passiva e incontrollata del ferro può portare a un aumento significativo del ferro libero, il cosiddetto ferro non legato alla transferrina (NTBI), a causa dell’esaurimento dei meccanismi di trasporto locale, che può anche provocare una tossicità sistemica. In generale, la sostituzione orale dovrebbe essere limitata ai pazienti non dializzati senza terapia con ESA e senza grave carenza di ferro, con una valutazione regolare dell’efficacia e della tolleranza [6, 7].
Sostituzione del ferro per via parenterale
L’elevato fabbisogno di ferro, soprattutto nei pazienti in emodialisi, supera la capacità di assorbimento e rilascio del ferro enterale dal pool di accumulo, che è già compromesso nel contesto dell’insufficienza renale, e spiega la chiara superiorità terapeutica della somministrazione parenterale rispetto alla somministrazione perorale. Per questo motivo, è raccomandata come forma di somministrazione standard in tutti i pazienti con insufficienza renale. In Svizzera sono attualmente disponibili tre preparati di ferro per via parenterale (Tab. 2).
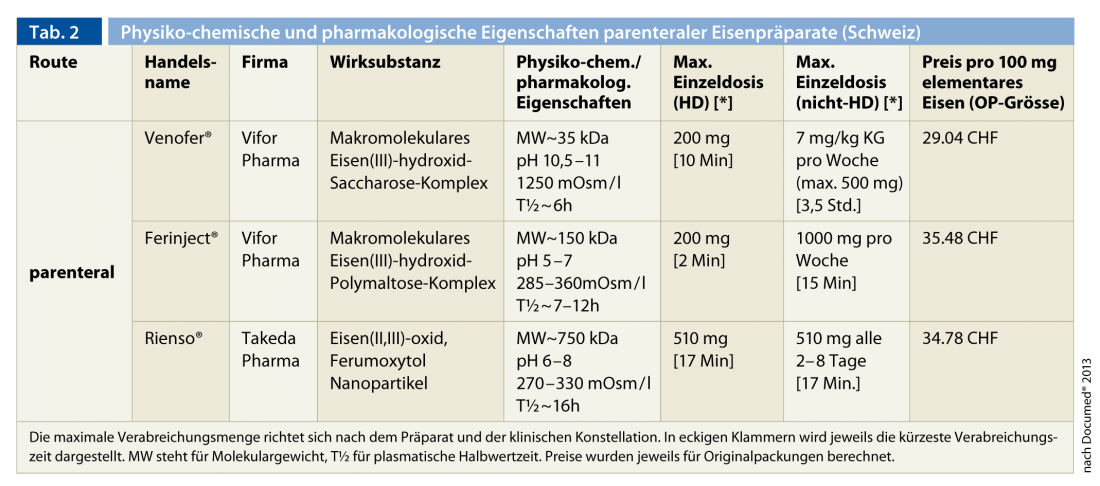
Si tratta, in ordine cronologico di approvazione, di Venofer® (complesso macromolecolare di ferro(III) idrossido di saccarosio), Ferinject® (complesso macromolecolare di ferro(III) idrossido di polimaltosio) e Rienso® (nanoparticelle di ferro(II, III) ossido (ferumoxytol)). Le preparazioni a basso e alto peso molecolare contenenti destrano non sono più in commercio a causa delle reazioni avverse potenzialmente letali (anafilassi). L’esperienza acquisita per decenni con il precedente preparato (Venofer®) è notevole. Le due preparazioni più recenti consentono la somministrazione di dosi singole più elevate grazie alle loro proprietà fisico-chimiche (pH e osmolalità) e soprattutto alla maggiore stabilità del complesso di ferro. Questo è un vantaggio significativo per i pazienti ambulatoriali non emodializzati. In tutti i casi, la frequenza degli effetti collaterali gravi e pericolosi per la vita è molto bassa. Non ci si devono aspettare reazioni incrociate con i preparati contenenti destrano, che non sono disponibili in Svizzera [15, 36]. Occasionalmente, si osservano episodi ipotensivi, broncospasmo, reazioni cutanee, mialgie e artralgie o febbre, soprattutto in caso di somministrazione rapida.
La terapia si divide in una fase di reintegro e in una fase di mantenimento. Il fabbisogno iniziale di ferro può essere calcolato secondo la formula di Ganzoni:
Deficit totale di ferro (mg) = [Soll-Hb – Ist-Hb (g/dl)] × peso corporeo (kg) × 2,4 + ferro di riserva (mg)
Questa quantità può essere somministrata in modo frazionato (Venofer® e Ferinject®) o come dose singola (Ferinject® e Rienso®), a seconda del preparato, della gravità dell’insufficienza renale e della forma di somministrazione. La dose di mantenimento dipende dall’effetto terapeutico raggiunto e dai parametri del ferro regolarmente monitorati.
CONCLUSIONE PER LA PRATICA
- La carenza di ferro assoluta e funzionale è comune nell’insufficienza renale cronica ed è significativamente coinvolta nello sviluppo dell’anemia renale.
- La sostituzione del ferro è un componente centrale nella terapia dell’anemia renale. L’ottimizzazione dei parametri del ferro consente di raggiungere gli obiettivi terapeutici nella maggior parte dei pazienti e di ridurre al minimo l’uso di ESA, il che è associato a una riduzione dei costi e probabilmente a un esito migliore.
- L’omeostasi del ferro è significativamente alterata nell’insufficienza renale, per cui i parametri ottimali del ferro sono definiti in modo diverso rispetto alla salute renale.
- Oggi, la somministrazione parenterale è superiore a quella perorale, grazie alla migliore efficacia e tollerabilità. Le più moderne preparazioni di ferro per via parenterale sono sicure e rendono molto più facile la sostituzione del ferro.
- A causa della mancanza di studi sugli esiti a lungo termine e delle prove esistenti sugli effetti deleteri del sovradosaggio di ferro in questa popolazione, la somministrazione sistematica di ferro deve essere eseguita solo rispettando i valori target.
Robert M. Kalicki, MD
Letteratura:
- Dunn LL, Suryo Rahmanto Y, Richardson DR: Trends Cell Biol 2007; 17, 93.
- Löffler G: Biochimica e patobiochimica. Edizione 7. Springer-Verlag: Berlino 2002.
- Andrews NC: Blood 2008; 112: 219.
- Babitt JL, Lin HY: Am J Kidney Dis 2010; 55: 726.
- Nemeth E, et al.: Science 2004; 306: 2090.
- Am J Kidney Dis 2006; 47: S16.
- Kidney International Supplements 2012; 2: 279.
- Jacobson LO, Goldwasser E, Fried W, Plzak L: Natura 1957; 179: 633.
- McGonigle RJ, Wallin JD, Shadduck RK, Fisher JW: Kidney Int 1984; 25: 437.
- Besarab AF, in: Anemia nella malattia renale. Lippincott Williams and Wilkins: Philadelphia 2007; 2406-2430.
- Eschbach JW: Kidney Int 1989; 35: 134.
- Babitt JL, Lin HY: J Am Soc Nephrol 2012; 23: 1631.
- Coyne DW, Auerbach M: Am J Hematol 2012; 85: 311.
- Fudin R, Jaichenko J, Shostak A, Bennett M, Gotloib L: Nephron 1998; 79: 299.
- Macdougall IC, Geisser P: Iran J Kidney Dis 2012; 7: 9.
- Ashby DR, et al: Kidney Int 2009; 75: 976.
- Nephrol Dial Transplant 2004; 19 [Suppl 2]: ii6.
- Fernandez-Rodriguez AM, et al: Am J Kidney Dis 1999; 34: 508.
- Aljama P, et al: Clin Nephrol 1978; 10: 101.
- Mirahmadi KS, et al: JAMA 1977; 238: 601.
- Chang CH, Chang CC, Chiang SS: Clin Nephrol 2002; 57: 136.
- Thomas DW, et al: Br J Haematol 2013.
- Kalantar-Zadeh K, et al: Am J Kidney Dis 1995; 26: 292.
- Bruner AB, Joffe A, Duggan AK, et al: Lancet 1996; 348: 992.
- Rowland TW, Deisroth MB, Green GM, et al: Am J Dis Child 1988; 142: 165.
- Sloand JA, Shelly MA, Feigin A, et al: Am J Kidney Dis 2004; 43: 663.
- Bethesda MD, National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases 2004.
- Solomon SD, et al: N Engl J Med 2010; 363: 1146.
- Kalantar-Zadeh K, et al: J Am Soc Nephrol 2005; 16: 3070.
- Feldman HI, et al: J Am Soc Nephrol 2002; 13: 734.
- Feldman HI, et al: J Am Soc Nephrol 2004; 15: 1623.
- Vaziri ND: Am J Kidney Dis 2013.
- Hershko C, Graham G, Bates GW, et al: Br J Haematol 1978; 40: 255.
- Kruske SG, Ruben AR, Brewster DR: J Paediatr Child Health 1999; 35: 153.
- Macdougall IC, et al: Kidney Int 1996; 50: 1694.
- Auerbach M, Ballard H: Ematologia Am Soc Hematol Educ Program 2010; 338.











