Circa la metà dei pazienti con NSCLC di nuova diagnosi può ricevere una terapia curativa. La probabilità di ricaduta è maggiore nei primi tre anni successivi. Non ci sono prove valide per un follow-up intensivo. Soprattutto non per il follow-up radiologico a maglie strette.
Il cancro al polmone è la malattia tumorale più comune che porta alla morte. La prognosi sfavorevole è in parte dovuta al fatto che solo circa il 50-55% dei pazienti con carcinoma polmonare non a piccole cellule (NSCLC) viene diagnosticato in uno stadio in cui è possibile offrire una terapia potenzialmente curativa (stadi I-III). A seconda dello stadio, il 30-75% dei pazienti sottoposti a chirurgia curativa subisce una recidiva [1–3]. La maggior parte delle recidive si verifica nei primi tre anni post-operatori [1,4]. Il Gruppo di Studio Polmonare Ludwig ha analizzato il modello di ricaduta in tre studi prospettici [4]. Su 426 pazienti con recidiva documentata, solo il 26% ha avuto una recidiva locale. La sopravvivenza mediana dopo una recidiva è inferiore a un anno [5]. Inoltre, i pazienti dopo un trattamento curativo del NSCLC presentano un rischio elevato di insorgenza di secondi tumori, soprattutto nuovi carcinomi bronchiali, tumori della testa e del collo e carcinomi esofagei [6]. I secondi tumori polmonari metacroni si verificano con un’incidenza dell’1-9% all’anno [7–9]. Nel caso di tumori secondari metacroni del polmone, esiste la possibilità di un nuovo approccio terapeutico potenzialmente curativo (chirurgia o radiazione stereotassica).
Il follow-up nei pazienti con NSCLC trattati in modo curativo serve principalmente a rilevare una recidiva in una situazione in cui la terapia curativa rinnovata rende possibile un miglioramento della sopravvivenza globale e un aumento significativo della qualità di vita. Questo include quindi sia il rilevamento di una recidiva locale che può essere sottoposta a un’altra terapia ablativa locale curativa (chirurgia o radiazione stereotassica), sia il rilevamento di metastasi solitarie a distanza (soprattutto polmone, cervello, ghiandole surrenali) che possono essere resecate o irradiate stereotassicamente con intento curativo in pazienti selezionati. Non ci sono studi prospettici randomizzati che dimostrino il valore del follow-up radiologico strutturato per quanto riguarda la sopravvivenza globale. In questo articolo di revisione, vorremmo discutere le prove per la cura di follow-up e le raccomandazioni delle varie società professionali.
Evidenze sul follow-up nel carcinoma bronchiale
Studi prospettici randomizzati: Moore et al. ha randomizzato 203 pazienti tra il follow-up convenzionale e il follow-up da parte di infermieri specializzati nel cancro del polmone [10]. Tutti i pazienti avevano completato il trattamento curativo e avevano un’aspettativa di vita di almeno tre mesi. Il follow-up convenzionale comprendeva controlli ambulatoriali ogni due o tre mesi. Il gruppo di intervento ha avuto un contatto mensile con un’infermiera specializzata, per telefono o in occasione di una consultazione per identificare i sintomi di progressione della malattia o le complicazioni della terapia precedente. I pazienti del gruppo di intervento avevano una dispnea statisticamente significativa, un tasso inferiore di neuropatia periferica e una migliore qualità di vita dopo dodici mesi. Il gruppo di intervento ha ottenuto risultati significativamente migliori in termini di soddisfazione dopo tre, sei e dodici mesi. La sopravvivenza mediana è stata la stessa in entrambi i gruppi, ma il tempo medio alla progressione sintomatica è stato più breve nel gruppo di intervento (6 vs. 10,2 mesi). Questo studio dimostra che un contatto più intenso e strutturato con il paziente durante il follow-up è importante per la soddisfazione del paziente e la sua qualità di vita e porta a un rilevamento più precoce delle recidive, ma non cambia la prognosi.
Studi comparativi retrospettivi: Virgo et al. Sono stati analizzati 182 pazienti con NSCLC resecato [11]. I pazienti sono stati divisi in un gruppo di follow-up intensivo (n=120) e in un gruppo di follow-up meno intensivo (n=62). Anche se l’analisi era retrospettiva, i gruppi erano ampiamente bilanciati. Tuttavia, i pazienti con un protocollo di follow-up più intenso avevano un numero significativamente maggiore di malattie concomitanti. In questo studio, un follow-up più intensivo – caratterizzato dalla frequenza e dall’estensione dei controlli chimici di laboratorio e radiologici – non ha mostrato alcun miglioramento nel tempo di individuazione di recidive, metastasi o secondi tumori. Anche la sopravvivenza complessiva non era diversa nei due gruppi.
Nakamura et al. ha studiato retrospettivamente 1398 pazienti che sono stati seguiti da chirurghi toracici (n=846) o pneumologi (n=552) dopo resezione curativa di NSCLC [12]. Il follow-up da parte dei chirurghi toracici comprendeva un esame clinico e una radiografia del torace un mese dopo l’intervento e poi ogni tre o quattro mesi per tre anni. Gli pneumologi hanno sottoposto i pazienti a una TAC del torace ogni sei mesi. I pazienti nel follow-up della chirurgia toracica hanno avuto un aumento della mortalità associata al NSCLC (hazard radio, HR 1,279). A causa dell’eterogeneità dei gruppi, soprattutto negli esami radiologici, questi risultati devono essere interpretati con cautela.
Younes e Gross hanno confrontato retrospettivamente il follow-up strutturato intensivo (n=67) con il follow-up basato sui sintomi (n=63) nei pazienti dopo la resezione curativa del NSCLC [13]. Il follow-up intensivo comprendeva esami clinici (settimane 1, 3 e 8, poi bimestrali per i primi sei mesi e trimestrali fino a due anni dopo l’intervento), esami radiografici del torace (settimane 1 e 3 e poi dopo 2, 4, 9, 15 e 24 mesi) e test di funzionalità epatica (dopo uno e due anni). Le caratteristiche cliniche dei due gruppi erano comparabili. Né la sopravvivenza libera da malattia né quella globale erano significativamente diverse. Alla maggior parte dei pazienti è stata diagnosticata una recidiva o una metastasi in base ai sintomi clinici.
Studi a braccio singolo: in uno studio prospettico presso l’Ospedale Universitario di Basilea, 563 pazienti sono stati seguiti per dieci anni dopo la resezione curativa del NSCLC mediante controlli clinici ed esami radiografici del torace [14]. L’intervallo di follow-up è stato trimestrale per due anni, semestrale per altri tre anni e annuale per gli anni 6-10. Questo follow-up ha permesso al 3,1% dei pazienti di ricevere un’ulteriore opzione di trattamento curativo. Circa un terzo dei pazienti con recidiva è stato diagnosticato in base ai sintomi e non durante il follow-up strutturato. Questo studio ha esaminato anche i costi del follow-up strutturato. Sono stati dati 90.000 franchi svizzeri per ogni anno di vita guadagnata.
Walsh et al. sono riusciti a dimostrare in una coorte di 358 pazienti che la diagnosi precoce di una recidiva in pazienti asintomatici non migliorava la prognosi [15]. Westeel et al. ha presentato i dati di un programma di follow-up intensivo con broncoscopia e tomografia computerizzata di polmoni, fegato e ghiandole surrenali ogni sei mesi [16]. In 192 pazienti con NSCLC resecato in modo curativo, il tasso di recidiva è stato del 71%. Nel 26% dei pazienti, la recidiva è stata rilevata attraverso un follow-up strutturato. Il tasso di sopravvivenza dopo tre anni era del 31% nei pazienti asintomatici.
Uno studio asiatico ha analizzato il follow-up strutturato con la TAC [17]. 986 pazienti con NSCLC resecato (48% stadio I) sono stati valutati retrospettivamente. I pazienti sono stati seguiti a intervalli di tre mesi per i primi due anni e poi a intervalli di quattro mesi fino a cinque anni dopo l’intervento. La TAC con contrasto è stata eseguita ogni tre mesi per due anni e poi ogni sei mesi. Inoltre, è stata eseguita una PET/CT un anno dopo l’intervento e se si sospettava una recidiva. In questo studio, il tasso di recidiva sintomatica è stato basso, pari al 18%. Il 50% delle recidive era locoregionale e il 39% dei pazienti è stato sottoposto a una seconda resezione curativa. La sopravvivenza mediana dopo la recidiva è stata di 43,6 mesi. Questi ottimi risultati devono essere interpretati con cautela, soprattutto perché si tratta di una popolazione asiatica e di conseguenza sono stati inclusi molti non fumatori che hanno una biologia tumorale diversa (ad esempio, più mutazioni EGFR) e anche un rischio minore di secondi tumori.
Hanna et al. ha studiato il valore della TC a dose minima (MnDCT) in 271 pazienti dopo la resezione di NSCLC [18]. I pazienti sono stati seguiti con MnDCT e radiografia del torace convenzionale ai mesi 3, 6, 12, 18, 24, 36, 48 e 60 dopo l’intervento. I risultati sospetti sono stati ulteriormente chiariti con la TAC convenzionale e le biopsie. La MnDCT era più sensibile (94% vs. 21%, p<0,0001) e aveva un valore predittivo negativo più elevato (99% vs. 96%, p=0,007). Nel complesso, al 23,2% dei pazienti è stata diagnosticata una recidiva, mentre il 78% dei pazienti era asintomatico. La sopravvivenza mediana dei 37 pazienti sottoposti a ulteriore terapia curativa è stata di 69 mesi. Si tratta di risultati eccellenti in un gruppo selezionato di pazienti, senza alcun confronto con un gruppo con un follow-up del tumore meno intensivo.
Prove sull’uso della PET/CT nell’assistenza di follow-up
Il problema principale dell’uso della PET/CT nel follow-up risiede nei cambiamenti infiammatori post-operatori nel torace, che possono portare a risultati falsi-positivi, poiché tali cambiamenti sono spesso accompagnati da un forte accumulo di FDG. Questi cambiamenti infiammatori possono essere ancora presenti sei mesi dopo l’intervento [19]. Il tasso di falsi positivi in questa fase iniziale è superiore al 10% [20]. Questo problema è ancora più marcato dopo la radioterapia locale [21,22]. Un possibile vantaggio della PET/CT è il rilevamento precoce delle metastasi a distanza. Va detto che l’importanza della PET/CT nel rilevamento delle metastasi cerebrali – un sito frequente di recidiva – è limitata. La PET/CT ha anche un potenziale beneficio nella diagnosi precoce di secondi tumori. Tuttavia, in uno studio prospettico non randomizzato, non è stato rilevato alcun vantaggio della PET/CT rispetto agli esami radiologici convenzionali nel follow-up del NSCLC. L’esposizione alle radiazioni durante la PET/CT (circa. 11 mSV) è significativamente più alto di quello di una TAC toracica a “bassa dose” (2 mSV) o di una radiografia toracica convenzionale (0,05 mSV) [20,23]. Inoltre, anche i costi sono significativamente più alti. Inoltre, ci sono i costi per un ulteriore chiarimento dei risultati falsi positivi. Finora, non ci sono studi che dimostrino un beneficio della PET/CT nel follow-up per quanto riguarda la sopravvivenza o la qualità della vita.
Raccomandazioni attuali delle società professionali
La maggior parte delle società professionali raccomanda controlli clinici regolari e immagini radiologiche convenzionali del torace o TAC del torace (Tab. 1). Nella pratica clinica, molti medici non seguono queste raccomandazioni ed eseguono controlli di imaging aggiuntivi con PET/CT o RM [24]. È interessante notare che in un sondaggio della Società di Chirurgia Toracica, solo una piccola percentuale di medici ritiene probabile che il loro comportamento nel follow-up del tumore dia ai pazienti un vantaggio di sopravvivenza [25,26].
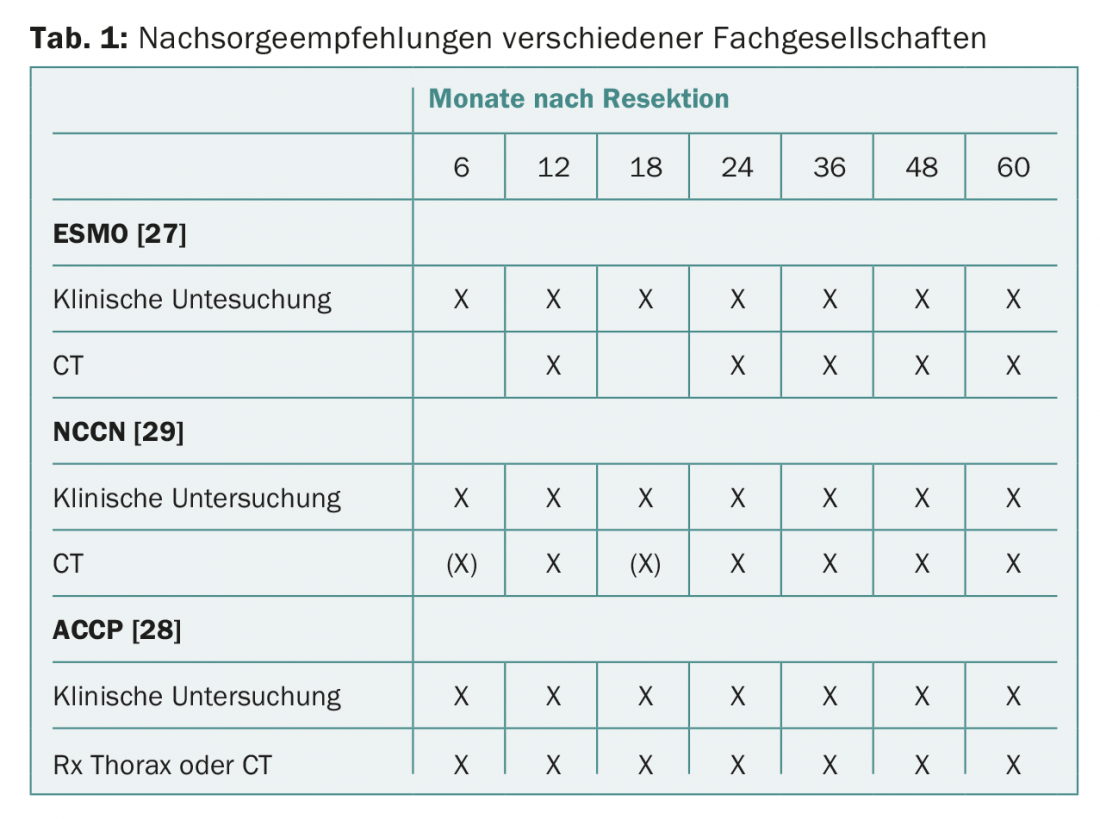
Le linee guida dell’ESMO (Società Europea di Oncologia Medica) raccomandano un controllo clinico ogni tre-sei mesi per i primi due-tre anni e successivamente ogni anno. Per quanto riguarda la diagnostica per immagini, si raccomandano radiografie del torace e tomografia computerizzata annuale del torace [27].
L’American College of Chest Physicians (ACCP) raccomanda che i pazienti sottoposti a resezione curativa di NSCLC siano monitorati con una TAC del torace ogni sei mesi per i primi due anni e successivamente ogni anno. L’esecuzione di esami PET nel follow-up non è raccomandata [28].
Le raccomandazioni del NCCN (National Comprehensive Cancer Network) per il carcinoma bronchiale suggeriscono esami clinici e TAC del torace con o senza contrasto ogni sei-dodici mesi per due anni, poi esami annuali senza contrasto [29]. La PET o la risonanza magnetica cranica non sono raccomandate.
Sommario
Nonostante i potenziali benefici di un follow-up intensivo e basato sulle immagini per l’individuazione precoce di recidive locali che possono essere affrontate nuovamente in modo curativo e per l’individuazione precoce di secondi tumori, ci sono poche prove a sostegno dell’uso di routine di indagini che vadano oltre l’esame fisico periodico e la radiografia toracica convenzionale. Nessuno studio di follow-up ha dimostrato un miglioramento della sopravvivenza o della qualità di vita dei pazienti con NSCLC. La maggior parte di questi studi sono retrospettivi e presentano molte limitazioni. Gli esami radiologici aggiuntivi sono talvolta associati a costi elevati. Diversi studi hanno dimostrato che il follow-up intensivo non è economicamente vantaggioso [11,14]. Inoltre, va detto a questo punto che un maggiore uso di esami radiologici sensibili nel follow-up aumenta il rischio di risultati falsi positivi, che a loro volta rendono necessari ulteriori esami, che rappresentano un onere per i pazienti e generano costi aggiuntivi.
La maggior parte dei pazienti con NSCLC operati con intento curativo sono più anziani e presentano malattie concomitanti. Molti sono fumatori attivi o ex fumatori. Questi punti giustificano un consulto medico regolare. Nonostante la mancanza di prove, la maggior parte delle società professionali raccomanda l’uso della TAC del torace ogni tre-sei mesi, oltre all’esame clinico. C’è un’elevata necessità di studi prospettici per valutare il valore degli esami radiologici nell’assistenza di follow-up. Al di fuori dei protocolli di studio, raccomandiamo che il follow-up sia essenzialmente limitato ai controlli clinici e alla radiografia toracica convenzionale. È importante discutere con i pazienti l’importanza e l’attuazione del follow-up. Un aspetto importante dell’assistenza di follow-up è anche quello di motivare i pazienti a smettere di fumare. I pazienti che continuano a fumare hanno un rischio maggiore di ricaduta, un rischio più elevato di un secondo tumore, un aumento della mortalità per cause non tumorali e una minore sopravvivenza complessiva [30–32].
Messaggi da portare a casa
- Solo circa la metà dei pazienti con carcinoma polmonare non a piccole cellule (NSCLC) di nuova diagnosi può essere sottoposta a terapia curativa.
- La probabilità di recidiva dopo la terapia curativa nel NSCLC è del 30-75% a seconda dello stadio ed è maggiore nei primi tre anni.
- Non ci sono prove valide per un follow-up intensivo dopo il trattamento curativo del NSCLC, soprattutto non per un follow-up radiologico ravvicinato. La maggior parte dei pazienti non può più essere trattata in modo curativo in caso di recidiva.
- Il follow-up deve includere essenzialmente il controllo clinico, le radiografie convenzionali del torace e, se necessario, la TAC.
Letteratura:
- Martini N, et al: Incidenza di recidiva locale e di secondi tumori primari nel carcinoma polmonare di stadio I resecato. J Thorac Cardiovasc Surg 1995; 109: 120-129.
- al-Kattan K, et al: Recidiva della malattia dopo la resezione per il cancro al polmone di stadio I. Eur J Cardiothorac Surg 1997; 12(3): 380-384.
- Martin J, et al: Risultati a lungo termine della terapia combinata nel carcinoma polmonare non a piccole cellule resecabile. J Clin Oncol 2002; 20: 1989-1995.
- Nessun autore elencato: Modelli di fallimento nei pazienti con carcinoma non a piccole cellule del polmone resecato in stadio I e II. Il Gruppo di Studio sul Cancro Polmonare Ludwig. Ann Surg 1987; 205: 67-71.
- Sugimura H, et al: Sopravvivenza dopo una recidiva di carcinoma polmonare non a piccole cellule dopo resezione polmonare completa. Ann Thorac Surg 2007; 83: 409-417.
- Thomas P, Rubinstein L: Recidiva del cancro dopo la resezione: carcinoma polmonare non a piccole cellule T1 N0. Gruppo di studio sul cancro al polmone. Ann Thorac Surg 1990; 49(2): 242-247.
- Johnson BE: Secondo tumore al polmone nei pazienti dopo il trattamento di un tumore al polmone iniziale. J Natl Cancer Inst 1998; 90: 1335-1345.
- Deschamps C, et al: Tumori polmonari primari multipli. Risultati del trattamento chirurgico. J Thorac Cardiovasc Surg 1990; 99: 769-777.
- Martini N, Melamed MR: Tumori polmonari multipli primari. J Thorac Cardiovasc Surg 1975; 70: 606-612.
- Moore S, et al: Follow up guidato dall’infermiere e follow up medico convenzionale nella gestione dei pazienti con cancro al polmone: studio randomizzato. BMJ 2002; 325: 1145.
- Virgo KS, et al: Opzioni di gestione post-trattamento per i pazienti con cancro al polmone. Ann Surg 1995; 222: 700-710.
- Nakamura R, et al: Follow-up post-operatorio per i pazienti con carcinoma polmonare non a piccole cellule. Oncologia 2010; 33: 14-18.
- Younes RN, Gross JL: Follow-up nel cancro al polmone: quanto spesso e a quale scopo? Chest 1999; 115: 1494-1499.
- Egermann U, et al: Un follow-up regolare dopo la resezione curativa del carcinoma polmonare non a piccole cellule: un reale beneficio per i pazienti? Eur Respir J 2002; 19: 464-468.
- Walsh GL, et al: Il follow-up dei pazienti con carcinoma polmonare dopo la resezione è indicato dal punto di vista medico ed efficace dal punto di vista dei costi? Ann Thorac Surg 1995; 60: 1563-1570.
- Westeel V, et al: Importanza di un follow-up intensivo post-operatorio dopo l’intervento chirurgico per il carcinoma polmonare non a piccole cellule. Ann Thorac Surg 2000; 70: 1185-1190.
- Song IH, et al: Fattori prognostici per la sopravvivenza post-recidiva nei pazienti con carcinoma polmonare non a piccole cellule in stadio I completamente resecato. Eur J Cardiothorac Surg 2014; 45: 262-267.
- Hanna WC, et al: La tomografia computerizzata a dose minima è superiore alla radiografia del torace per il follow-up e il trattamento dei pazienti con cancro al polmone resecato. J Thorac Cardiovasc Surg 2014; 147: 30-33.
- Kanzaki R, et al: Valore clinico della tomografia ad emissione di positroni-computerizzata con F18-fluorodesossiglucosio nei pazienti con carcinoma polmonare non a piccole cellule dopo un intervento chirurgico potenzialmente curativo: esperienza con 241 pazienti. Interact Cardiovasc Thorac Surg 2010; 10: 1009-1014.
- Choi SH, et al: Tomografia a emissione di positroni – tomografia computerizzata per la sorveglianza post-operatoria nel carcinoma polmonare non a piccole cellule. Ann Thorac Surg 2011; 92: 1826-1832; discussione 1832.
- Dahele M, et al: Cambiamenti radiologici dopo la radioterapia stereotassica per il cancro al polmone di stadio I. J Thorac Oncol 2011; 6: 1221-1228.
- Huang K, et al.: Cambiamenti radiografici dopo la radioterapia stereotassica ablativa del polmone (SABR) – Possiamo distinguere la recidiva dalla fibrosi? Una revisione sistematica della letteratura. Radiother Oncol 2012; 102: 335-342.
- Brix G, et al: Esposizione alle radiazioni dei pazienti sottoposti a esami 18F-FDG PET/CT a doppia modalità su tutto il corpo. J Nucl Med 2005; 46: 608-613.
- Edelman MJ, Schuetz J: Follow-up del carcinoma polmonare non a piccole cellule locale (stadio I e stadio II) dopo la resezione chirurgica. Curr Treat Options Oncol 2002; 3: 67-73.
- Naunheim KS, et al: Test di sorveglianza clinica dopo le operazioni per il cancro al polmone. Ann Thorac Surg 1995; 60: 1612-1616.
- Virgo KS, et al: Follow-up dei pazienti con tumore al polmone: motivazione dei chirurghi toracici. Chest 1998; 114: 1519-1534.
- Vansteenkiste J, et al.: 2a Conferenza di consenso ESMO sul cancro al polmone: consenso sul cancro al polmone non a piccole cellule in stadio precoce su diagnosi, trattamento e follow-up. Ann Oncol 2014 Aug; 25(8): 1462-1474.
- Colt HG, et al: Follow-up e sorveglianza del paziente con tumore al polmone dopo la terapia con intento curativo: Diagnosi e gestione del tumore al polmone, 3a ed.: Linee guida di pratica clinica basate sull’evidenza dell’American College of Chest Physicians. Chest 2013; 143: e437S-54S.
- National Comprehensive Cancer Network: Linee guida di pratica clinica in oncologia NCCN (NCCN Guidelines®); Cancro del polmone non a piccole cellule. Cancro al polmone non a piccole cellule (versione 5; 2017).
- Warren GW, et al: Fumo alla diagnosi e sopravvivenza nei pazienti oncologici. Int J Cancer 2013; 132: 401-410.
- Park SM, et al: Fumo, obesità, resistenza all’insulina e rischio di un secondo tumore primario nei maschi sopravvissuti al cancro: National Health Insurance Corporation Study. J Clin Oncol 2007; 25: 4835-4843.
- Gajdos C, et al: Effetti negativi del fumo sugli esiti post-operatori nei pazienti oncologici. Ann Surg Oncol 2012; 19: 1430-1438.
InFo ONCOLOGIA & EMATOLOGIA 2017; 5(3): 18-21