Le reazioni avverse ai farmaci si dividono in reazioni di tipo A e di tipo B. Le reazioni di tipo A si basano sul meccanismo d’azione del farmaco. Le reazioni di tipo B (allergie ai farmaci) sono meno comuni ma potenzialmente pericolose e sono causate da una reazione immunitaria al farmaco.
Le allergie ai farmaci (MA) di solito si manifestano in modo imprevedibile. Le manifestazioni sono clinicamente molto variabili e potenzialmente pericolose. I meccanismi sottostanti sono eterogenei e trovare le cause è difficile. Dati recenti hanno dimostrato che la stimolazione immunitaria nel MA è innescata da tre meccanismi distinti che differiscono per velocità di manifestazione, dipendenza dalla dose, opzioni di chiarimento e genetica [3]. L’attribuzione di una reazione è complicata dal fatto che molti pazienti ricevono più farmaci contemporaneamente. Se si sospetta la MA, è necessario un attento chiarimento. Se si tratta di un MA, il paziente colpito deve essere adeguatamente informato sulla sua condizione. Si raccomanda un passaporto delle allergie della SGAI (Società Svizzera di Allergologia e Immunologia), che contiene informazioni sulla gravità dell’allergia, sui farmaci alternativi tollerati e informazioni di base sulla diagnosi di allergia. Il passaporto delle allergie è disponibile presso il Centro Allergie Svizzera (www.aha.ch).
“Reazione avversa ai farmaci”
Le reazioni avverse ai farmaci (ADR) si dividono in reazioni di tipo A e di tipo B [1,2]. Le reazioni di tipo A sono comuni (85%) e sono dovute a reazioni farmacologiche (ad esempio, affaticamento dopo l’assunzione di bloccanti anti-H1 ad alto dosaggio, gastrite erosiva dopo l’assunzione di FANS, ecc). Le reazioni di tipo B (circa il 15%) sono quelle reazioni di ipersensibilità i cui sintomi non corrispondono al meccanismo d’azione del farmaco, ma sono causati da reazioni immunitarie: un esantema dopo l’amoxicillina non ha nulla a che fare con il meccanismo d’azione dell’antibiotico, ma è causato da una reazione immunitaria all’amoxicillina.
Reazioni di ipersensibilità: Reazione di tipo B
Formazione di un nuovo antigene/allergene (modello hapten): Un farmaco chimicamente reattivo (ad esempio la penicillina) si lega a una proteina mediante un legame covalente (meccanismo aptenico): il complesso aptenico-proteico viene riconosciuto come un nuovo antigene dal sistema immunitario, contro il quale si sviluppa una complessa reazione immunitaria basata su diverse simulazioni di cellule B o T. Clinicamente, a seconda del tipo di stimolazione immunitaria, si manifestano sintomi diversi, come l’anafilassi a rapida insorgenza (IgE-mediata), l’eczema e l’esantema (entrambi mediati dalle cellule T) che si manifestano solo dopo giorni, o l’emolisi (IgG/IgM). Questa reazione immunoallergica segue i principi della stimolazione immunitaria alle proteine e può essere rilevata con test cutanei e test in vitro. Il numero di farmaci che stimolano chiaramente attraverso il meccanismo degli apteni è gestibile. Alcuni farmaci diventano reattivi solo dopo la metabolizzazione (ad esempio, le sulfanilammidi) (Tab. 1).

p-i (interazione farmacologica con i recettori immunitari): Questo concetto, sviluppato dal gruppo di ricerca sulle allergie ai farmaci dell’Inselspital, combina la farmacologia con l’immunologia [4]. I farmaci tendono ad attaccarsi alle proteine tramite legami idrogeno, interazioni elettrostatiche e forze di van der Waals, come nel caso delle normali interazioni ligando-recettore. In parte, queste interazioni non covalenti portano al blocco o alla stimolazione dei recettori importanti per l’attivazione delle cellule T. Nel meccanismo p-i, queste interazioni “farmacologiche” coinvolgono i recettori immunitari HLA e TCR. A differenza del modello hapten, nella p-i si verifica solo una stimolazione selettiva delle cellule T. Esiste un certo numero di farmaci che stimolano principalmente attraverso il meccanismo p-i e queste reazioni sono spesso clinicamente problematiche (epatite, DRESS, SJS/TEN) (Tabella 1).
Nel caso dei farmaci abacavir, carbamazepina o allopurinolo, l’affinità relativa si lega principalmente o esclusivamente a determinati alleli HLA: ad esempio, il metabolita principale dell’allopurinolo (ossipurinolo) può legarsi fortemente all’allele HLA-B*58:01, l’abacavir al B*57:01 e la carbamazepina al B*15:01 o all’A*31:01. Le persone che hanno questi alleli HLA sono particolarmente suscettibili di NW grave, come SJS o DRESS: la tipizzazione HLA può essere utilizzata per rilevare il rischio di NW grave, cosa che viene spesso fatta per l’abacavir e la carbamazepina nelle persone provenienti dal Sud-Est asiatico, in quanto HLA-B*15:02 è relativamente comune in questa regione. In alternativa, il farmaco può legarsi direttamente al TCR, che riconosce i peptidi nell’HLA: questo è il caso, ad esempio, delle allergie al sulfametossazolo, dove sono stati identificati diversi siti di legame sul TCR [4]. La diagnosi si basa sul rilevamento delle reazioni delle cellule T nella pelle o sul test in vitro (cyto-LTT).
Effetti collaterali pseudoallergici: Questi sono dovuti alla stimolazione diretta delle cellule effettrici del sistema immunitario. La più studiata è la stimolazione dei mastociti attraverso il recettore MRGPRX2, legando i chinoloni o i miorilassanti [5]. Spiega la comparsa di orticaria e anafilassi con questi farmaci. Le più importanti sono le reazioni pseudoallergiche ai FANS, parte delle quali possono essere attribuite all’aumento della produzione di leucotrieni [6]. C’è un’attivazione degli eosinofili e dei basofili, nonché una stimolazione dei mastociti. I sintomi includono rinosinusite e broncospasmo nel senso di asma sensibile all’aspirina, e/o orticaria e anafilassi. La NW pseudoallergica è comune. Poiché non vi è alcun coinvolgimento del sistema immunitario specifico (cellule B e T), i test immunitari (test cutanei, BAT, cito-LTT) sono negativi (tab. 1) . La diagnosi si basa su test di provocazione, oltre che sull’anamnesi e sull’osservazione del decorso per quanto riguarda la questione di quali farmaci sono tollerati o scatenano i sintomi.
Reazioni di tipo immediato o di tipo tardivo?
Le seguenti domande sono importanti per il medico: Potrebbe trattarsi di un’allergia al farmaco? Distinzione tra reazioni di tipo immediato e tardivo? Segnali di pericolo? Quale farmaco è il fattore scatenante? La MA è spesso considerata tardiva nella diagnosi differenziale, poiché le manifestazioni cliniche della MA imitano varie altre malattie immunitarie o autoimmuni virali o batteriche. Nel caso di malattie che non possono essere spiegate, la MA deve sempre essere inclusa nella diagnosi differenziale. Le indicazioni del MA come causa dei sintomi sono: Collegamento con un farmaco prescritto di recente (da <1-45 giorni) o sintomi tipici di un’eruzione cutanea pruriginosa (esantema), orticaria, anafilassi o eosinofilia.
È importante distinguere le reazioni di tipo immediato da quelle di tipo tardivo. Le reazioni che si verificano entro un’ora dalla somministrazione del farmaco (a volte peracute, entro pochi minuti) sono IgE-mediate o pseudoallergiche. Si manifestano come flash, prurito (tipicamente palmare, plantare, cuoio capelluto, ascellare, genitale), orticaria e, se sono colpiti anche gli organi interni, anche come anafilassi (broncospasmo, vomito, diarrea, ipotensione, shock cardiogeno). La maggior parte delle reazioni non si manifesta prima di sei ore (di solito non prima di quattro giorni). Con l’amoxicillina, il fattore scatenante più frequente della MA in Svizzera (2-8% dei trattati), l’esantema spesso compare solo dopo un periodo di trattamento di 7-12 giorni, a volte solo dopo la sospensione del farmaco. L’esantema è clinicamente relativamente eterogeneo e per lo più causato da cellule T stimolate da farmaci.
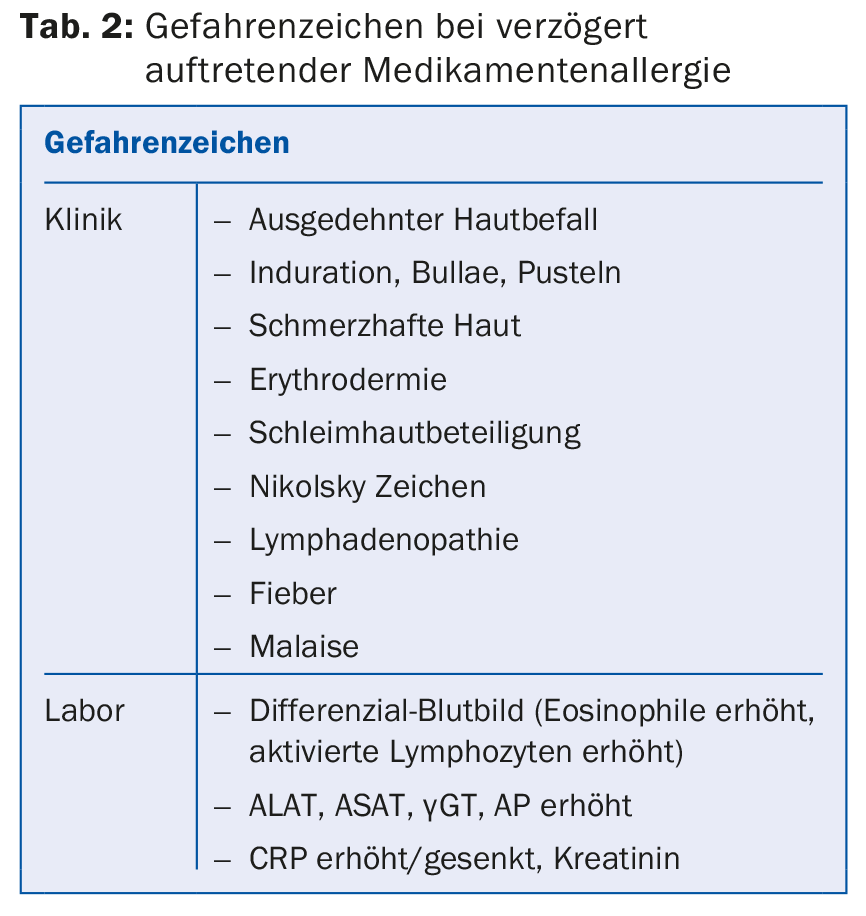
Le reazioni di tipo tardivo sono dominate da esantema maculare, orticarioide e maculopapulare. L’epatite da lieve a moderata non è rara, mentre pleurite, pancreatite, ecc. sono rare. Le reazioni cutanee bollose e le reazioni delle membrane mucose (congiuntivite, ulcere/afte orali o genitali), che caratterizzano la SJS/TEN e hanno una letalità del 10-30%, devono sempre essere classificate come pericolose. Tipici e quindi indicativi sono gli aumenti massicci dell’eosinofilia (spesso >1 G/l) e linfoblasti (come nell’infezione da virus di Epstein-Barr), che spesso vengono ignorati: In caso di sospetto di MA, esegua sempre un emocromo differenziale o cerchi i linfoblasti e, in caso di esantema generalizzato, determini sempre anche i valori epatici (SGOT/SGPT, LDH, AP, γGT) per individuare il coinvolgimento del fegato; informi sui segnali di pericolo. Tabella 2. Raramente, può verificarsi un’ematologia non positiva (trombocitopenia, anemia emolitica, agranulocitosi). Questi sono in gran parte mediati dalle IgG.
Quale farmaco è il fattore scatenante?
L’identificazione dei fattori scatenanti dell’MA è molto complessa. La documentazione il più precisa possibile del farmaco per quanto riguarda la durata, la dose e il momento in cui si sono manifestati i primi sintomi di MA sono fondamentali per il chiarimento; in particolare, se e quale tipo di MA è noto con il farmaco corrispondente. A volte questo è sufficiente per riuscire a delimitare e classificare. Poiché molti pazienti ricevono una terapia combinata, l’anamnesi è spesso difficile e inconcludente. La diagnosi di allergia a un farmaco deve essere fatta con una probabilità di errore più bassa possibile, poiché le conseguenze associate possono includere la rinuncia a un gruppo importante di farmaci e un aumento dei costi o un peggioramento della terapia.
Test cutanei e in vitro: nel chiarimento in vivo, devono essere prese in considerazione le concentrazioni, la solubilità, la disponibilità di farmaci sterili, nonché l’assunzione contemporanea di farmaci durante il test e molto altro ancora, in modo che il chiarimento avvenga con l’allergologo. Si devono considerare anche i possibili meccanismi immunitari, cioè se la reazione potrebbe essere legata alle IgE o alle cellule T. Se si sospetta un meccanismo IgE-mediato, si possono eseguire test cutanei con sostanze solubili e test intradermici con farmaci solubili sterili. Per alcuni farmaci, esiste un test di laboratorio per il rilevamento delle IgE farmaco-specifiche mediante sierologia (metodo ImmunoCap). Le reazioni delle cellule T contro il farmaco possono essere rilevate mediante test cutanei (test intradermico e test epicutaneo). Le possibilità di chiarimento in vitro sono state migliorate di recente: Se si sospetta una reazione IgE-mediata, si utilizza il BAT. Per le reazioni tardive, la cito-LTT in vitro è più adatta a rilevare la sensibilizzazione.
Reazioni di tipo immediato: test di attivazione dei basofili: Il BAT è adatto per il chiarimento diagnostico di una reazione di tipo immediato (di solito pochi minuti/ore dopo l’assunzione di farmaci). Nel BAT, la reazione che si verifica nel corpo viene “ricreata” in laboratorio. Il sangue viene incubato con il presunto farmaco scatenante in sostanza pura e in concentrazione crescente, per cui i basofili presenti nel sangue vengono attivati in caso di sensibilizzazione. Oltre al rilascio di mediatori (istamina, eparina), sulla superficie dei basofili vengono espressi anche diversi marcatori di attivazione, che possono essere quantificati con la citometria a flusso. Poiché il test richiede cellule vive, è essenziale un tempo di trasporto rapido del campione (<24h). Il test deve anche essere registrato presso il laboratorio. Il materiale necessario per il test è almeno 4 ml di sangue EDTA.
I seguenti gruppi di farmaci si sono dimostrati adatti alla chiarificazione di una MA di tipo immediato con il BAT (esperienza di ADR-AC): penicilline, cefalosporine, miorilassanti, PPI, fluorochinoloni e vari disinfettanti. Se vengono testati altri farmaci, il test deve essere ancora considerato sperimentale. Come per il test cutaneo, la sensibilità del BAT diminuisce con la distanza dall’evento. In modo ottimale, il BAT viene effettuato entro un anno dalla reazione allergica.
Reazioni di tipo tardivo: Test di trasformazione dei linfociti in citochine (cyto-LTT): per il chiarimento diagnostico delle reazioni allergiche di tipo tardivo mediante la diagnostica di laboratorio in vitro, il cyto-LTT si è dimostrato utile e – sulla base di dati precedenti – superiore al test cutaneo e al normale LTT: In una coltura cellulare di 7 giorni delle cellule del paziente con il farmaco, vengono stimolate cellule T specifiche che secernono citochine: L’analisi di alcuni mediatori nei surnatanti delle colture cellulari, ossia IL-5, IL-13, IFN-y, granzima B e granulysina, è adatta a rilevare i diversi tipi di reazioni. In base al modello di distribuzione delle citochine, si possono anche trarre conclusioni sul modello della malattia. Per esempio, i pazienti con esantema maculopapulare tendono a mostrare un aumento dei livelli di IL-5 e IL-13, mentre i meccanismi di risposta citotossica come AGEP o DRESS mostrano un aumento delle citochine citotossiche. Il cyto-LTT richiede 4050 ml di sangue eparinato, con un tempo di raccolta ottimale che va da due settimane a 1-2 anni dopo la risoluzione della risposta, tranne che nella SJS/TEN, dove il test deve essere eseguito il prima possibile. Nel cyto-LTT è possibile testare un ampio spettro di sostanze attive. Questo include i principali fattori scatenanti tipici delle reazioni di tipo tardivo mediate da farmaci (dettagli su www.adr-ac.ch).
Decorso dei sintomi e misure
Come prima misura, il farmaco somministrato di recente deve essere interrotto. Questo perché è improbabile che un farmaco già assunto da molto tempo (ad esempio un anno) possa scatenare un’allergia. A seconda della gravità dei sintomi (tab. 2), sono necessarie ulteriori misure. La DRESS è una reazione sistemica clinicamente grave (esantema massiccio, malessere, gonfiore del viso, epatite e spesso eosinofilia) ed è scatenata principalmente da alcuni farmaci specifici (tab. 3). La DRESS spesso si verifica solo dopo diverse settimane di terapia e può causare un’insufficienza d’organo letale (cardite, epatite). I pazienti con esantema grave e DRESS possono comunque sviluppare per anni una nuova MA contro nuovi farmaci (“ipersensibilità multipla ai farmaci”, MDH) [7]. Nel MA lieve, è sufficiente una terapia a breve termine con bloccanti anti-H1, integrata da steroidi topici. Gli steroidi sistemici sono utilizzati per l’MA grave. L’ospedalizzazione e il coinvolgimento di specialisti sono necessari e utili nelle malattie cutanee bollose (SJS/TEN), nella DRESS e soprattutto nell’AGEP, poiché i decorsi sono spesso sorprendenti e l’esperienza con queste MA gravi è importante. Il follow-up dei pazienti con DRESS è complicato, poiché molti pazienti presentano reazioni di “flare up” nonostante la cessazione dei fattori scatenanti e alcuni pazienti sviluppano la MDH.

La durata della sensibilizzazione dopo la MA non è stata sufficientemente studiata. Sono stati osservati casi che reagivano ancora in modo fortemente positivo al farmaco nel test cutaneo o nella LTT dopo più di 12-20 anni, per cui si deve ipotizzare una MA permanente: Questo è particolarmente vero per le MA gravi come la DRESS, la SJS/TEN e l’epatite. Nell’anafilassi, il rilevamento dell’allergia è più elevato nel primo anno dopo l’evento che in seguito, in quanto è stata ripetutamente osservata una diminuzione spontanea delle IgE farmaco-specifiche. Tuttavia, questa diminuzione non è certa, per cui – se lo stesso farmaco deve essere utilizzato di nuovo – viene prima somministrata una dose di prova: Il farmaco viene somministrato a 1/100 – 1/10 della dose giornaliera e poi viene aumentato rapidamente alla dose normale entro 3-6 ore (“sfida graduata”). La riesposizione (test di “sfida”/provocazione) con la dose completa è controindicata nelle reazioni gravi. Nel caso delle frequenti reazioni tardive, originariamente lievi (esantema), sarebbe possibile una riesposizione dopo >2 anni, se si tratta di una classe di farmaci importante.
Messaggi da portare a casa
- Le reazioni avverse ai farmaci si dividono in reazioni di tipo A e di tipo B [1,2]. Le reazioni di tipo A si basano sul meccanismo d’azione del farmaco. Le reazioni di tipo B (allergie ai farmaci) sono meno comuni ma potenzialmente pericolose e sono causate da una reazione immunitaria al farmaco.
- Le allergie ai farmaci possono essere classificate in forme immunoallergiche, p-i e pseudoallergiche, in base al meccanismo d’azione del farmaco con le cellule immunitarie e infiammatorie. Le caratteristiche distintive riguardano la velocità di manifestazione, la dipendenza dalla dose, le opzioni di chiarimento e la genetica.
- Inoltre, bisogna distinguere le reazioni di tipo immediato da quelle di tipo tardivo. Oltre all’anamnesi e all’osservazione del decorso della malattia, l’emocromo differenziale può fornire indizi diagnostici. Identificare i farmaci che scatenano la malattia è complicato. I nuovi test in vitro facilitano l’individuazione del fattore scatenante sia per le reazioni immediate (test di attivazione dei basofili, BAT) che per le reazioni tardive (cyto-LTT).
Letteratura:
- Rawlins MD, Thompson JW: Patogenesi delle reazioni avverse ai farmaci. In: Davies DM, ed. Libro di testo sulle reazioni avverse ai farmaci. Oxford: Oxford University Press, 1977: 10-17.
- Rawlins MD: Farmacologia clinica: reazioni avverse ai farmaci. BMJ 1981; 282: 974-976.
- Pichler WJ, Hausmann O: Classificazione dell’ipersensibilità ai farmaci in forme allergiche, p-i e pseudo-allergiche. Int Arch Allergy Immunol 2016; 171 (3-4): 166-179.
- Pichler WJ, et al.: Ipersensibilità ai farmaci: come i farmaci stimolano le cellule T attraverso l’interazione farmacologica con i recettori immunitari. Intern Arch Allerg Clin Immunol 2015; 168(1): 13-24.
- McNeil BD, et al: Identificazione di un recettore specifico per i mastociti, fondamentale per le reazioni pseudoallergiche ai farmaci. Natura 2015; 519 (7542): 237-241. doi: 10.1038/nature14022.
- Kowalski ML, et al: Classificazione e approccio pratico alla diagnosi e alla gestione dell’ipersensibilità ai farmaci antinfiammatori non steroidei. Allergia 2013; 68(10): 1219-1232.
- Pichler WJ, Srinoulprasert Y, Yun J, Hausmann O: Ipersensibilità multipla ai farmaci. Int Arch Allergy Immunol 2017; 172(3): 129-138.
PRATICA GP 2018; 13(10): 12-16