Per la maggior parte dei pazienti affetti da melanoma, oggi sono disponibili terapie molto più efficaci rispetto a qualche anno fa. Questo vale anche per il trattamento adiuvante del melanoma. Sono stati stabiliti molti nuovi approcci terapeutici, che vengono successivamente studiati in studi più o meno grandi. Questo include l’analisi intermedia presentata alla Riunione Annuale ADF di quest’anno.
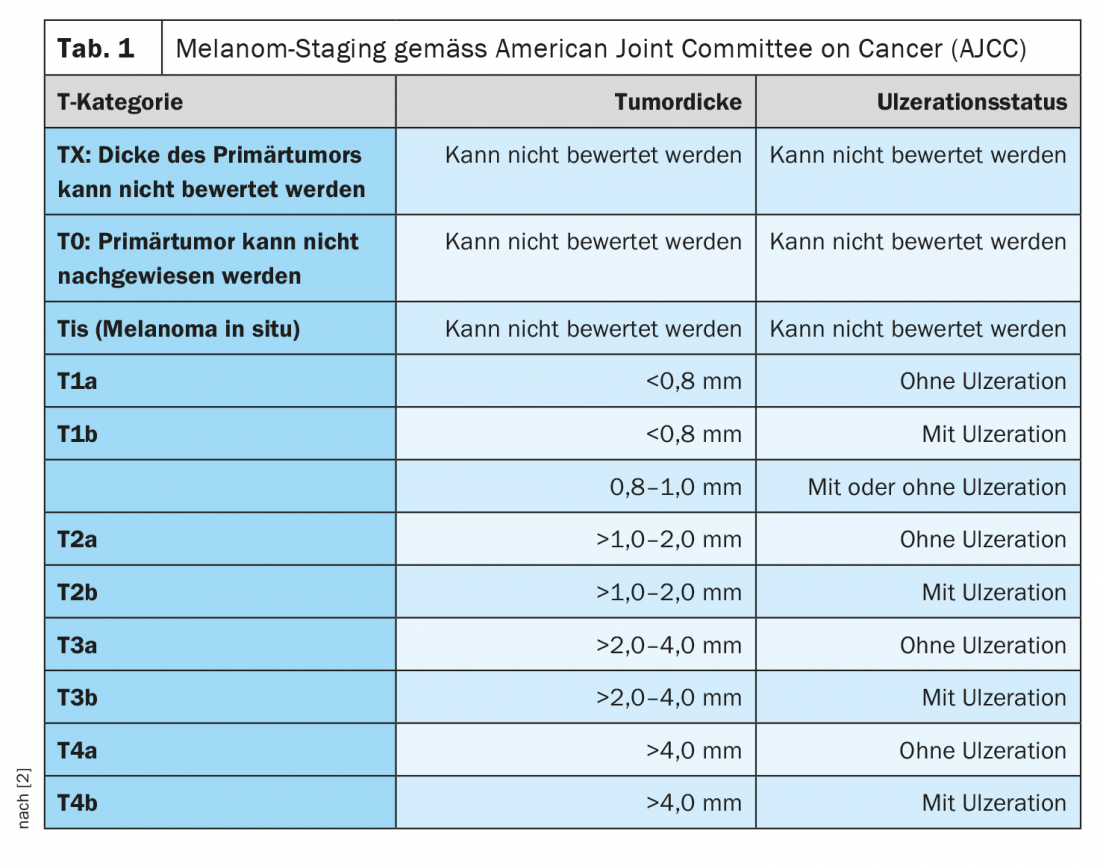
Ogni anno, si stima che circa 200.000 persone in tutto il mondo sviluppino un melanoma maligno [1]. L’incidenza è aumentata costantemente negli ultimi decenni. L’età media di insorgenza è di circa 60 anni per le donne e 64 anni per gli uomini. La classificazione e la stadiazione del melanoma maligno si basano attualmente sull’ottava edizione della classificazione AJCC (Tab. 1) [2]. Oltre allo spessore del tumore secondo Breslow, la presenza di ulcerazioni e il coinvolgimento linfonodale sono considerati criteri prognostici importanti al momento della diagnosi iniziale [1]. Fino a pochi anni fa, lo standard di cura per il melanoma avanzato e metastatico era palliativo, con una sopravvivenza mediana di 6-12 mesi. La chemioterapia era il trattamento standard. Il lancio di opzioni terapeutiche altamente efficaci nel campo degli inibitori del checkpoint e degli inibitori mirati della chinasi, come gli inibitori di BRAF e MEK, ha migliorato significativamente l’aspettativa di vita dei pazienti con melanoma completamente resecato.
Gli inibitori del checkpoint sono stati i pionieri – e oggi?
Dal lancio di ipilimumab nel 2011, sono stati compiuti ulteriori progressi nel campo dell’immunoterapia per i pazienti affetti da melanoma. Per quanto riguarda il trattamento adiuvante, questo è documentato, tra gli altri, dallo studio KEYNOTE-054 [3], in cui nivolumab ha mostrato un vantaggio significativo per la sopravvivenza libera da recidiva rispetto a ipilimumab. E nello studio Checkmate-238, il pembrolizumab si è dimostrato superiore al placebo in termini di sopravvivenza libera da recidiva [4]. La riduzione del rischio è stata del 35% per nivolumab rispetto a ipilimumab e del 43% per pembrolizumab rispetto al placebo, rispettivamente. Lo studio randomizzato di nivolumab rispetto a ipilimumab ha mostrato anche un miglioramento significativo della sopravvivenza libera da metastasi a distanza (HR 0,73, 95% CI: 0,55-0,95]. Per quanto riguarda il profilo rischio-beneficio, la valutazione dell’attuale linea guida AWMF è che, nonostante il rischio latente di effetti collaterali potenzialmente gravi, il beneficio di una riduzione del rischio depone a favore dell’uso di questa opzione terapeutica. [5].
Gli inibitori di BRAF e MEK ampliano lo spettro di sostanze altamente efficaci
Per la terapia adiuvante con inibitori di BRAF e MEK , l’attuale linea guida S3 menziona, tra l’altro, uno studio di fase III randomizzato, controllato e in doppio cieco di dabrafenib/trametinib. chiamato. Pazienti in stadi da IIIA (diametro minimo del linfonodo interessato >1 mm) a IIIC con un BRAFV600E o mutazione V600K hanno ricevuto dabrafenib 150 mg 2× al giorno e trametinib 2 mg 1× al giorno, o un trattamento placebo comparabile, per un totale di 12 mesi [6]. Dopo un follow-up mediano di 2,8 anni, la probabilità a 3 anni di sopravvivenza libera da recidiva era del 58% per il braccio di trattamento e del 39% per il braccio placebo (HR per recidiva o morte 0,47; 95% CI: 0,39-0,58; p<0,001). Secondo la valutazione dell’attuale linea guida S3, l’uso di queste opzioni terapeutiche deve essere raccomandato nonostante un tasso di interruzione relativamente alto legato agli effetti collaterali, in considerazione del beneficio dimostrato: riduzione del rischio del 53% per la sopravvivenza libera da recidiva e del 43% per la morte legata al melanoma.
Risultati provvisori di un set di dati interregionale della regione DACH
Al Meeting annuale ADF di quest’anno, sono stati presentati i dati di un’analisi ad interim di uno studio retrospettivo in cui i pazienti affetti da melanoma di Germania, Austria e Svizzera (DACH) hanno ricevuto pembrolizumab e nivolumab (anti PD-1) o dabrafenib/trametinib (inibizione di BRAF/MEK) come terapia adiuvante tra il 1/2017 e il 2/2020 [7]. Nel settembre 2020, sono stati analizzati i dati di 524 pazienti su un totale di 1039 partecipanti allo studio. Le due opzioni di trattamento adiuvante sono state confrontate in termini di PFS a 12 mesi e di altri parametri di esito rilevanti.
Le caratteristiche dei pazienti delle sottopopolazioni trattate con l’inibizione di BRAF/MEK rispetto alla terapia anti PD1 erano comparabili in termini di variabili demografiche e caratteristiche tumorali. La maggior parte dei pazienti ha ricevuto una terapia adiuvante con PD1 (n=439; 83,8%; Nivo=69,2%; Pembro=30,8%). Il periodo medio di follow-up è stato di 13,1 mesi. L’intervallo di tempo dalla resezione completa all’inizio del trattamento adiuvante è stato di 2,5 mesi (SD=1,55) per l’inibizione di BRAF/MEK e di 2,7 mesi (SD=2,62) per la terapia anti-PD1. La durata media della terapia è stata di 7,4 mesi (SD=4,4) per entrambi i regimi di trattamento. Le analisi statistiche hanno mostrato una PFS a 12 mesi dell’81,2% per il sottogruppo anti-PD1 e del 90,4% per quelli trattati con l’inibizione di BRAF/MEK (OR 2,001; 95% CI: 1,045-3,830; p=0,036). Non c’è stata alcuna differenza nella PFS tra i pazienti che hanno ricevuto nivolumab e pembrolizumab.
Sia nel gruppo di inibizione BRAF/MEK che nel gruppo di trattamento anti-PD1, l’ulcerazione, il maggiore spessore del tumore e il maggiore coinvolgimento dei linfonodi metastatici sono stati predittori negativi della PFS. I predittori positivi per una PFS più favorevole sono stati un BMI più alto (25-30) e il sesso maschile nei pazienti che hanno ricevuto una terapia con inibitori BRAF/MEK. La PFS non differiva a seconda della dissezione linfonodale completa rispetto alla biopsia del linfonodo sentinella.

Il profilo di sicurezza di tutti i principi attivi studiati si è rivelato paragonabile agli studi precedenti. Il tasso di eventi avversi associati al farmaco (drAE) e di AE immuno-correlati è stato simile con nivolumab rispetto a pembrolizumab (64,2-63,7% e 33,3-33,8%, rispettivamente). Tra i pazienti trattati con inibizione di BRAF/MEK, la percentuale di drAE era dell’87% in questo studio. Gli autori non forniscono ulteriori informazioni sul tipo di effetti collaterali. Sono previste ulteriori analisi per saperne di più sulle caratteristiche dei pazienti e sulle caratteristiche del tumore che correlano con una risposta favorevole all’inibizione anti-PD1 vs BRAF/MEK come regimi di terapia adiuvante.
Congresso: Gruppo di lavoro sulla ricerca dermatologica 2021
Letteratura:
- Lamos C, Hunger RE: Inibitori del checkpoint – indicazione e uso nei pazienti con melanoma [Checkpoint inhibitors-indications and application in melanoma patients]. Z Rheumatol 2020;79(8): 818-825.
- Gershenwald JE, et al; per i membri dell’American Joint Committee on Cancer Melanoma Expert Panel e dell’International Melanoma Database and Discovery Platform. Stadiazione del melanoma: modifiche basate sull’evidenza nel manuale di stadiazione del cancro dell’ottava edizione dell’American Joint Committee on Cancer. CA Cancer J Clin 2017; 67(6): 472-492.
- Weber J, et al: nivolumab adiuvante rispetto a ipilimumab nel melanoma resecato in stadio III o IV. N Engl J Med 2017; 377(19): 1824-1835.
- Eggermont AMM, et al: Pembrolizumab adiuvante rispetto al placebo nel melanoma resecato in stadio III. N Engl J Med 2018; 378(19): 1789-1801.
- AWMF: Linea guida S3 sulla diagnosi, il trattamento e il follow-up del melanoma Versione 3.3 – Luglio 2020 Numero di registro AWMF: 032/024OL
- Long GV, et al: Dabrafenib adiuvante più trametinib nel melanoma BRAF-mutato in stadio III. N Engl J Med 2017; 377(19): 1813-1823.
- Schumann K, et al.: P048 Trattamento adiuvante del melanoma: dati reali dalla regione DACH, 47a Riunione annuale della Arbeitsgemeinschaft Dermatologische Forschung (ADF) Virtual, 04.03.-06.03.2021
- Schadendorf D, et al: Melanoma. Lancet 2018; 392: 971-984.
- Arozarena I, Wellbrock C: Superare la resistenza agli inibitori BRAF. Ann Transl Med 2017; 5: 387
DERMATOLOGIE PRAXIS 2021; 31(4): 44-45 (pubblicato il 18.8.21; in anticipo sulla stampa).