Gli inibitori della 5α-reduttasi riducono il volume della prostata e i sintomi associati. I possibili effetti collaterali sono disfunzioni sessuali e disturbi depressivi. Si ritiene che gli steroidi neuroattivi svolgano un ruolo importante in questo senso, ma i meccanismi esatti non sono ancora chiari. Negli studi sugli animali, sono stati evidenziati cambiamenti rilevanti nel sistema dopaminergico dopo il trattamento con la finasteride. La depressione, soprattutto l’anedonia, è associata alla disfunzione dei processi dopaminergici.
La prevalenza dell’iperplasia prostatica benigna (IPB) negli uomini di età compresa tra i 50 e i 70 anni è del 50-75% e di circa l’80% in quelli di età superiore ai 70 anni [1]. La terapia dipende dai sintomi e dallo stadio della malattia. Le opzioni di trattamento farmacologico includono fitoterapici (ad esempio, estratti di saw palmetto) e α-bloccanti selettivi, antiandrogeni o inibitori della 5α-reduttasi (5-ARI). Gli effetti dei 5-ARI (ad esempio, la finasteride) si basano su un forte calo della concentrazione di 5α-diidrotestosterone (DHT), dovuto al blocco irreversibile della 5α-reduttasi negli organi sessuali, nel cervello, nella pelle e in altri organi e tessuti [2]. Questo ha l’effetto di impedire la conversione del testosterone nell’androgeno più forte diidrotestosterone e di bloccare gli steroidi depressivi neuroattivi (ad esempio allopregnanolone, androsterone) [2]. I 5-ARI devono essere assunti per almeno 6-12 mesi. Oltre agli effetti terapeutici desiderati, come la riduzione della prostata e il miglioramento dei sintomi della minzione, possono esserci sintomi di accompagnamento come disfunzioni sessuali e disturbi depressivi. In un’analisi secondaria, Saengmearnuparp et al. ha indagato lo stato attuale delle conoscenze sulla relazione tra 5-ARI e depressione (riquadro) . Di seguito è riportato un estratto dei risultati.

Cambiamenti dipendenti dalla dose e dal tempo nel modello animale
Come dimostrano gli studi sperimentali nei roditori, le disfunzioni del sistema dopaminergico e le modifiche dell’asse ipotalamo-ipofisi-surrene sono tra i cambiamenti innescati dai 5-ARI [4,5]. In contrasto con gli effetti acuti, la finasteride ha provocato una modificazione comportamentale dipendente dalla dose e dal tempo nei ratti Wistar maschi adulti di [4,5] quando sono stati trattati per 24 h a 7 giorni e per ≥14 giorni negli esperimenti sugli animali. I risultati degli studi condotti su topi C57BL/6N hanno mostrato che i livelli cerebrali di DHT sono stati significativamente ridotti in un gruppo trattato con finasteride per 24 ore e 7 giorni, ma i livelli cerebrali di testosterone non sono cambiati [6].
Nei ratti maschi Sprague-Dawley, il trattamento con finasteride a basso dosaggio per ≥14 giorni non ha avuto effetti significativi sulla concentrazione dei prodotti della 5α-reduttasi, come il diidroprogesterone (DHP), il tetraidroprogesterone (THP) e il diidrotestosterone (DHT), indicando processi di compensazione [7]. I livelli plasmatici di DHT nel gruppo trattato con finasteride, tuttavia, sono stati significativamente ridotti [7].
Risultati animali sui processi dopaminergici
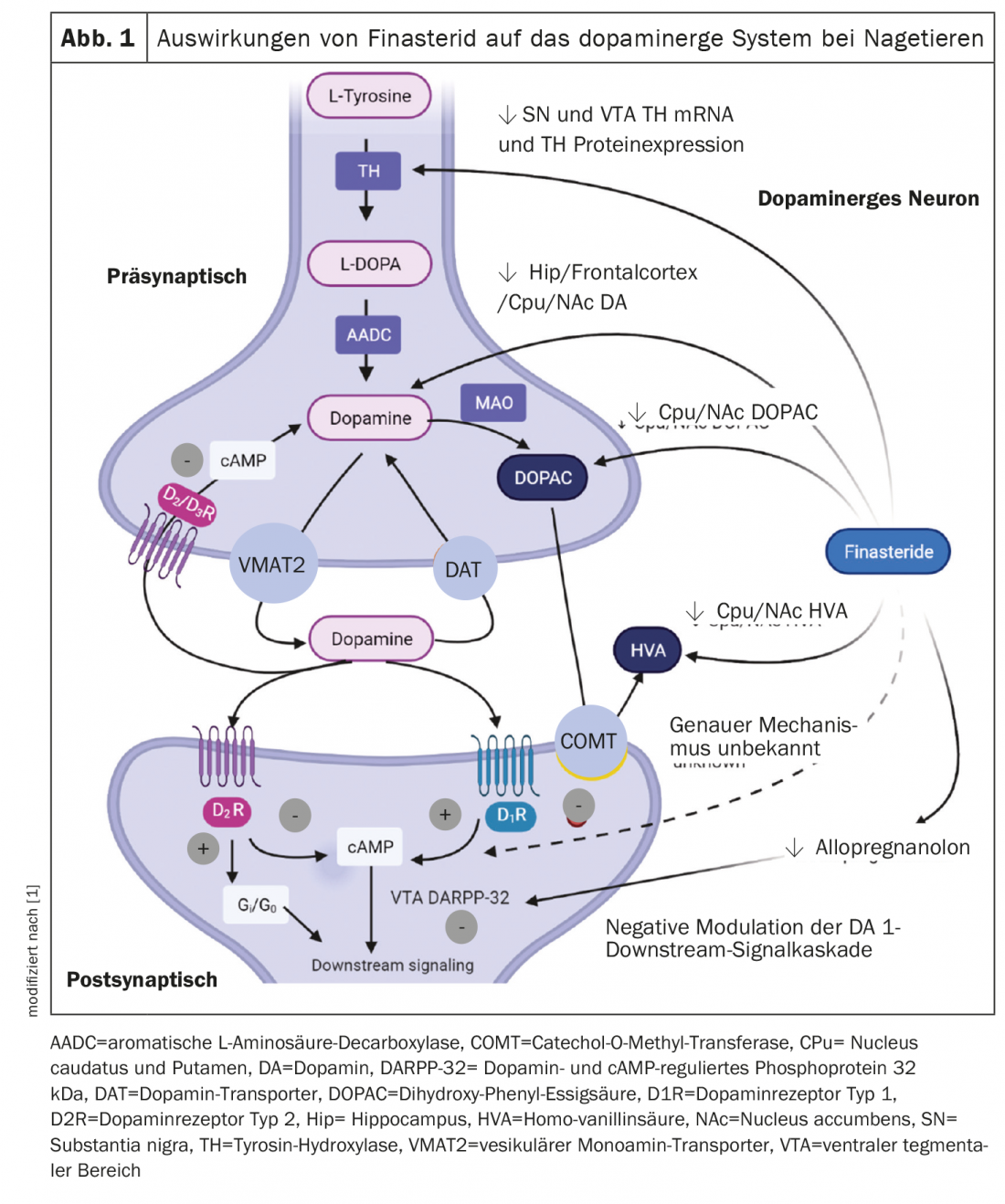
La somministrazione prolungata di finasteride ha ridotto le concentrazioni di dopamina e i suoi metaboliti in diverse regioni cerebrali nel modello del ratto [8]. Questi risultati sono stati osservati solo nel gruppo finasteride durante l’adolescenza o il periodo di aumento del testosterone. Anche i livelli di dopamina, acido diidrossifenilacetico e acido omovanillico nel nucleo caudato, nel putamen e nel nucleo accumbens sono diminuiti in modo significativo. Inoltre, è stata osservata una riduzione dell’espressione mRNA e proteica della tirosina idrossilasi nella substantia nigra e nelle aree tegmentali ventrali di questi ratti. Gli effetti della finasteride sul sistema dopaminergico osservati negli esperimenti sugli animali sono riassunti nella Figura 1 [8]. Nel complesso, i risultati suggeriscono che una diminuzione del DHT, il principale metabolita androgenico, durante un periodo di aumento del testosterone può essere una delle cause dei cambiamenti nel sistema dopaminergico. È stato anche documentato che i cambiamenti di altri steroidi neuroattivi, come il testosterone, gli estrogeni e i glucocorticoidi, attraverso la modulazione della segnalazione dopaminergica nei ratti adolescenti, rappresentano un rischio per la segnalazione dopaminergica nei ratti adolescenti [9].
Ippocampo: riduzione della neurogenesi e aumento della neuroinfiammazione
Un altro meccanismo che spiega i sintomi depressivi dopo il trattamento con i 5-ARI è la riduzione della neurogenesi nell’ippocampo. Inoltre, il trattamento con finasteride è stato associato a un aumento delle citochine proinfiammatorie nella regione dell’ippocampo [12,13]. Secondo i dati preclinici e clinici, esiste un legame tra la neuroinfiammazione e le tendenze comportamentali depressive [10,11].
Sulla base dei suddetti e di altri studi, gli autori deducono quanto segue: La neuroinfiammazione dovuta alla somministrazione di finasteride provoca una riduzione della neurogenesi e successivamente porta a sintomi depressivi. La neuroinfiammazione indotta dalla finasteride altera i processi dopaminergici e la sintesi di serotonina, favorendo il comportamento depressivo [14]. Inoltre, gli autori menzionano che ci sono prove che la finasteride promuove la disbiosi intestinale, influenzando così l’infiammazione sistemica. Quindi, la finasteride ha portato ad un aumento del ceppo di Bacteroidetes nell’intestino con una durata del trattamento da 24 ore a 7 giorni e un trattamento per ≥14 giorni. La disbiosi del microbiota intestinale è stata associata a comportamenti simili alla depressione nei ratti [8,14].
Letteratura:
- Saengmearnuparp T, et al: Il collegamento degli inibitori della 5-alfa reduttasi allo sviluppo della depressione. Biomed Pharmacother 2021; 143: 112100. doi: 10.1016/j.biopha.2021.
- “Crescita dei capelli con conseguenze”: Un trattamento con finasteride di successo può portare a problemi permanenti”, www.deutsche-apotheker-zeitung.de/daz-az/2018/daz-16-2018/haarwuchs-mit-folgen, (ultimo accesso 05.09.2022).
- Traish AM: Sindrome post-finasteride: una sfida superabile per i medici. Fertil Steril 2020; 113 (1): 21-50.
- Sasibhushana RB, et al: La somministrazione ripetuta di finasteride induce un comportamento simile alla depressione nei ratti maschi adulti. Behav Brain Res 2019; 365: 185-189.
- Li L, et al: La finasteride ha inibito il sistema dopaminergico cerebrale e i comportamenti in campo aperto nei ratti maschi adolescenti, CNS Neurosci Ther 2018; 24 (2): 115-125.
- Römer B, et al: Il trattamento con finasteride inibisce la neurogenesi ippocampale adulta nei topi maschi, Farmacopsichiatria 2010; 43 (5): 174-178.
- Giatti S, et al.: Effetti del trattamento subcronico con finasteride e della sua sospensione sui livelli di steroidi neuroattivi e sui loro recettori nel cervello del ratto maschio. Neuroendocrinologia 2016; 103 (6): 746-757.
- Yu M, et al: Variazioni del microbiota intestinale e del fenotipo metabolico fecale associati alla depressione mediante sequenziamento del gene 16S rRNA e metabolomica basata su LC/MS. J Pharm Biomed Anal 2017; 138: 231-239.
- Sinclair D, et al.: Impatto dello stress e degli ormoni sessuali sulla neurotrasmissione della dopamina nel cervello degli adolescenti. Psicofarmacologia 2014; 231 (8): 1581-1599.
- Snyder JS, et al: La neurogenesi dell’ippocampo adulto tampona le risposte allo stress e il comportamento depressivo, Nature 2011; 476 (7361): 458-461.
- Malberg JE, et al: Il trattamento antidepressivo cronico aumenta la neurogenesi nell’ippocampo del ratto adulto, J. Neurosci 2000; 20 (24): 9104-9110.
- Diviccaro S, et al: Il trattamento di ratti maschi con finasteride, un inibitore dell’enzima 5alfa-reduttasi, induce effetti di lunga durata sul comportamento depressivo, sulla neurogenesi ippocampale, sulla neuroinfiammazione e sulla composizione del microbiota intestinale. Psiconeuroendocrinologia 2019; 99: 206-215.
- Felger JC, Treadway MT: Effetti dell’infiammazione sulla motivazione e sull’attività motoria: ruolo della dopamina, Neuropsychopharmacology 2017; 42 (1): 216-241.
- Troubat R, et al: Neuroinfiammazione e depressione: una revisione, Eur J Neurosci 2021; 53 (1): 151-171.
PRATICA GP 2022: 17(9): 26-27