Le procedure di resezione nel trattamento del linfedema sono state sviluppate fin dall’inizio del secolo scorso. Sono invasivi e presentano molte complicazioni. Con il progresso della microchirurgia, le anastomosi linfovenose svolgono un ruolo importante nel migliorare la qualità di vita del paziente.
Le procedure di resezione nel trattamento del linfedema sono metodi che rimuovono chirurgicamente il tessuto in eccesso. Dalla fine del XIX secolo sono state descritte varie procedure, in parte storiche, per la terapia chirurgica del linfedema (Tab. 1).
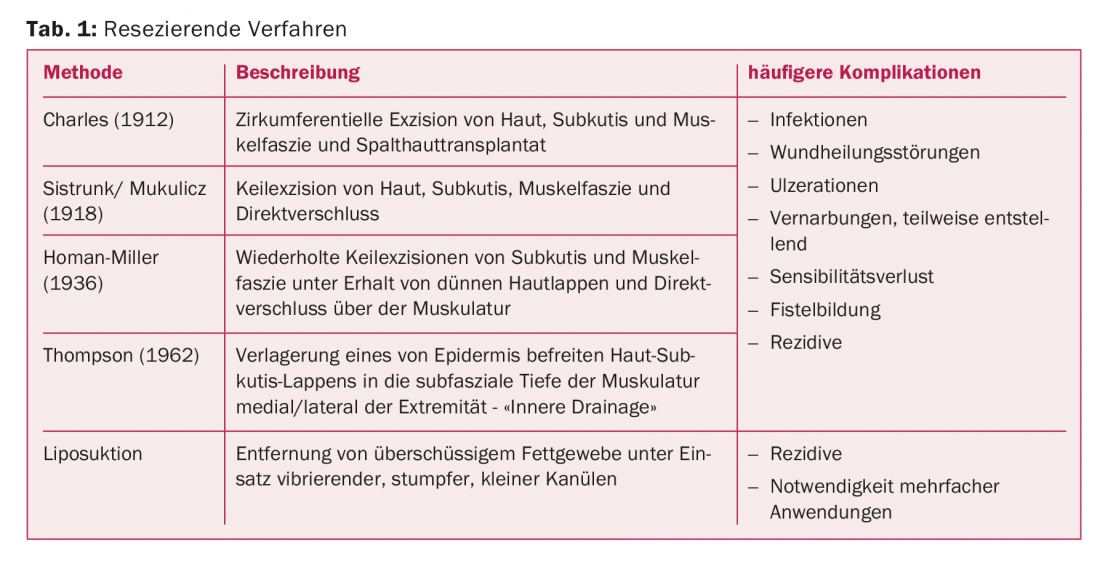
Nel 1912, è stata sviluppata la procedura Charles, in cui la pelle, il sottocute e la fascia muscolare vengono asportati in modo circonferenziale e coperti con una pelle divisa [1]. Secondo Sistrunk, le escissioni a cuneo di pelle, sottocute e fascia muscolare vengono eseguite con chiusura diretta, mentre nella procedura secondo Homan la pelle veniva risparmiata per la prima volta e chiusa sul difetto di tessuto resecato [2]. Questa procedura viene ripetuta fino a raggiungere la circonferenza desiderata. L’idea di collegare i linfatici superficiali e profondi si è affermata per la prima volta nel 1962, quando Thompson ha resecato il tessuto sottocutaneo e ha riposizionato un sottile lembo di pelle sottocutanea profilata nella profondità sottofasciale della muscolatura. Di conseguenza, non ci sono solo cicatrici deturpanti, ma anche frequenti fistole linfatiche e sinusoidi pilonidali [3].
Il processo di guarigione è spesso complicato dalle infezioni e dalla formazione di cicatrici instabili durante le procedure di resezione. Questi metodi devono essere esplorati nei casi di disabilità e di fallimento del trattamento nella fase finale del linfedema e possono aumentare l’efficacia delle terapie causali riducendo il cosiddetto ‘carico linfatico’. Possono essere combinati con metodi ricostruttivi. Nell’edema genitale, queste procedure vengono spesso prese in considerazione prima.
Liposuzione
La liposuzione è una procedura di resezione speciale che può ridurre efficacemente la circonferenza del linfedema degli arti. La liposuzione è la rimozione del tessuto adiposo in eccesso mediante aspirazione con cannule vibranti, smussate e piccole. La trasformazione del linfedema in tessuto adiposo (la cosiddetta trasformazione grassa) avviene molto spesso nel corso successivo della malattia. Il chirurgo svedese Hakan Brorson è stato il pioniere dell’uso della liposuzione per il linfedema degli arti e negli ultimi anni ha pubblicato risultati promettenti. In uno studio prospettico su 56 pazienti affetti da linfedema (29 primario, 27 secondario dopo la terapia antitumorale), la circonferenza dell’arto inferiore trattato con la liposuzione era ancora significativamente simile al lato sano dopo dieci anni [4]. Tuttavia, le persone colpite hanno continuato a indossare continuamente calze compressive. In un altro studio prospettico su 146 pazienti con cancro al seno che avevano sviluppato un linfedema dell’arto superiore, il volume in eccesso è stato efficacemente rimosso e la circonferenza ridotta dell’arto è stata mantenuta a lungo termine indossando costantemente calze compressive [5]. Un ampio studio di indagine ha rilevato un alto livello di soddisfazione psicologica e fisica tra le persone in trattamento [6].
Il rischio di un ulteriore danno ai vasi linfatici dovuto alla liposuzione non è stato ancora osservato né sperimentalmente né clinicamente. Gli esami anatomici dopo l’aspirazione in direzione longitudinale delle estremità non hanno potuto dimostrare alcun danno ai vasi linfatici epifasici. Di norma, non vengono aspirati più di quattro litri di grasso per ogni procedura, per evitare problemi circolatori e sbalzi elettrolitici. Potrebbero essere necessari diversi interventi.
Anastomosi linfovenose (LVA)
Sebbene l’interesse per il ruolo del sistema linfatico nei processi fisiologici e patologici sia cresciuto negli ultimi anni, la conoscenza del sistema linfatico rimane limitata rispetto a quella del sistema cardiovascolare. I meccanismi patologici del linfedema sono oggi sempre più studiati e le possibilità di trattamento chirurgico sono in continua espansione. Per ripristinare il drenaggio linfatico in modo fisiologico, vengono create anastomosi linfovenose, che consentono il drenaggio linfatico extraanatomico, in modo supermicrochirurgico. La supermicrochirurgia è una nuova tecnica e un ulteriore sviluppo della microchirurgia che permette di preparare e suturare insieme vasi molto piccoli con un diametro inferiore a 1 mm (0,3-0,8 mm). Vengono realizzati appositamente strumenti chirurgici molto sottili e si utilizzano microscopi con ingrandimento fino a 40x. Si utilizzano materiali di sutura molto sottili, che hanno uno spessore di 12-0 secondo la classificazione USP (< 0,1 mm di spessore del filo). Queste delicate anastomosi vengono solitamente inserite in anestesia generale per migliorare il comfort del paziente, ma in linea di principio possono essere inserite anche in anestesia locale.
I vasi linfatici stessi sono difficili da visualizzare nel complesso, perché sono di piccolo calibro e trasportano principalmente liquido linfatico chiaro e quasi privo di cellule. La maggior parte delle tecniche di visualizzazione si basa sulla capacità naturale dei vasi linfatici di assorbire i traccianti iniettati nello spazio tissutale. Il tracciante viene poi trasportato e concentrato nel vaso linfatico, consentendo varie modalità di imaging.
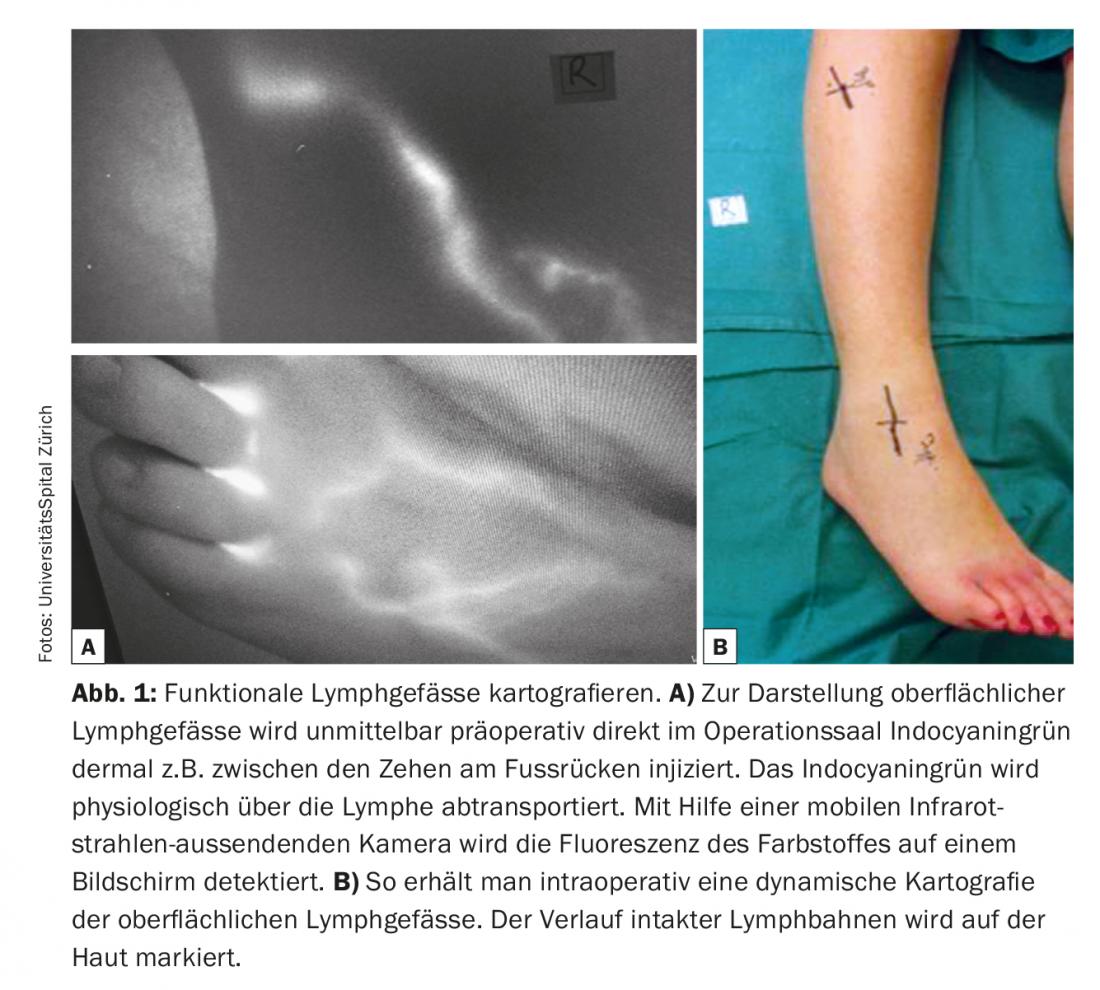
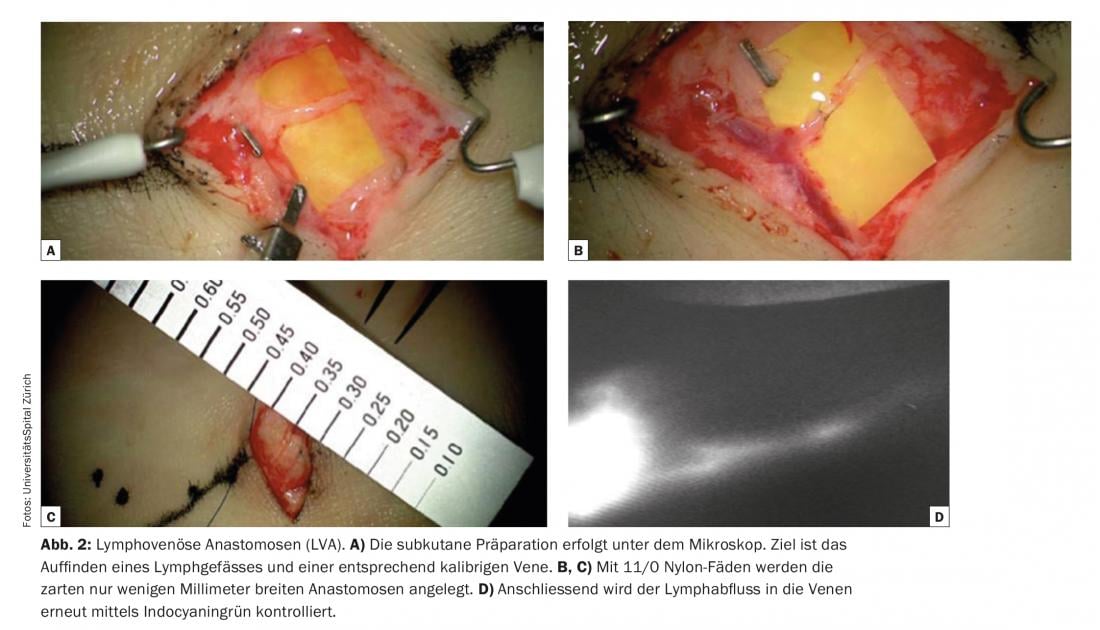
Una delle condizioni elementari per il successo delle anastomosi linfovenose è l’identificazione di vasi linfatici adatti, non fibrotici e con un’elevata capacità di trasporto. La linfangiografia con verde di indocianina (ICG) è attualmente utilizzata come tecnica relativamente semplice e rapidamente informativa per l’imaging dei vasi linfatici. Nei vasi linfatici funzionali – ad esempio delle estremità – il verde indocianina viene assorbito rapidamente e trasportato rapidamente nei canali linfatici lineari verso l’inguine o l’ascella. Spesso si può osservare anche la peristalsi. L’ICG viene utilizzato come una navigazione pre- e intra-operatoria valida ed economica. Il verde indocianina viene iniettato a livello cutaneo immediatamente prima dell’intervento in sala operatoria per visualizzare i vasi linfatici superficiali, ad esempio tra le dita dei piedi sul dorso del piede, e il decorso dei vasi linfatici viene segnato sulla pelle. (Fig. 1). La preparazione sottocutanea viene effettuata al microscopio (Fig. 2). L’obiettivo è trovare un vaso linfatico e una vena di calibro corrispondente. Le anastomosi vengono create con fili di nylon 11/0 o 12/0. Successivamente, il drenaggio linfatico nella vena viene controllato nuovamente con l’ICG. Spesso, i vasi linfatici aggiuntivi in una determinata area chirurgica, che non sono stati visualizzati e registrati dall’ICG prima dell’intervento, vengono rilevati solo intraoperatoriamente. Questi vasi aggiuntivi sono spesso di diametro maggiore e quasi più adatti. Il drenaggio linfatico è in parte visibile a occhio nudo. Questi cosiddetti vasi linfatici ICG-negativi sono sempre più utilizzati per generare anastomosi aggiuntive nell’area chirurgica e per potenziare la funzione di drenaggio.
Finora, queste osservazioni cliniche non sono state descritte in letteratura. In generale, la ricerca sperimentale in questo campo è molto limitata. Le funzioni di trasporto differenziale tra due vasi di raccolta sono state dimostrate in un modello di ratto [7]. Si ritiene che esistano modelli di drenaggio linfatico preferenziali, in modo che per un determinato spazio tissutale, il drenaggio linfatico sia la responsabilità principale di un singolo vaso, con eventuali vasi aggiuntivi nell’area che servono solo quando il sistema è sovraccarico o come via di trasporto di riserva per grandi carichi linfatici [7]. Le differenze di profondità e diametro dei vasi possono favorire il drenaggio linfatico attraverso un particolare vaso linfatico [7]. Anche gli effetti del verde indocianina sulla normale contrattilità linfatica e sulla funzione di drenaggio possono causare artefatti significativi [8].
L’identificazione delle piccole vene è problematica anche nei pazienti con linfedema, perché il grasso sottocutaneo è spesso ispessito e il tessuto fibrotico. Deve essere presente una vena adatta nelle immediate vicinanze di un vaso linfatico funzionale rilevato. I sistemi di visualizzazione senza contatto per l’identificazione preoperatoria delle venule sottocutanee con un diametro di circa 0,5-1,0 mm sono descritti in letteratura come promettenti [9].
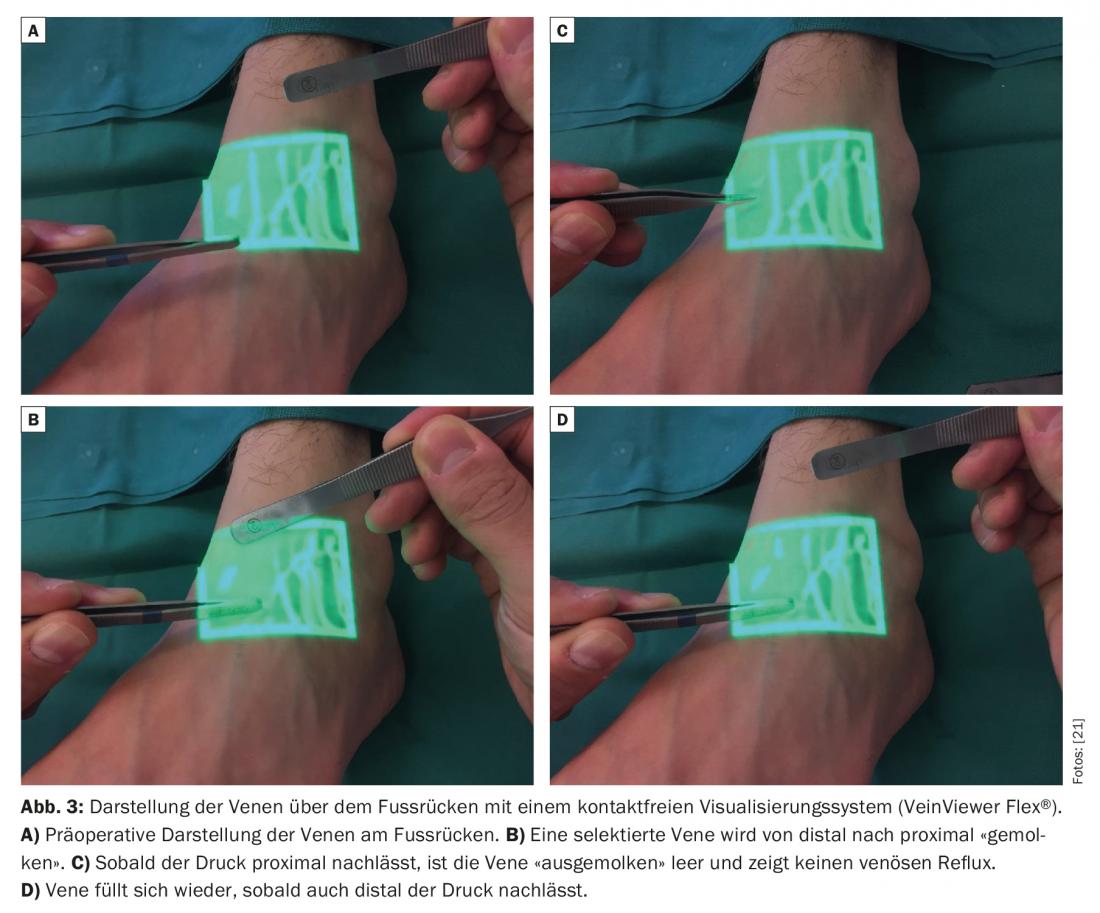
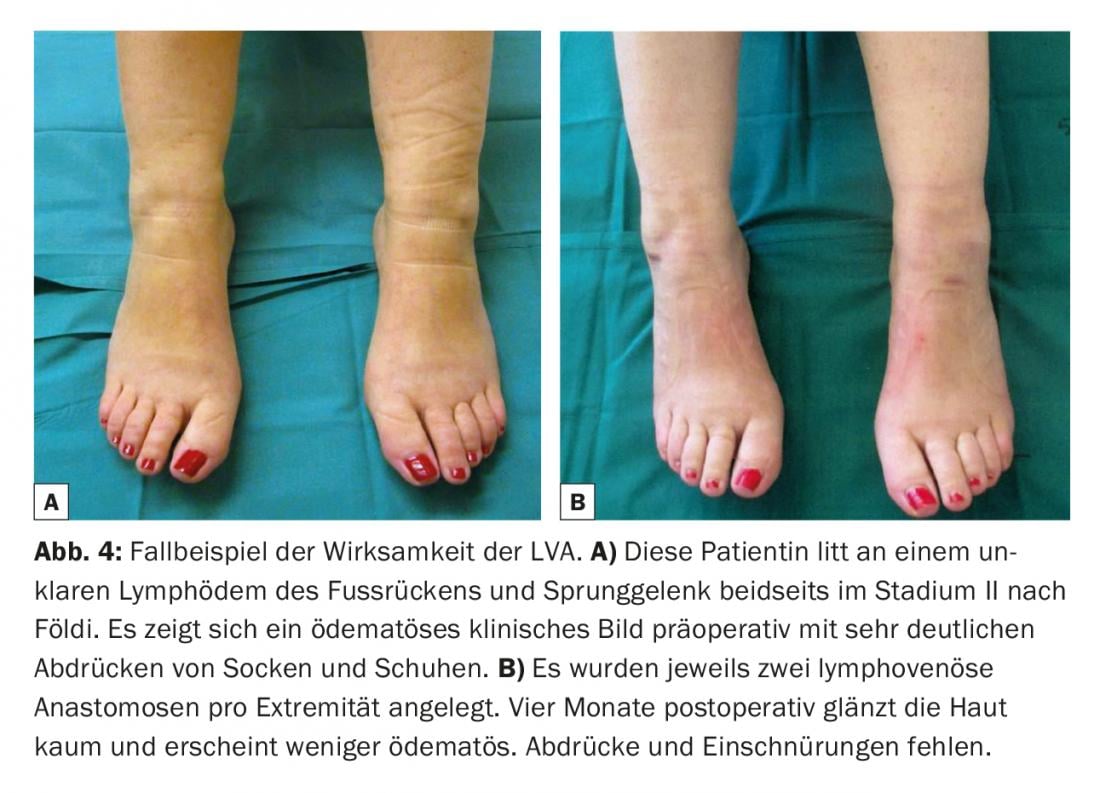
La pressione venosa è solitamente più alta rispetto al sistema linfatico [10,11]. Pertanto, anche l’assenza di reflusso venoso è di elementare importanza. Se la vena ha un sistema di valvole inadeguato o un decorso sfavorevole, può verificarsi un riflusso venoso nel vaso linfatico. Pertanto, la trombosi e la fibrosi delle anastomosi possono limitare in modo significativo la longevità delle anastomosi [12]. Pertanto, i sistemi di visualizzazione standard senza contatto sono sempre più utilizzati per ottenere una mappatura venosa rapida e per identificare le biforcazioni nascoste, nonché le valvole in posizione sfavorevole nelle vene che potrebbero potenzialmente avere un’influenza negativa sulla qualità delle anastomosi linfovenose create. (Fig.3). Dopo l’intervento, si indossa un leggero bendaggio compressivo per non mettere in pericolo le delicate anastomosi appena applicate. I pazienti rimangono ricoverati per una notte. Le lesioni cutanee nelle sopravvissute al cancro al seno con linfedema dell’arto superiore potrebbero quindi essere ridotte [13]. Molti studi clinici riportano una riduzione della circonferenza dal 35% al 50% nelle pazienti con cancro al seno e linfedema del braccio, un anno dopo il posizionamento di queste anastomosi [14–16]. La discrepanza di questi risultati è molto probabilmente dovuta ai risultati retrospettivi con solo un piccolo numero di casi. In uno studio prospettico più ampio con 100 casi, i ricercatori hanno recentemente determinato una riduzione della circonferenza fino al 38% dopo tre anni e hanno dimostrato che c’era anche un significativo sollievo dei sintomi a livello soggettivo [17]. Il dolore associato al linfedema è stato alleviato [18]. In un altro studio clinico condotto su 49 pazienti affetti da linfedema secondario degli arti inferiori, è stato rilevato che la combinazione delle anastomosi linfovenose con la liposuzione può anche ridurre in modo significativo la consistenza della pelle e la circonferenza [19]. Nel complesso, si ipotizza che l’efficacia della LVA sia maggiore nelle fasi iniziali (Fig. 4) . In letteratura esistono case report e revisioni che dimostrano che l’insorgenza di linfedema dopo la linfoadenectomia può essere significativamente ridotta con il posizionamento profilattico di anastomosi linfovenose [20].
In sintesi, le procedure di resezione sono invasive e piene di complicazioni e vengono prese in considerazione solo nelle fasi finali della malattia. La liposuzione è una procedura di resezione speciale perché è meno invasiva e ha prodotto risultati eccellenti in molti studi clinici. Le procedure di resezione possono essere combinate con la creazione di anastomosi linfovenose in alcuni casi. La creazione di anastomosi linfovenose è una procedura chirurgica sicura e ha mostrato risultati di miglioramento della qualità della pelle e di riduzione della circonferenza negli studi clinici e sperimentali disponibili fino ad oggi, anche se i risultati a lungo termine sono ancora in sospeso. In definitiva, in futuro sono necessari ulteriori studi sperimentali e studi clinici-prospettici a lungo termine con un numero maggiore di pazienti, per poter dimostrare meglio l’evidenza di questa terapia e ottimizzare continuamente la procedura dal punto di vista tecnico.
Le anastomosi linfovenose sono riconosciute a livello internazionale come parte integrante della terapia chirurgica del linfedema.
Messaggi da portare a casa
- Le procedure di resezione sono invasive e piene di complicazioni. Vengono presi in considerazione solo nelle fasi finali della malattia.
- La creazione di anastomosi linfovenose è una procedura chirurgica sicura e ha mostrato risultati di miglioramento della qualità della pelle e di riduzione della circonferenza negli studi clinici e sperimentali disponibili.
- Le anastomosi linfovenose sono riconosciute a livello internazionale come parte integrante della terapia chirurgica del linfedema.
Letteratura:
- Charles H: Elefantiasi della gamba. In: Latham A, English TC, editori. Un sistema di trattamento. Vol. Londra: Churchill 1912: 516.
- Sistrunk WE: Contributo alla chirurgia plastica: rimozione delle cicatrici per gradi; un’operazione aperta per una lacerazione estesa dello sfintere anale; l’operazione Kondoleon per l’elefantiasi. Ann surg 1927; 85: 185-193.
- Thompson N: Operazione con lembo dermico interrato per il linfedema cronico dell’estremo. Plast Reconstr Surg 1970; 45: 541-548.
- Brorson H: La liposuzione normalizza l’ipertrofia del tessuto adiposo indotta dal linfedema nell’elefantiasi della gamba. Plast Reconstr Surg 2015; 136 (4): 133-134.
- Brorson H: Riduzione completa del linfedema del braccio dopo il cancro al seno – Uno studio prospettico di ventuno anni. Plast Reconstr Surg 2015; 136 (4): 134-135.
- Hoffner M, et al: L’SF-36 mostra un aumento della qualità di vita in seguito alla riduzione completa del linfedema postmastectomia con la liposuzione. Lymphat Res Biol 2017; 15 (1): 87-98.
- Gashev AA et al: Verde indocianina e imaging linfatico: problemi attuali. Ricerca e biologia linfatica. 2010; 8 (2): 127-130.
- Weiler M, Dixon JB: Funzione di trasporto differenziale dei vasi linfatici nel modello della coda del ratto ed effetti a lungo termine del Verde Indocianina, valutati con l’imaging nel vicino infrarosso. Frontiere della fisiologia. 2013; 4: 215.
- Makoto M, et al: Linfedema dell’arto inferiore trattato con anastomosi linfatico-venosa basata sulla linfografia icg pre e intraoperatoria e sulla visualizzazione della vena senza contatto: un rapporto di caso. Microchirurgia 2012; 32: 227-230.
- Wardhan R, Shelley K: Forma d’onda della pressione venosa periferica. Curr Opin Anaesthesiol 2009; 22: 814-821
- Munn LL: Meccanobiologia delle contrazioni linfatiche. Semin Cell Dev Biol 2015; 38: 67-74.
- Yamamoto T, Koshima I: Neo-valvuloplastica per la supermicrochirurgia linfatica. JPlast Reconstr Aesthet Surg 2014; 67: 587-588.
- Jeremy ST, et al: Il bypass linfatico-venoso riduce le alterazioni patologiche della pelle nel cancro al seno dell’estremità superiore rel. Linfedema. Lymphatic Res Biol. 2015; 13: 46-53.
- Koshima I, et al: Anastomosi linfaticovenosa supermicrochirurgica per il trattamento del linfedema degli arti superiori. J Reconstr Microsurg 2000; 16: 437-442
- Furukawa H, et al: Impianto linfaticovenoso microchirurgico mirato al riflusso linfatico cutaneo mediante linfografia a fluorescenza verde indocianina nel trattamento del linfedema postmastectomia. Plast Reconstr Surg 2011; 127: 1804-1811.
- Chang DW: Bypass linfatico-venoso per la gestione del linfedema nelle pazienti con cancro al seno: uno studio prospettico. Plast Reconstr Surg 2010; 126: 752-758.
- Chang DW, et al: Un’analisi prospettica di 100 casi consecutivi di bypass linfovenoso per il trattamento del linfedema dell’estremità. Chirurgia plastica ricostruttiva 2013; 132: 1305-1314.
- Mihara M, et al: L’anastomosi linfatico-venosa libera dal dolore associato al linfedema dell’estremità inferiore. Plast Reconst Surg Global Open. 2017; 5 (1): e1205.
- Chang K1, et al: Liposuzione combinata con anastomosi linfatico-venosa per il trattamento del linfedema secondario degli arti inferiori: un rapporto di 49 casi. Zhonghua Wai Ke Za Zhi 2017; 55 (4): 274-278.
- Jorgensen MG, et al: L’effetto dell’anastomosi linfovenosa profilattica e degli shunt per prevenire il linfedema correlato al cancro: una revisione sistematica e una meta-analisi. Microchirurgia 2017; 00: 1-10.
- Scaglioni M, et al: Ottimizzazione dei risultati della supermicrochirurgia dell’anastomosi linfatico-venosa (LVA) mediante l’identificazione preoperatoria della vena priva di reflusso: scegliere la vena con saggezza. Manoscritto presentato a Microsurgery, 2017.
CARDIOVASC 2017; 16(5): 11-15