Il 21 agosto 2014 si è tenuto un simposio sull’ictus all’Inselspital di Berna, organizzato dal Dipartimento universitario di Neurologia. Le prime presentazioni hanno riguardato la struttura e la certificazione delle stroke unit. Dopo la pausa, gli esperti hanno fornito informazioni su vari aspetti della terapia dell’ictus. Riportiamo sei delle nove conferenze.
(ee) L’unità di emergenza neurologica dell’ospedale centrale dell’Università di Helsinki serve un bacino di utenza di 1,6 milioni di abitanti (tutta la Finlandia: circa 5,5 milioni di persone). Il Prof. Dr. med. Turgut Tatlisumak, medico capo dello Stroke Center di Helsinki, ha mostrato come è riuscito a migliorare il tempo medio dall’insorgenza dei sintomi alla trombolisi nel suo ospedale per i pazienti con ictus. L’obiettivo delle misure era quello di ottenere la ricanalizzazione nel maggior numero possibile di pazienti.
Le catene di salvataggio forti sono importanti
La trombolisi deve avvenire nelle prime 4,5 ore dall’insorgenza dei sintomi – prima è, meglio è. Questo tempo è suddiviso in tempo “onset-to-door” (riconoscimento dei sintomi, chiamata di emergenza, arrivo all’ambulatorio, valutazione del paziente, trasferimento al pronto soccorso) e tempo “door-to-needle” (ricovero del paziente, anamnesi ed esami, laboratorio, imaging, valutazione dell’indicazione alla trombolisi, ottenimento del consenso, inizio del trattamento). Tutti gli anelli di questa catena devono essere ottimizzati.
Il Prof. Tatlisumak ha sottolineato che è molto importante mantenere il tempo door-to-needle breve, anche se un paziente arriva in ospedale rapidamente e teoricamente ha più tempo per i chiarimenti in ospedale. All’Ospedale Centrale dell’Università di Helsinki, circa il 30% dei pazienti con ictus riceve la trombolisi, e il tempo da porta a ago è diminuito da tre ore nel 1998 a una media di 20 minuti oggi. Un neurologo è sempre presente in ospedale per ricevere il paziente con ictus e successivamente prendere tutte le decisioni fino alla trombolisi. Questi medici frequentano corsi di formazione speciali.
Devono essere prese misure anche per il periodo fuori dall’ospedale: informazione costante della popolazione sui sintomi e sulla procedura corretta in caso di sospetto ictus, formazione continua dei paramedici, organizzazione della catena di soccorso, ecc. “I pazienti con ictus dovrebbero essere ricoverati solo in ospedali che hanno accesso a una stroke unit 24 ore su 24”, ha chiesto il relatore. Il lavoro prezioso viene svolto già durante il trasporto del paziente in ospedale (predisposizione dell’accesso, esami di laboratorio, monitoraggio dei parametri vitali, ricerca dei numeri di telefono dei parenti, notifica all’ospedale, ecc.)
In Germania, attualmente sono in corso prove in due città con unità mobili per l’ictus, ossia ambulatori speciali dotati di TAC, laboratorio e personale qualificato. L’obiettivo è portare la stroke unit – e quindi la possibilità di trombolisi – al paziente, piuttosto che il paziente alla stroke unit. Attualmente non è chiaro se questo dimezzerà il tempo necessario per la trombolisi e migliorerà l’esito del paziente.
Opzioni di terapia endovascolare per l’ictus
Il Prof. Jan Gralla, MD, Neuroradiologia, Inselspital Bern, ha parlato delle diverse terapie endovascolari. In tutti questi casi, l’obiettivo è ripristinare la perfusione cerebrale, preservare le funzioni della penombra cerebrale e quindi ottenere un deficit neurologico minore per il paziente. A seconda della procedura, si aprono finestre temporali diverse: 4,5 ore per la lisi i.v., sei ore per la lisi intra-arteriosa e otto ore per la trombectomia meccanica. Un problema della lisi i.v. è che i trombi di grandi dimensioni (>8 mm) nei vasi di grandi dimensioni non vengono dissolti. Questi trombi sono suscettibili di trombectomia meccanica – che, tuttavia, non è facile da eseguire perché i vasi cerebrali sono stretti e corrono in modo molto tortuoso.
Le procedure di trombectomia si dividono in trombectomia distale (il cestello viene dispiegato dietro il trombo) e la più moderna procedura con stent retriever (lo stent viene posizionato parallelamente al trombo e poi dispiegato, successivamente rimosso con il trombo). Con la procedura di stent retriever, i tassi di ricanalizzazione sono elevati (fino all’80%) con buoni esiti per il paziente. La procedura è anche veloce: in media, ci vogliono 25-45 minuti dal punto inguinale alla ricanalizzazione. Oggi ci sono molti diversi recuperatori di stent sul mercato. Tuttavia, l’efficacia non è stata ancora dimostrata da studi randomizzati e controllati.
Rimane aperta la questione di quale procedura utilizzare per trattare i pazienti che possono essere trattati entro 4,5 ore dalla comparsa dei sintomi. Le tre opzioni disponibili sono state presentate in tre studi pubblicati sul NEJM nel febbraio 2013, e non è stata riscontrata alcuna differenza in termini di efficacia. Tuttavia, questi studi presentano diversi punti deboli, ha sottolineato il relatore. Attualmente è in corso lo studio SWIFT-PRIME, in cui i pazienti vengono trattati con lisi i.v. o con lisi i.v. seguita da ricanalizzazione meccanica. Tuttavia, anche le condizioni iniziali sono decisive per il risultato. Il Prof. Gralla la mette così: “Si può salvare solo ciò che c’è ancora”, sottolineando così ancora una volta l’importanza di una catena di salvataggio ottimizzata.
Fibrillazione atriale, anticoagulazione e ictus
Il Prof. Dr. med. Heinrich Mattle, Inselspital di Berna, ha fornito informazioni sulla correlazione tra fibrillazione atriale (FA) e ictus. La maggior parte dei pazienti con VCF viene visitata per la prima volta dal medico internista, ad esempio a causa dell’ipertensione o dell’insufficienza cardiaca. “Solo” il 10% circa ha un ictus o un attacco ischemico transitorio (TIA) come primo sintomo. I pazienti con ictus e VHF sono in media più anziani dei pazienti con ictus senza VHF e presentano più spesso infarti territoriali. L’anticoagulazione riduce il rischio di ictus di due terzi. L’eventuale indicazione all’anticoagulazione viene valutata con il punteggio CHA2DS2-VASc. I nuovi anticoagulanti (dabigatran, rivaroxaban, apixaban) funzionano meglio del warfarin per la prevenzione degli ictus emorragici. Dabigatran riduce il rischio di ictus meglio di Marcoumar® e provoca meno effetti collaterali emorragici.
Il Prof. Mattle ha risposto ad alcune domande pratiche sull’anticoagulazione per l’ictus:
- Quando iniziare l’anticoagulazione dopo un TIA o un ictus? I pazienti ricevono aspirina (non eparina) per le prime due settimane. Successivamente, viene applicata la regola “1-3-6-12”: Nel caso di un TIA, l’anticoagulazione inizia immediatamente (giorno 1), nel caso di un ictus minore dopo tre giorni, nel caso di un infarto moderato dopo sei giorni e nel caso di un infarto grave dopo 12-21 giorni.
- I farmaci anticoagulanti e antiaggreganti devono essere combinati? La tripla terapia non è raccomandata a causa del rischio relativamente elevato di emorragia. Tuttavia, l’anticoagulazione più i farmaci antiaggreganti (il clopidogrel è il migliore negli studi) è utile, anche per i pazienti coronarici con stent.
- L’anticoagulazione deve essere ripresa dopo un’emorragia cerebrale? In linea di principio, è necessario conoscere la causa dell’emorragia per poter prendere una decisione in merito. Se c’è un’emorragia in profondità nel cervello, l’anticoagulazione può essere ricominciata dopo 10-14 giorni. Per evitare una nuova emorragia, mantenere l’INR <3, abbassare la pressione sanguigna e non associare farmaci antiaggreganti. Per le emorragie superficiali, il rischio di sanguinamento con l’anticoagulazione potrebbe essere troppo elevato, ma le prove sono carenti.
- I pazienti con cavernomi dovrebbero essere anticoagulati? Se il paziente non ha avuto emorragie, si può procedere all’anticoagulazione, poiché il rischio di emorragia è minimo. Tuttavia, se il cavernoma ha sanguinato, esiste un rischio significativo di nuove emorragie; in questi pazienti, il cavernoma deve essere rimosso chirurgicamente prima dell’anticoagulazione.
- I pazienti neurochirurgici dovrebbero essere anticoagulati? Dieci settimane dopo l’ematoma subdurale o la craniotomia, questi pazienti ricevono uno dei nuovi anticoagulanti. Nel periodo precedente, i pazienti vengono trattati con l’eparina.
- I pazienti ad alto rischio di cadute possono essere anticoagulati? Il rischio di cadute è spesso sovrastimato e di solito il beneficio dell’anticoagulazione è maggiore del rischio di sanguinamento dopo una caduta. Uno studio svizzero ha rilevato che l’emorragia grave e pericolosa per la vita non è più comune nei pazienti con caduta rispetto alle altre persone. Uno studio recente dimostra che nei pazienti con un punteggio di 0-3 sul punteggio CHADS, il rischio di anticoagulazione è maggiore del beneficio; tuttavia, l’anticoagulazione dovrebbe essere somministrata a partire da un punteggio di quattro sul punteggio CHADS.
- Cosa devono fare i pazienti con controindicazioni all’anticoagulazione? Devono essere chiariti da un cardiologo, perché la chiusura dell’orecchio atriale può essere possibile e utile.
L’ictus criptogenetico esiste?
Se le indagini standard per trovare la causa di un ictus (ECG, ECG delle 24 ore, eco, imaging, laboratorio, ecc.) sono negative, si ipotizza un ictus criptogenetico (in circa il 20-40% dei pazienti con ictus). Il PD Dr. med. Simon Jung, Berna, ha raccomandato che sarebbe meglio usare il termine “ictus embolico di causa indeterminata”, perché con chiarimenti prolungati si potrebbe individuare una causa nella maggior parte di questi pazienti (Fig. 1).
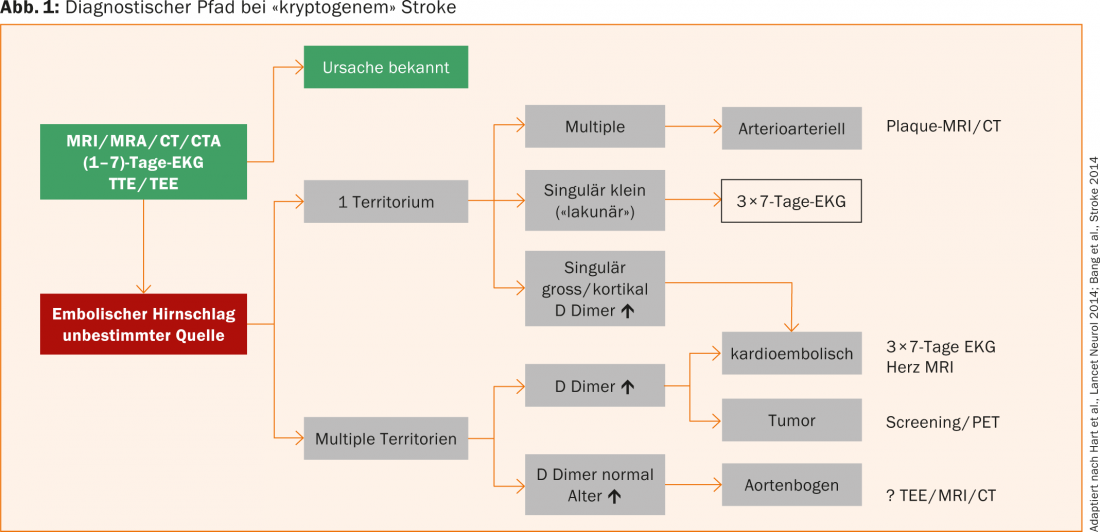
In primo luogo, si distingue se la lesione o le lesioni ischemiche interessano uno o più territori. Ischemie multiple in un territorio sono sospette di un evento arterioarterioso, anche in presenza di placche stenosanti emodinamicamente non significative. In questi pazienti, è utile la ricerca della placca instabile con la risonanza magnetica/TC. Nel caso di infarti singolarmente grandi o in posizione corticale o nel caso di distribuzione su più territori e nel caso di D-dimeri marcatamente elevati, una genesi cardioembolica è probabile e deve essere ricercata con enfasi. Studi recenti dimostrano che il rilevamento del VHF intermittente aumenta con il tempo di registrazione. Pertanto, si raccomanda di eseguire un ECG di 7 giorni e di ripeterlo due volte se è negativo.
Se diversi territori sono interessati da lesioni ischemiche e i D-dimeri sono elevati, si deve considerare un disturbo della coagulazione associato al tumore, oltre a un’eziologia cardioembolica. Con lesioni in territori multipli e D-dimeri normali, possono essere presenti placche nell’arco aortico, di solito in pazienti che tendono ad essere più anziani. La diagnosi viene effettuata mediante ecocardiografia trans-esofagea, risonanza magnetica o TAC.
La diagnostica estesa può ridurre in modo significativo la percentuale di pazienti con una causa sconosciuta di ictus, che si traduce anche in un cambiamento rilevante della terapia per la maggior parte di questi pazienti (ad esempio, anticoagulazione o terapia antitumorale).
Gestione della pressione arteriosa nell’ictus acuto
“Dopo un ictus ischemico, la pressione sanguigna è elevata nella maggior parte dei pazienti”, ha detto il PD Dr med Urs Fischer, dell’Inselspital di Berna. “L’81% dei pazienti ha la pressione sistolica >140 mmHg. Il meccanismo alla base dell’aumento della pressione sanguigna non è chiaro”. Le cause sospette includono l’interruzione dell’autoregolazione cerebrale, i fattori neuroendocrini, la disregolazione dovuta alla morte del tessuto cerebrale, lo stress psicologico, ecc. In alcuni casi, l’aumento della pressione sanguigna è anche la causa dell’ictus. La pressione arteriosa post-ictus ha una componente prognostica: più bassa o alta è la pressione, peggiore è il destino del paziente (curva a U).
Se e quanto si debba abbassare la pressione sanguigna è controverso. Secondo lo studio SCAST, non c’è differenza di risultato se la pressione sanguigna viene abbassata o meno. Tuttavia, in questo studio le emorragie e le ischemie sono state valutate insieme, il che è problematico. Nello studio CATIS del 2013, sono stati esaminati solo i pazienti con ictus ischemico. Anche in questo caso, non ci sono state differenze complessive nell’esito. Tuttavia, il tempo di follow-up era di soli 14 giorni e quindi non si possono fare affermazioni sugli effetti a lungo termine della riduzione della pressione sanguigna nella fase acuta. Nella fase subacuta, tuttavia, la pressione sanguigna può essere probabilmente abbassata senza danneggiare il paziente.
Lo studio COSSACS ha cercato di rispondere se gli antipertensivi devono essere messi in pausa nell’ictus acuto. Anche in questo caso, il destino dei pazienti non dipendeva dall’arresto o dalla sosta. dal proseguimento del trattamento dell’ipertensione, ma lo studio aveva una potenza troppo bassa per fare un’affermazione definitiva. Almeno i risultati suggeriscono che i farmaci per la pressione sanguigna possono essere continuati nell’ictus acuto, il che ha senso visto che i pazienti spesso soffrono anche di malattie cardiache. In linea di principio, le linee guida AHA si applicano alla riduzione della pressione arteriosa dopo un ictus ischemico: riduzione della pressione arteriosa di un massimo del 15% e solo per valori sistolici >220 mmHg o diastolici >120 mmHg.
In caso di emorragia cerebrale, spesso si teme che l’ematoma possa aumentare con la pressione alta. Nello studio INTERACT, la pressione sanguigna è stata abbassata al di sotto di 140 mmHg per l’emorragia intracranica. Questa misura era sicura, ma non c’era molta differenza nel destino rispetto al gruppo di pazienti senza riduzione della pressione sanguigna. Il relatore ha interpretato i risultati con cautela: “Abbassare la pressione sanguigna probabilmente non è dannoso e forse porta a un miglioramento del destino clinico – tuttavia, questo vale solo per le emorragie cerebrali con un piccolo volume di ematoma”.
Finora, molti studi randomizzati su pressione arteriosa e ictus presentano importanti debolezze metodologiche. Negli studi futuri che indagano sul potenziale della riduzione della pressione arteriosa nell’ictus cerebrale, devono essere presi in considerazione altri fattori come la penombra, la pressione arteriosa premorbosa, il sito di occlusione del vaso, ecc. e devono essere inclusi solo i pazienti con un quadro clinico coerente (ischemia o emorragia).
Gestione dell’emorragia intracerebrale
“Purtroppo, non c’è quasi nessuna prova a favore di qualcosa nella gestione dell’emorragia intracerebrale!”. Così il Prof. Jürgen Beck, medico dell’Inselspital di Berna, ha introdotto la sua conferenza. Le emorragie intracerebrali sono più frequenti nelle persone anziane. Si raccomanda di abbassare la pressione sanguigna dei pazienti a 160 mmHg (180 mmHg per la pressione intracranica). Tuttavia, lo studio INTERACT ha dimostrato che non c’era alcuna differenza nell’esito o nell’incidenza del sanguinamento tra i pazienti con riduzione aggressiva della pressione arteriosa (<140 mmHg) e i pazienti senza riduzione della pressione arteriosa.
Non ci sono nemmeno prove per la rimozione chirurgica dell’emorragia. Nello studio STICH, non c’è stato alcun effetto positivo della rimozione dell’ematoma per tutti i pazienti. Nel sottogruppo di pazienti in coma profondo, l’intervento chirurgico ha addirittura aumentato il rischio di un esito negativo! C’è una tendenza a migliorare l’esito dell’intervento chirurgico solo nelle emorragie superficiali e lobari e nei pazienti con un punteggio di 9-13 sul GCS (cioè i pazienti non completamente svegli ma non in coma profondo). Anche l’entità dell’emorragia gioca un ruolo: nel caso di emorragie profonde con un volume di >30 ml, i pazienti non hanno quasi nessuna possibilità di sopravvivenza.
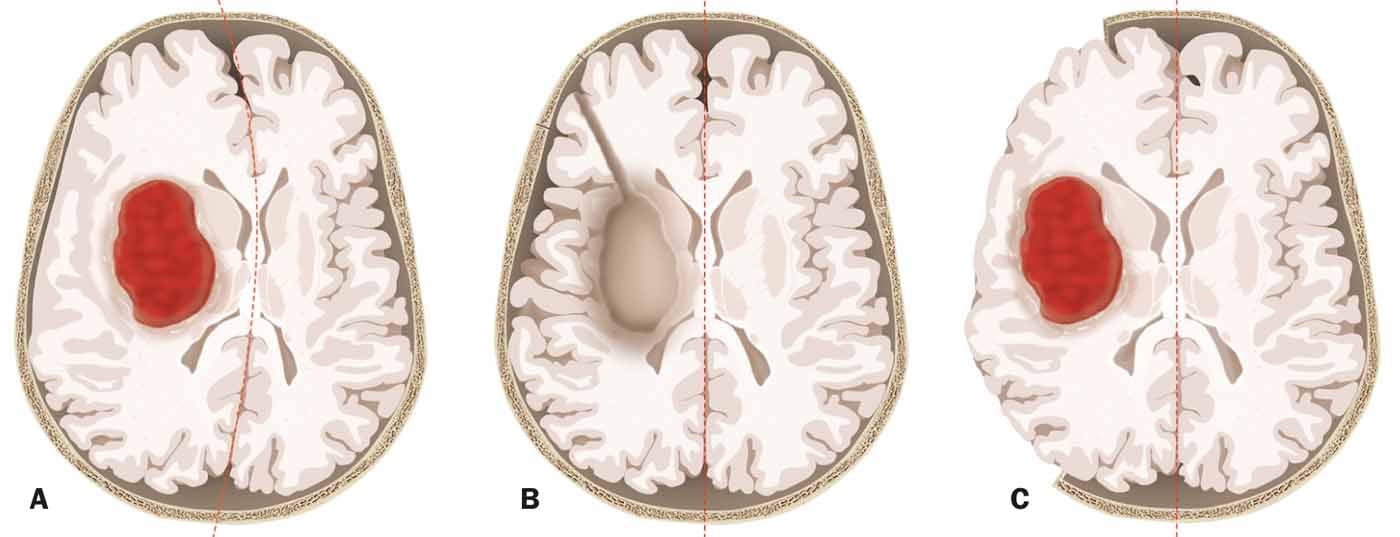
Il relatore ha sottolineato che quando si rimuove un’emorragia, la procedura stessa spesso mette a rischio il paziente. A differenza delle operazioni al tumore, per esempio, è probabile che anche il parenchima cerebrale funzionale venga danneggiato durante la rimozione di un’emorragia in una situazione di emergenza. Un’alternativa è la craniectomia decompressiva, che risparmia il parenchima (Fig. 2) . Ci sono prove che le craniectomie per l’emorragia cerebrale possono ridurre la mortalità. Un nuovo studio svizzero (SWITCH) è stato pianificato per verificare se la craniectomia può non solo ridurre la mortalità, ma anche migliorare gli esiti. Si spera che il reclutamento dei primi pazienti possa iniziare quest’anno.

Fonte: Simposio sull’ictus, 21 agosto 2014, Berna