A Medidays, il programma di formazione in medicina interna dell’Ospedale Universitario di Zurigo (USZ), sono state tenute anche delle presentazioni su vari temi ematologici. Come si chiarisce l’anemia in modo significativo? Quali pazienti dovrebbero essere passati ai nuovi anticoagulanti nella pratica? E quali sono le misure terapeutiche di cui beneficiano i pazienti con leucemia linfatica cronica?
(ee) Il Dr. med. Jeroen Goede, primario a.i. della Clinica di Ematologia dell’Ospedale Universitario di Zurigo, ha fornito informazioni sulla diagnosi e sul trattamento dell’anemia. Le cause di una discrepanza tra la concentrazione di emoglobina e la massa eritrocitaria sono varie (Tab. 1). In linea di massima, la concentrazione di emoglobina dipende da vari fattori come l’età, il sesso, la razza e l’altitudine di residenza. I valori di riferimento per l’anemia sono <120 g/l nelle donne, <110 g/l in gravidanza e <130 g/l negli uomini. Il valore più basso nelle donne non è dovuto alle mestruazioni, ma alla diminuzione dei livelli di testosterone; quando i livelli di testosterone diminuiscono negli uomini con l’età, anche la concentrazione di emoglobina diminuisce.
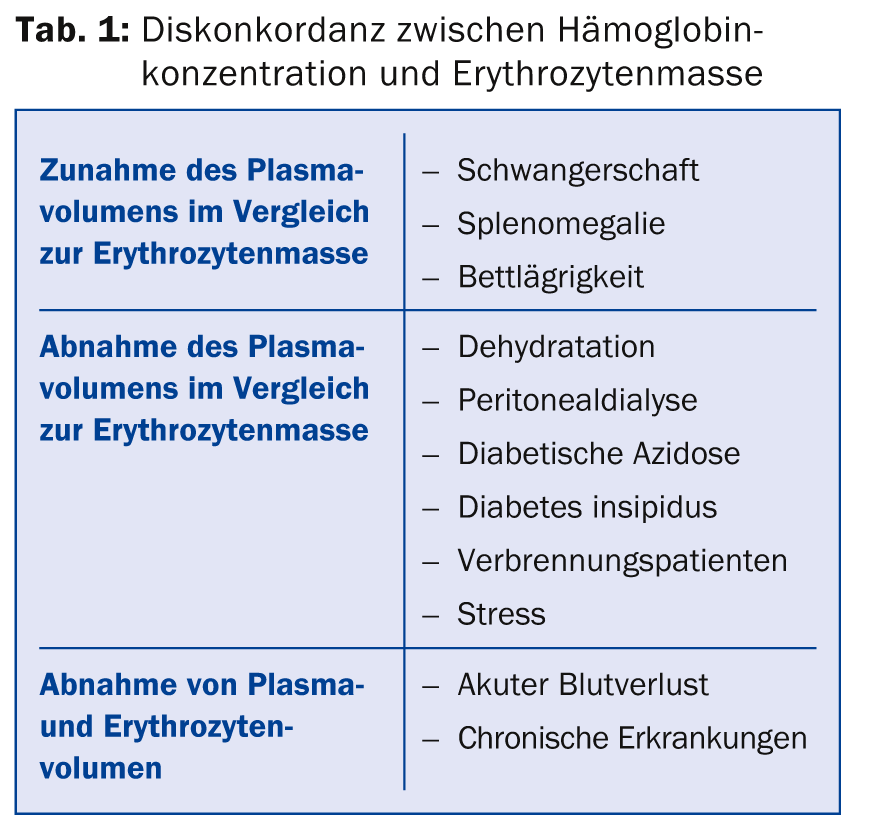
La diagnosi differenziale dell’anemia è molto varia. Fondamentalmente, si distingue tra produzione inadeguata di eritrociti (ad esempio, nella carenza di ferro o nel disturbo della normale eritropoiesi nelle neoplasie), aumento della degradazione (ad esempio, nelle protesi valvolari cardiache, nell’anemia emolitica autoimmune, nei difetti di membrana, ecc.), perdita di eritrociti (emorragia acuta o cronica) e “pseudo” anemia (ad esempio, in gravidanza). Alcuni esami di laboratorio sono di solito sufficienti per chiarire inizialmente l’anemia (Tabella 2). Ciò consente di effettuare la diagnosi in circa due terzi di tutte le anemie.

Il metabolismo del ferro è molto complesso. Nel 99% dei casi, tuttavia, la determinazione della ferritina è sufficiente per la diagnosi di anemia da carenza di ferro; uno stato sideropenico completo di solito non è necessario. In caso di carenza di ferro, ai pazienti deve essere raccomandata una dieta ricca di ferro (carne, tuorlo d’uovo, cereali con buccia, soia, noci, pane integrale). La sostituzione orale del ferro con 200 mg/d di solfato di ferro (per 3-6 mesi) ha senso solo se il ferro può essere assorbito – ecco perché, ad esempio, la sostituzione del ferro deve avvenire per via endovenosa in caso di celiachia. Tuttavia, le compresse di ferro spesso provocano disturbi gastrointestinali.
La sostituzione del ferro per via endovenosa può essere effettuata oggi in modo molto sicuro; i nuovi preparati con carbossimaltosio di ferro (Ferinject®) risp. Il ferro saccarosio (Venofer®) non contiene più destrano e non causa più anafilassi grave. Una chiara indicazione è comunque obbligatoria per la somministrazione di ferro per via endovenosa. Questi includono l’intolleranza documentata alla somministrazione di ferro per via orale, il malassorbimento o la non conformità che non può essere influenzata. Una trombocitosi lieve (fino a 700 G/l) è comune con la carenza di ferro, ma di solito scompare dopo la sostituzione.
Nuovi anticoagulanti orali
Da qualche anno sono disponibili nuovi anticoagulanti orali: l’antagonista diretto della trombina dabigatran (Pradaxa®) e gli antagonisti diretti del fattore Xa rivaroxaban (Xarelto®), apixaban (Eliquis®) e – non disponibile in Svizzera – edoxaban (Lixiana®). Jan-Dirk Studt, MD, medico senior presso la Clinica di Ematologia dell’Ospedale Universitario di Zurigo, ha presentato le possibili applicazioni, nonché i vantaggi e gli svantaggi.
Tutti i nuovi anticoagulanti orali (NOAK) sono approvati in Svizzera per la profilassi embolica nella fibrillazione atriale. Rivaroxaban e apixaban sono approvati anche per la profilassi del tromboembolismo venoso (TEV) negli interventi di chirurgia ortopedica maggiore dell’anca e del ginocchio; rivaroxaban può essere utilizzato anche per la terapia del TEV acuto e per la profilassi secondaria (senza la precedente somministrazione di eparina a basso peso molecolare).
Nei pazienti con fibrillazione atriale, i NOAK sono leggermente migliori degli antagonisti della vitamina K in termini di efficacia e sicurezza, secondo gli studi attuali; nei pazienti con TEV, entrambe le classi sono attualmente considerate approssimativamente equivalenti. La Tabella 3 elenca le indicazioni per la conversione. In linea di principio, i NOAK hanno una sicurezza e un’efficacia equivalenti ai “vecchi” anticoagulanti orali, e un vantaggio significativo è la rapida insorgenza dell’azione.

Il dottor Studt ha informato sulla gestione delle NOAK in situazioni cliniche particolari:
- Procedure e interventi: Per la maggior parte delle procedure, NOAK deve essere interrotto almeno 24 ore prima dell’intervento, per le procedure ad alto rischio (ad esempio le procedure del SNC) 48 ore o più prima. In caso di insufficienza renale, è necessario un tempo di attesa più lungo.
- Annullamento degli effetti: non sono ancora disponibili antidoti specifici, quindi l’emivita relativamente breve delle nuove sostanze è vantaggiosa. Nel caso di dabigatran, la dialisi è nel migliore dei casi consigliabile; nel caso di rivaroxaban e apixaban, la dialisi non è promettente a causa dell’elevato legame proteico.
- Emorragia: In caso di emorragia minore, è appropriato un trattamento sintomatico (terapia locale, eventualmente posticipando la dose successiva). In caso di emorragia moderata o grave, l’assunzione viene interrotta e il paziente viene ricoverato in ospedale. La somministrazione di protamina o vitamina K è inefficace. Se necessario, si può somministrare un concentrato di complesso protrombinico o un concentrato di complesso protrombinico attivato.
- Valvole cardiache meccaniche: Per i pazienti con valvole cardiache protesiche meccaniche, gli antagonisti della vitamina K (VKA) rimangono la terapia standard. I risultati degli studi di confronto tra dabigatran e VKA sono stati sfavorevoli per dabigatran. Attualmente, tutti i NOAK sono controindicati nei pazienti con valvole protesiche meccaniche.
- Gravidanza e allattamento: i dati sull’uso dei NOAK in gravidanza e allattamento sono molto limitati, per cui tutti i NOAK sono attualmente controindicati nelle donne in gravidanza e allattamento. L’eparina a basso peso molecolare rimane la terapia standard.
- Insufficienza renale: nessuno dei NOAK può essere prescritto a pazienti con grave insufficienza renale (clearance della creatinina <30 ml/min.) o con necessità di dialisi. In caso di lieve insufficienza renale, i dosaggi possono essere adattati.
- La quantificazione dell’effetto NOAK è interessante in determinate situazioni cliniche, ad esempio prima di interventi – soprattutto non pianificati -, in caso di traumi, emorragie, insufficienza renale, pazienti molto leggeri o molto pesanti, sospetto di sovradosaggio o insorgenza di trombosi in presenza di una terapia adeguata. Non esiste un intervallo target come per la VKA o l’eparina, e sono disponibili test specifici per la quantificazione di ciascun agente.
Leucemia linfatica cronica
Il Prof. Dr. med. Markus G. Manz, Direttore della Clinica di Ematologia dell’Ospedale Universitario di Zurigo, ha parlato della leucemia linfatica cronica (LLC). Questa più frequente di tutte le leucemie si manifesta soprattutto nelle persone anziane (età mediana alla prima diagnosi 70 anni). A causa dell’invecchiamento della popolazione, l’incidenza della LLC aumenterà in futuro. Il 7% di tutti i donatori di sangue sani di età superiore ai 45 anni presenta una linfocitosi monoclonale a cellule B (MBL) nel sangue periferico, ma quando la MBL è presente, solo l’1-2% circa all’anno progredisce verso la LLC.
Le dinamiche della LLC variano molto da paziente a paziente: la malattia può progredire rapidamente, ma può anche essere asintomatica (riscontro incidentale). I sintomi tipici sono un calo delle prestazioni dovuto all’anemia, infezioni, stigmate emorragiche, sintomi B (febbre, sudorazione notturna, perdita di peso), ingrossamento dei linfonodi e ingrossamento del fegato e/o della milza. La diagnosi viene fatta dal sangue periferico (linfociti monoclonali B >5000/µl); una puntura del midollo osseo di solito non è necessaria, ma può essere utile in singoli casi, soprattutto prima di iniziare la terapia. Il chiarimento citogenetico deve sempre essere effettuato per diagnosticare le aberrazioni cromosomiche che sono prognosticamente sfavorevoli.
La CLL è classificata secondo Binet (Tab. 4) o Rai, il che è importante per stimare la prognosi. Fino al 1974, solo il 5% dei pazienti affetti da CLL sopravviveva alla diagnosi per più di cinque anni – questa situazione è cambiata in modo significativo grazie alla disponibilità di diverse opzioni terapeutiche. Tuttavia, la LLC non può essere curata con terapie sistemiche. Nella LLC asintomatica, il paziente non viene trattato perché attualmente non ci sono prove che la terapia nella fase asintomatica sia benefica. Esiste un’indicazione generale per la terapia nello stadio Binet C o in presenza di sintomi preoccupanti come gonfiore dei linfonodi, del fegato e della milza, sintomi B, anemia, ecc.

La terapia standard oggi è la chemioterapia con fludarabina, ciclofosfamide e rituximab (FCR). Tuttavia, questo schema viene deviato a seconda dell’età e delle condizioni generali del paziente, delle comorbidità (soprattutto l’insufficienza renale) e delle aberrazioni cromosomiche. La combinazione di bendamustina e rituximab ha dimostrato di essere meno tossica, ma anche leggermente meno efficace del regime FCR. Pertanto, è più probabile che questa combinazione venga utilizzata nei pazienti anziani di età superiore ai 65 anni. Per i pazienti con CLL refrattaria o recidivata, è possibile anche il trapianto di cellule staminali allogeniche.
Nel luglio 2014, l’Agenzia Europea dei Medicinali (EMA) ha raccomandato gli inibitori della tirosin-chinasi ibrutinib e idelalisib (Zydelig®) e l’anticorpo monoclonale anti-CD20 obinutuzumab (Gazyvaro®) per l’approvazione per l’indicazione CLL. Ibrutinib può prolungare significativamente la sopravvivenza, ma si sviluppa anche una resistenza.
Il relatore ha richiamato l’attenzione sul fatto che i costi elevati dei nuovi farmaci per il trattamento delle leucemie croniche rappresentano una sfida per la società: “Il trattamento dell’ipertensione con l’enalapril costa circa 500 franchi all’anno, il trattamento della CML con l’imatinib 40.000 franchi. Con l’avanzare dell’età e l’aumento delle leucemie croniche, si pone la questione di chi sosterrà i costi delle costose terapie”.
Fonte: Medidays, 3 settembre 2014, Ospedale Universitario di Zurigo
PRATICA GP 2014; 9(11): 52-56











