Al Congresso europeo sul cancro di Vienna, sono state presentate nuove scoperte sulla possibile eziologia del linfoma di Hodgkin. Inoltre, è stato presentato un confronto europeo completo delle cure oncologiche. Nel campo del melanoma metastatico, sono state date risposte a due domande: In che misura i pazienti con fattori prognostici sfavorevoli beneficiano dell’immunoterapia combinata? E come devono essere interpretati gli attuali dati di sopravvivenza dello studio COMBI-v?
Per comprendere meglio l’eziologia del linfoma di Hodgkin (HL) nei bambini e nei giovani adulti, un team inglese ha studiato 621 casi di registro di HL in pazienti di età compresa tra 0 e 24 anni (anni 1968-2003). 247 di questi erano del sottotipo nodulare sclerosante, 105 erano del tipo misto, 58 erano HL ricchi di linfociti (tipo con esito migliore), 68 rientravano nella categoria “altro” e 143 nella categoria “non ulteriormente specificato”.
Complessivamente, i pazienti HL di sesso maschile erano più numerosi. Questo vale anche per il sottotipo HL nodulare sclerosante, con 130 maschi contro 117 femmine. È interessante notare, tuttavia, che c’è stato un cambiamento legato all’età nel rapporto tra i sessi: nel gruppo dei 20-24enni, predominano le donne (72 contro 55 persone). Tra i giovani uomini, i tassi specifici per età sono stati di 14,26 (per milione di persone/anno), mentre la cifra corrispondente per le giovani donne è stata di 18,79.
Oltre al genere, anche le privazioni hanno avuto un ruolo. I ricercatori hanno definito questi fattori attraverso quattro fattori: Famiglie con un’alta densità di persone, disoccupazione, assenza di case di proprietà, famiglie senza auto. La deprivazione è stata notevolmente associata a tassi di incidenza più bassi del sottotipo nodulare sclerosante. Con ogni aumento dell’1% del fattore “densità di persone nel nucleo familiare”, si è registrata una riduzione significativa del rischio del 12% (RR 0,88; 95% CI 0,82-0,94). Una tendenza inversa è stata riscontrata nei tipi che non sono stati ulteriormente specificati. Qui il RR era di 1,17. Per gli altri sottotipi, la deprivazione non ha avuto alcun effetto sull’incidenza.
Come si possono spiegare i risultati?
I dati sono rivelatori sotto diversi aspetti. Da un lato, l’inversione del rapporto tra i sessi potrebbe essere spiegata da fattori ormonali che svolgono un ruolo durante la pubertà femminile, compresi gli estrogeni. È possibile che l’eziologia del sottotipo nodulare sclerosante sia anche legata ai cambiamenti ormonali femminili, oltre ad altri fattori. Questo potrebbe essere il motivo per cui l’incidenza nelle donne aumenta dopo la pubertà. Molti geni sono regolati direttamente (ma anche indirettamente) dagli ormoni sessuali.
La minore incidenza di questo sottotipo nelle famiglie affollate può anche indicare un fattore eziologico ambientale. Quando le persone vivono vicine tra loro, sono presenti più agenti infettivi. Le persone che sono esposte a diversi agenti patogeni in giovane età e che subiscono infezioni multiple possono sviluppare un sistema immunitario più forte, in grado di rispondere meglio alle infezioni future e alle cellule cancerose in età adulta. Questo è un vantaggio nell’area HL. Gli individui con suscettibilità genetica alla HL che vivono in condizioni di grande scala durante l’infanzia e sperimentano meno infezioni, secondo questa teoria, sarebbero più suscettibili al sottotipo in seguito, perché il loro sistema immunitario è meno sviluppato. Secondo gli autori, l’inversione di tendenza nei tipi non specificati è più difficile da spiegare, ma potrebbe anche essere una coincidenza.
Assistenza ai pazienti oncologici in Europa
EUROCARE, il più grande studio di registro tumori basato sulla popolazione in Europa, è in corso dalla fine degli anni Novanta. Al congresso sono stati presentati nuovi risultati con implicazioni transnazionali. I dati di oltre dieci milioni di pazienti affetti da cancro di età superiore ai 15 anni, provenienti da 29 Paesi europei e da un totale di 107 registri, sono stati valutati per quanto riguarda la sopravvivenza a 5 anni, tra le altre cose. Questo dato è stato aggiustato per i decessi dovuti a cause diverse dal cancro e per le differenze di età. Sono state incluse le diagnosi fino al 2007.
In generale, i tassi di sopravvivenza sono bassi nell’Europa orientale, ma elevati nell’Europa settentrionale e centrale. Sono emerse altre differenze geografiche, che sono riassunte nella tabella 1 . Le differenze più drammatiche sono state riscontrate nella leucemia mieloide e linfocitica cronica (CML/CLL), nel linfoma follicolare e diffuso a grandi cellule B e nel mieloma multiplo. La CML ha mostrato una sopravvivenza media a 5 anni del 53%, ma un’enorme variazione nei diversi gruppi di età. Tra tutti i tumori ematologici, le differenze regionali sono state maggiori per il CML: 33,4% nell’Europa orientale contro il 51-58% nel resto d’Europa. Le differenze geografiche sono state riscontrate anche per i tumori con prognosi sfavorevole, come quelli alle ovaie, ai polmoni, al pancreas, all’esofago e allo stomaco, i tumori al cervello e il linfoma di Hodgkin – ma nel complesso sono state un po’ meno pronunciate.
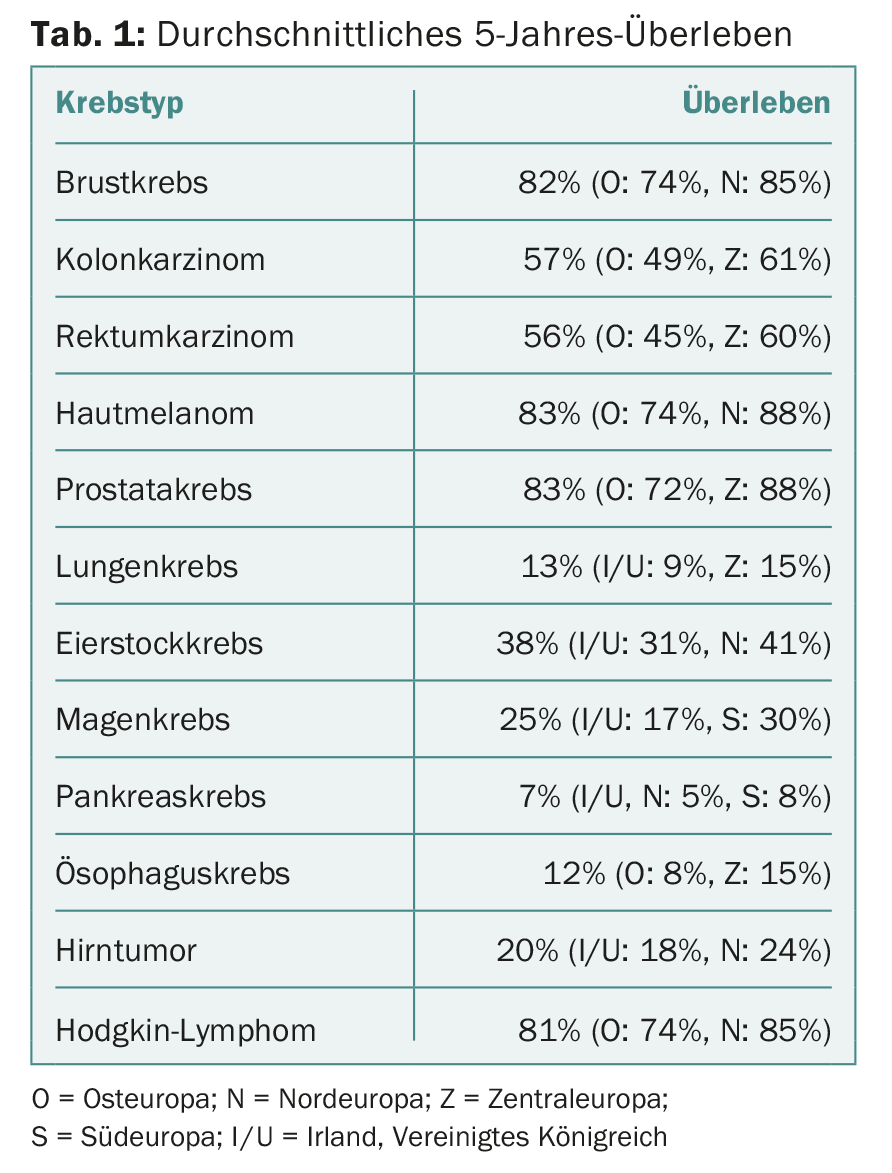
I tassi di sopravvivenza a 5 anni sono aumentati in tutta Europa durante il periodo di osservazione, soprattutto nell’Europa orientale. In particolare, i tassi sono aumentati per i tumori della mammella, del collo dell’utero, del fegato, delle vie biliari e della testa/collo (escluso il tumore della laringe), ad esempio. L’aumento maggiore tra il 1999-2001 e il 2005-2007 è stato registrato nel CML (32-54%), nella prostata (73-82%) e nel cancro rettale (52-58%). C’è stato anche un leggero aumento della sopravvivenza per i melanomi della pelle. I tassi sono rimasti stabili per i tumori dell’esofago, del pancreas, del pene e del testicolo.
I tassi di sopravvivenza combinati a 5 anni di tutti i tumori sono stati correlati positivamente con il prodotto interno lordo e la spesa nazionale totale per la salute. Gli Stati con aumenti recenti più elevati di entrambi i parametri hanno avuto aumenti corrispondenti più elevati dei tassi di sopravvivenza. Tuttavia, questo non è sempre vero: Paesi come il Regno Unito e la Danimarca avrebbero dovuto raggiungere tassi migliori, data la loro elevata spesa sanitaria.
Le variazioni geografiche possono essere spiegate, tra l’altro, dai diversi sforzi diagnostici o dalla qualità e dall’esistenza di programmi di screening nazionali (cancro alla prostata, al seno, al colon-retto). Oltre alla diagnosi precoce, anche l’accesso al trattamento multidisciplinare, la buona qualità dell’assistenza, lo stile di vita e lo stato di salute e socioeconomico della rispettiva popolazione giocano un ruolo importante nella sopravvivenza. Resta da vedere se i risultati porteranno a sforzi politici concreti.
Le terapie combinate per il melanoma continuano a convincere
CheckMate 067: i checkpoint CTLA-4 e PD-1 sono utilizzati dalle cellule tumorali per superare la risposta immunitaria specifica del cancro dell’organismo. Gli inibitori possono essere usati per bloccare i checkpoint, il che attiva il sistema immunitario o porta ad un aumento dell’attività delle cellule T. Il CheckMate 067 è uno studio di fase III che ha confrontato l’inibitore del checkpoint PD-1 nivolumab da solo o in combinazione con l’inibitore del checkpoint CTLA-4 ipilimumab con la monoterapia con ipilimumab. La popolazione dello studio era composta da 945 pazienti precedentemente non trattati con melanoma avanzato. La combinazione è stata significativamente superiore alla monoterapia con ipilumab in termini di sopravvivenza libera da progressione (PFS) e di tasso di risposta obiettiva. I risultati di un’analisi di sottogruppo prespecificata sono stati presentati al congresso ECCO/ESMO: La combinazione rimane superiore indipendentemente dall’età, dallo stato genetico o dalla diffusione del tumore? Di particolare interesse è stata la situazione dei pazienti con fattori prognostici sfavorevoli. I sottogruppi differivano per quanto riguarda le metastasi, i livelli sierici di lattato deidrogenasi (LDH), lo stato di mutazione BRAF e l’età.
I parametri citati erano equamente distribuiti nei tre bracci di trattamento. La PFS è stata di 11,5 mesi (combinazione) vs. 2,9 mesi (monoterapia con ipilimumab; riduzione significativa del rischio del 58%) vs. 6,9 mesi (monoterapia con nivolumab; riduzione significativa del rischio del 43%).
I risultati per i sottogruppi citati sono mostrati nella tabella 2. Nel complesso, la PFS è stata sempre più lunga con la combinazione. Non sono state riscontrate differenze nel profilo di sicurezza (rispetto alla popolazione generale).
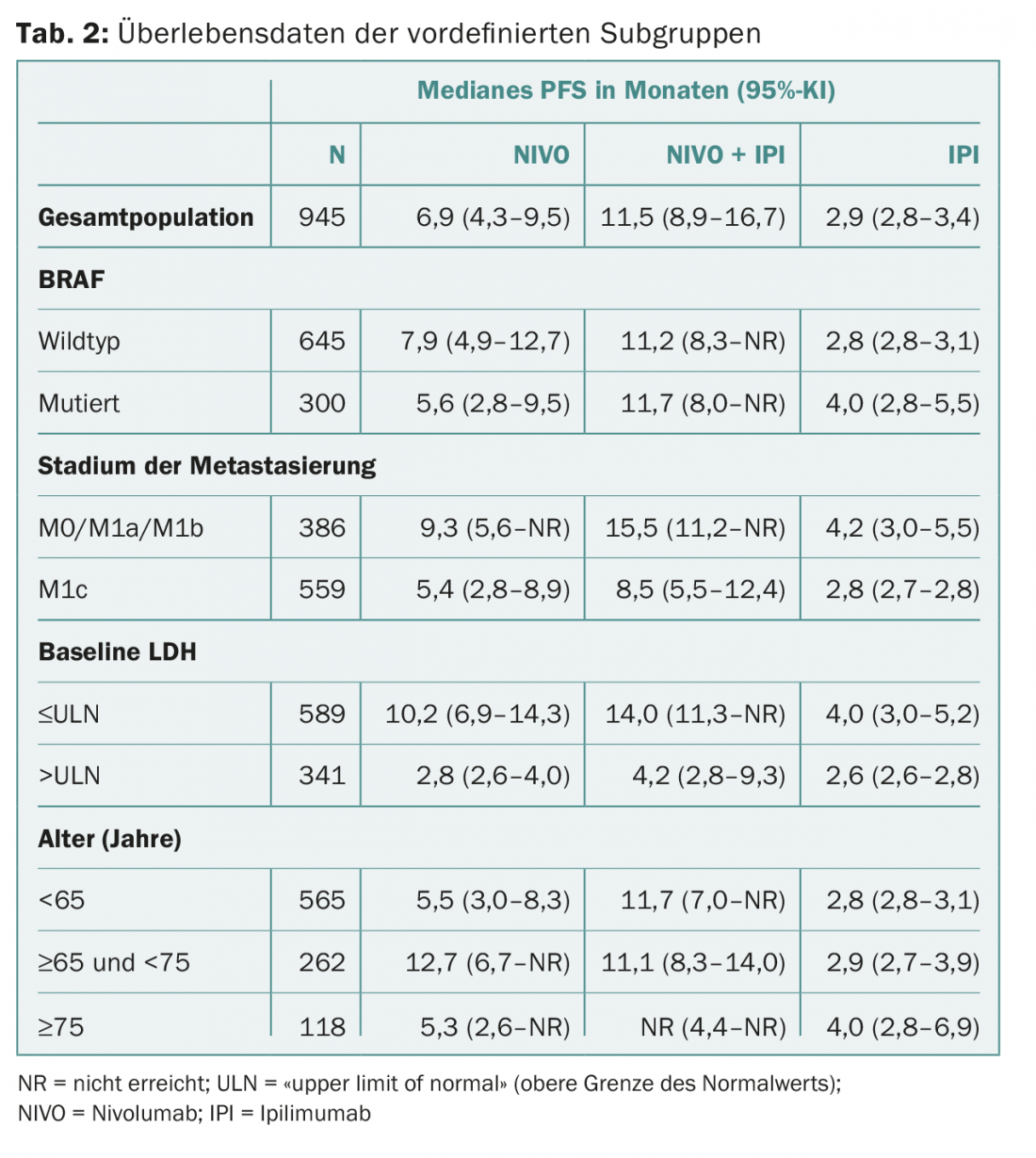
Gli autori concludono che la combinazione di nivolumab e ipilimumab è significativamente superiore alle monoterapie anche nei pazienti con fattori prognostici sfavorevoli ed è controllabile in termini di profilo di sicurezza. In pratica, questo potrebbe portare a un processo decisionale più rapido e più semplice per quanto riguarda l’uso della terapia combinata in futuro. Soprattutto perché i ricercatori hanno studiato deliberatamente i sottogruppi più rilevanti per il medico. Sapere se alcuni pazienti non traggono beneficio dalla combinazione è importante, perché nonostante l’euforia, non bisogna dimenticare che le terapie possono essere accompagnate da un numero relativamente elevato di effetti collaterali.
COMBI-v: in questo studio di fase III, la combinazione dell’inibitore della chinasi BRAF dabrafenib e dell’inibitore MEK trametinib (braccio 1) con l’inibitore BRAF vemurafenib (braccio 2) a confronto. La popolazione dello studio era composta da 704 pazienti non trattati in precedenza con melanoma metastatico e non resecabile in stadio avanzato IIIC/IV con mutazione BRAF V600E/K. Secondo i risultati pubblicati nel New England Journal of Medicine nel gennaio 2015 [1], il tasso di sopravvivenza globale, l’endpoint primario, era del 72% nel braccio 1 dopo 12 mesi e del 65% nel braccio 2 (HR 0,69; 95% CI 0,53-0,89; p=0,005). I tassi di effetti collaterali sono stati comparabili in entrambi i bracci. A causa dei risultati convincenti, lo studio è stato interrotto nel luglio 2014. Tuttavia, poiché i pazienti avevano la possibilità di rimanere in terapia, i ricercatori hanno avuto l’opportunità di un follow-up prolungato. Al congresso è stato presentato un aggiornamento che includeva i dati fino al 13 marzo 2015:
- La sopravvivenza globale mediana è stata di 25,6 contro 18 mesi, che corrisponde a una riduzione significativa del rischio di mortalità del 34%.
- La PFS mediana è stata di 12,6 vs. 7,3 mesi, corrispondente a una riduzione significativa del rischio di morte o progressione del 39%.
- Dopo due anni, il 51 contro il 38% dei pazienti era vivo.
- Non ci sono stati nuovi effetti collaterali sorprendenti nel follow-up esteso.
- Un’altra sottoanalisi presentata al congresso ha anche dimostrato che la combinazione ha migliorato significativamente la qualità della vita.
L’aggiornamento ha quindi confermato i risultati convincenti dell’analisi pubblicata ben undici mesi prima. L’UE ha quindi approvato la combinazione di dabrafenib e trametinib per questa indicazione all’inizio di settembre 2015.
Fonte: Congresso europeo sul cancro(18° ECCO, 40° ESMO), 25-29 settembre 2015, Vienna.
Letteratura:
- Robert C, et al: Miglioramento della sopravvivenza globale nel melanoma con la combinazione di dabrafenib e trametinib. N Engl J Med 2015 Jan 1; 372(1): 30-39.
InFo ONCOLOGIA & EMATOLOGIA 2015; 3(11-12): 32-34