L’incidenza del carcinoma endometriale è in aumento. Nelle donne in postmenopausa, di solito si nota presto attraverso il sanguinamento vaginale. Oltre il 70% dei pazienti si trova nello stadio FIGO I al momento della diagnosi. La terapia chirurgica consiste nell’isterectomia, nell’annessiectomia bilaterale e, a seconda del profilo di rischio, nella linfonodectomia sentinella e/o pelvica e para-aortica. La terapia adiuvante dipende dalla stadiazione e dal rischio di recidiva.
Il carcinoma endometriale è il tumore ginecologico maligno più comune e la sesta malattia maligna più diffusa a livello mondiale. L’incidenza annuale nell’Europa occidentale è in aumento e attualmente è di 10-25:100.000 donne [1]. La malattia viene solitamente diagnosticata nelle fasi iniziali limitate all’utero e nelle donne in postmenopausa a causa di un sanguinamento vaginale. In premenopausa, la malattia può manifestarsi attraverso cambiamenti nell’intensità e nella frequenza delle mestruazioni.
Nuova classificazione biologica molecolare?
Il carcinoma endometriale è classicamente diviso in due categorie: Il tipo I, che è più comune (80%) e ha origine da un’iperplasia endometriale atipica, corrisponde istologicamente agli adenocarcinomi endometriali. I carcinomi di tipo II sono più aggressivi e comprendono i carcinomi a cellule chiare, i carcinomi sierosi e i carcinosarcomi. Tuttavia, questa classificazione, basata solo sull’istologia, viene ora messa in discussione. Attualmente è in discussione una nuova classificazione biologica molecolare, che potrebbe essere più rilevante dal punto di vista prognostico e terapeutico. L’età media alla diagnosi è stata considerata più alta per i carcinomi di tipo II fino ad oggi. Tuttavia, uno studio prospettico su oltre un milione di donne norvegesi, che comprendeva 992 tumori di tipo II, non ha mostrato alcuna differenza (età media in entrambi i gruppi: 65 anni) [2].
Il carcinoma endometriale di tipo I è estrogeno-dipendente. Inoltre, l’uso a lungo termine di estrogeni senza protezione progestinica, la sindrome metabolica con obesità, il menarca precoce, la menopausa tardiva, il trattamento con tamoxifene e gli alti livelli di estrogeni (ad esempio, nella sindrome dell’ovaio policistico) sono considerati fattori di rischio per i carcinomi di tipo I. Sono inclusi anche l’ipertensione arteriosa e il diabete mellito. Inoltre, il cancro endometriale si verifica nel 40-60 delle pazienti con sindrome di Lynch e nel 5-10% delle pazienti con sindrome di Cowden.
La contraccezione ormonale, invece, riduce il rischio di cancro endometriale di circa il 50%. Anche il fumo sembra essere un fattore protettivo. Il suo effetto protettivo può essere spiegato dalla stimolazione del metabolismo epatico degli estrogeni. Altri fattori protettivi sono un’età elevata all’ultimo parto e il consumo di caffè e tè.
Stadiazione e valutazione del rischio
Dal 2009, è in vigore la versione aggiornata della stadiazione secondo la FIGO [3] (Tab. 1) . La sopravvivenza a 5 anni per lo stadio IA è ~90%, per lo stadio IB 78% e scende al 57% per lo stadio IIIC1. al 49% nel caso di coinvolgimento dei linfonodi paraaortici (IIIC2) [4].
Nello stadio I, vengono definiti tre gruppi di rischio in base allo stadio istologico di maturità (G1-3) e all’istologia (tipo endometrioide vs. tipo non endometrioide) (Tab. 2). Un’analisi molecolare completa di 373 carcinomi endometriali pubblicata nel 2013 ha identificato quattro sottotipi prognosticamente diversi. Questo potrebbe portare a una nuova classificazione in futuro, che potrebbe cambiare la terapia del carcinoma endometriale [5].

Diagnostica
Non esistono misure di screening basate sull’evidenza per quanto riguarda il carcinoma endometriale. La malattia viene diagnosticata più spesso nelle donne in postmenopausa a causa di un sanguinamento vaginale. In premenopausa, può manifestarsi attraverso cambiamenti nell’intensità e nella frequenza delle mestruazioni. Spesso la diagnosi può essere già sospettata con l’ecografia vaginale e poi stabilita con la cosiddetta pipelle de cornier (biopsia endometriale). È importante stabilire se la fonte dell’emorragia è davvero il cavum uteri e non la cervice, la vagina, il retto o addirittura la vescica. Se la pipetta non è possibile o la biopsia non è rappresentativa, la diagnosi viene fatta con isteroscopia e curettage. Se si sospetta uno stadio avanzato, si può eseguire una TAC addominale per la stadiazione preoperatoria.
Chirurgia
Desiderio di avere figli: in caso di desiderio urgente di avere figli e di carcinoma endometrioide ben differenziato in stadio T1a, si può prendere in considerazione una terapia di conservazione della fertilità, se è stato accertato isteroscopicamente che non vi è un carcinoma residuo nell’utero. L’infiltrazione miometriale e le metastasi ovariche devono essere escluse mediante ecografia transvaginale, risonanza magnetica e laparoscopia. I pazienti devono essere informati della maggiore probabilità di recidiva, della possibilità di progressione e della necessità di un attento follow-up. L’applicazione orale continua di progestinici con medrossiprogesterone acetato 200 mg/d è la terapia di scelta. Ogni tre mesi viene effettuato un controllo con ecografia transvaginale, isteroscopia e biopsia endometriale. La gravidanza deve essere tentata solo dopo una ristadiazione non evidente, se necessario con la riproduzione assistita, al fine di mantenere il tempo di gravidanza il più breve possibile. Dopo aver realizzato il desiderio di un figlio, è necessaria una terapia chirurgica adeguata allo stadio, a causa dell’alto rischio di recidiva .
Stadiazione laparoscopica: Tranne nei casi di desiderio urgente di avere un figlio e di situazioni ad alto rischio con operabilità limitata, la terapia chirurgica viene eseguita principalmente. La stadiazione chirurgica sistematica consiste nell’isterectomia, nell’annessiectomia bilaterale e, a seconda del profilo di rischio, nella linfonodectomia sentinella e/o pelvica e para-aortica. In rari casi, è indicata anche un’omentectomia. Tradizionalmente, la stadiazione del carcinoma endometriale viene eseguita in laparotomia. Negli ultimi anni, tuttavia, diversi studi hanno confrontato la stadiazione tramite laparotomia con quella tramite laparoscopia [6]. Poiché gli studi randomizzati e le meta-analisi hanno dimostrato i chiari vantaggi della procedura laparoscopica rispetto alla classica chirurgia aperta (meno complicazioni e degenza più breve), con la stessa frequenza di recidiva e lo stesso tasso di sopravvivenza a 5 anni, l’intervento chirurgico dovrebbe essere eseguito in laparoscopia come standard al giorno d’oggi. (Fig. 1). Per quanto riguarda la chirurgia robot-assistita, ad oggi non sono stati pubblicati studi che dimostrino un vantaggio rispetto alla laparoscopia nel trattamento chirurgico del carcinoma endometriale.
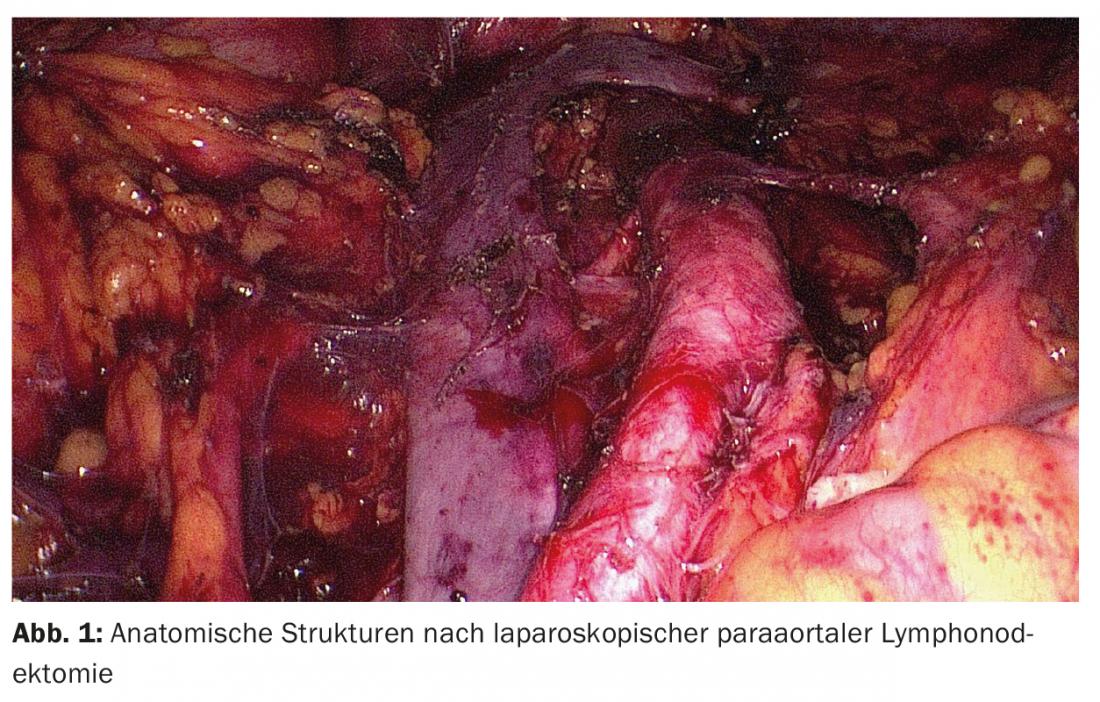
Linfonodectomia: una questione centrale controversa è quando deve essere eseguita la linfonodectomia e in quale misura. Due studi multicentrici randomizzati, che purtroppo presentano gravi difetti formali, non sono riusciti a dimostrare un beneficio in termini di sopravvivenza per la sola linfonodectomia pelvica [7,8]. I dati sull’importanza della linfonodectomia pelvica e para-aortica sistematica sono scarsi; non esistono studi prospettici randomizzati. Uno studio di coorte retrospettivo ha dimostrato che i pazienti a rischio intermedio o alto di recidiva sottoposti a linfonodectomia pelvica e para-aortica avevano un’aspettativa di vita più lunga rispetto a quelli sottoposti alla sola linfonodectomia pelvica. Questo vantaggio non è stato riscontrato a basso rischio [9].
Sebbene l’effetto terapeutico diretto della linfonodectomia rimanga controverso, è generalmente accettato che venga utilizzato per valutare la prognosi e decidere la terapia adiuvante. Se i linfonodi sono poco evidenti, si può rinunciare alla terapia adiuvante, evitando così una tossicità inutile. Poiché la linfonodectomia aumenta la morbilità sia operativa che postoperatoria, dovrebbe essere eseguita solo se c’è un’alta probabilità di linfonodi cancerosi. Uno studio prospettico di coorte mostra che nelle pazienti a rischio intermedio e alto di recidiva, i linfonodi pelvici erano positivi nel 17% e i linfonodi para-aortici nel 12%. Il 55% dei pazienti con linfonodi pelvici positivi aveva anche linfonodi para-aortici positivi. Inoltre, il 3% dei pazienti con linfonodi pelvici negativi aveva linfonodi para-aortici positivi.
È interessante notare che la maggior parte dei pazienti con linfonodi paraaortici positivi mostrava un coinvolgimento tra i vasi renali e l’arteria mesenterica inferiore (IMA) [10]. Pertanto, per il rischio intermedio e superiore di recidiva, si raccomanda generalmente la linfonodectomia pelvica e para-aortica. Se il rischio è basso, invece, la probabilità di linfonodi cancerosi rimane così bassa (3-5%) che non si esegue la linfonodectomia.
Tuttavia, come già detto, la linfonodectomia è associata a morbilità intra e post-operatoria. Il rischio di linfedema è riportato tra il 5 e il 38%, a seconda dello studio. Per aggirare questo problema, il concetto di linfonodo sentinella viene attualmente valutato anche nel carcinoma endometriale in diversi studi in corso. Una meta-analisi di 26 studi con 1101 interventi al linfonodo sentinella ha mostrato una sensibilità del 93% per il rilevamento di metastasi linfonodali [11]. La tecnica ICG sembra dare i migliori tassi di rilevamento (Fig. 2) e potrebbe affermarsi in futuro [12]. Ciò consentirebbe di catturare i linfonodi raramente colpiti da carcinoma a rischio basso e intermedio di recidiva.

Stadi superiori: se lo stroma cervicale è interessato (FIGO II), si può presumere che il rischio di coinvolgimento dei parametri sia simile a quello del carcinoma cervicale, ma questo non è confermato dai dati attuali. Sembra che l’invasione linfovascolare sia un indicatore migliore di diffusione parametrica rispetto all’infestazione stromale cervicale. Pertanto, l’isterectomia radicale non è necessariamente raccomandata per i carcinomi endometriali FIGO II. Se il tumore si è diffuso alla vagina e/o ai parametri (FIGO IIIB), si esegue un’isterectomia radicale estesa, con resezione dei parametri e, se necessario, con colpectomia. Negli stadi incurabili e avanzati, l’intervento chirurgico (isterectomia per la profilassi delle emorragie, debulking di grandi masse tumorali) può essere preso in considerazione in un contesto palliativo.
Trattamenti adiuvanti
Radioterapia: l’ultima meta-analisi Cochrane ha dimostrato che la radioterapia percutanea post-operatoria per il carcinoma endometriale FIGO di stadio I a basso rischio non aggiunge benefici [13]. Anche se la radioterapia esterna, cioè percutanea, migliora il controllo locale del tumore nel rischio intermedio e alto, non può prolungare la sopravvivenza. Grazie alla minore tossicità con la stessa efficacia, la brachiterapia vaginale post-operatoria è preferibile alla radioterapia esterna per il trattamento del carcinoma endometriale precoce con rischio da intermedio ad alto.
Chemioterapia adiuvante, in combinazione con la radioterapia percutanea: solo negli stadi tumorali avanzati (FIGO III e pazienti ben trattati chirurgicamente con malattia FIGO IV) è indicata la chemioterapia adiuvante con doxorubicina e cisplatino, che migliora la sopravvivenza del 25% [14]. Lo studio PORTEC-3, che sarà completato solo tra qualche anno, sta testando in modo casuale la radioterapia percutanea rispetto alla radiochemioterapia nei pazienti di stadio IB con una costellazione ad alto rischio.
Recidive e terapie palliative
Le ricadute di solito si verificano entro tre anni. Lo spettro è ampio e va dalle recidive vaginali isolate, che possono essere trattate in modo curativo con terapie locali, alle manifestazioni disseminate. I tumori ben differenziati, le recidive tardive e le metastasi polmonari possono essere trattati meglio, mentre le recidive dopo la chemioterapia adiuvante sono prognosticamente sfavorevoli. Ci sono solo pochi dati per questa situazione rispetto ad altri tumori, ad esempio per temsirolimus o bevacizumab. Le terapie ormonali palliative sono un’alternativa frequentemente utilizzata e ben tollerata nei pazienti oligosintomatici con tumori ben differenziati e positivi ai recettori ormonali. I tassi di risposta raggiungono il 30% e non di rado sono di lunga durata. Vengono utilizzati il medrossiprogesterone acetato (=Farlutal), il tamoxifene, leggermente meno efficace ma chiaramente migliore degli inibitori dell’aromatasi letrozolo o anastrozolo.
Sintesi e prospettive
Il carcinoma endometriale viene spesso diagnosticato in una fase iniziale. Spesso la diagnosi può essere fatta senza complicazioni. È più difficile adattare la radicalità della terapia al profilo di rischio del tumore e alle risorse del paziente.
In futuro, insieme alla differenziazione molecolare, alla chirurgia minimamente invasiva e alla linfonodectomia sentinella, la chirurgia e le terapie adiuvanti potranno essere adattate nel modo più ideale possibile.
Letteratura:
- Weiderpass E, et al: Tendenze della mortalità per cancro del corpo dell’utero negli Stati membri dell’Unione Europea. Eur J Cancer 2014;50: 1675-1684.
- Bjørge T, et. al.: La dimensione corporea in relazione al cancro del corpo uterino in 1 milione di donne norvegesi. Int J Cancer 2007; 120: 378.
- Pecorelli S: Stadiazione FIGO rivista per il carcinoma della vulva, della cervice e dell’endometrio. Int J Gynaecol Obstet. 2009;105: 103-104.
- Lewin SN, et al: Prestazioni comparative del sistema di stadiazione 2009 della Federazione internazionale di ginecologia e ostetricia per il cancro del corpo dell’utero. Obstet Gynecol. 2010; 116: 1141-1149.
- Cancer Genome Atlas Research N, Kandoth C, et al: Caratterizzazione genomica integrata del carcinoma endometriale. Natura 2013;497: 67-73.
- Santi A, et al: Laparoscopia o laparotomia? Un confronto tra 240 pazienti con cancro endometriale in fase iniziale. Chirurgia Endosc. 2010;24(4): 939-43
- Benedetti Panici P, et al: Linfoadenectomia pelvica sistematica vs. nessuna linfadenectomia nel carcinoma endometriale in fase iniziale: studio clinico randomizzato. J Natl Cancer Inst. 2008;100: 1707-1716.
- Gruppo di studio ASTEC, Kitchener H, et al: Efficacia della linfoadenectomia pelvica sistematica nel carcinoma endometriale (studio MRC ASTEC): uno studio randomizzato. Lancet 2009;373: 125-136.
- Todo Y, et al: Effetto sulla sopravvivenza della linfoadenectomia para-aortica nel carcinoma endometriale (studio SEPAL): un’analisi retrospettiva di coorte. Lancet. 2010;375: 1165-1172.
- Kumar S, et al: Valutazione prospettica della prevalenza di metastasi linfonodali pelviche, paraaortiche e paraaortiche alte nel carcinoma endometriale. Gynecol Oncol. 2014; 132(1): 38-43.
- Kang S, et.al.: Biopsia del linfonodo sentinella nel cancro dell’endometrio: meta-analisi di 26 studi. Gynecol Oncol 2011; 123: 522.
- Papadia A, et. al: Mappatura laparoscopica del linfonodo sentinella al verde di indocianina nel cancro dell’endometrio. Ann Surg Oncol. 2016; 2206-2211
- Kong A, et al: Radioterapia adiuvante per il cancro endometriale di stadio I. Cochrane Database Syst Rev. 2012;4.
- Galaal K, et al.: Chemioterapia adiuvante per il cancro endometriale avanzato. Cochrane Database Syst Rev. 2014;5.
PRATICA GP 2017; 12(2): 19-24