L’esecuzione della citometria a flusso da campioni di CSF di alta qualità ha permesso di identificare le firme specifiche delle cellule immunitarie in diverse malattie neurologiche. In questo modo, si potrebbe migliorare la differenziazione di varie malattie neurologiche, ad esempio le neuropatie immunitarie e le malattie autoimmuni del sistema nervoso centrale, e acquisire conoscenze sulle possibili popolazioni cellulari coinvolte nelle diverse patologie.
Nel Dipartimento di Neurologia con l’Istituto di Neurologia Traslazionale dell’Ospedale Universitario di Münster, è stata eseguita la citometria a flusso da campioni di CSF di alta qualità su una scala mai raggiunta prima ed è stato creato un database unico e completo che ha permesso di identificare firme di cellule immunitarie specifiche in diverse malattie neurologiche. Questo ha migliorato la differenziazione di varie malattie neurologiche, ad esempio le neuropatie immunitarie e le malattie autoimmuni del sistema nervoso centrale, e ha fornito una visione delle possibili popolazioni cellulari coinvolte nelle diverse patologie. Il seguente articolo offre una visione del lavoro scientifico basato sulla citometria a flusso del liquido cerebrospinale e fornisce una breve panoramica di alcune composizioni di cellule immunitarie in importanti malattie neurologiche.
Il liquor come finestra diagnostica sul sistema nervoso centrale
Il liquido cerebrospinale (in breve CSF) è un liquido chiaro che circola intorno al sistema nervoso centrale (SNC) e circonda il cervello e il midollo spinale. In questo contesto, il liquor non solo fornisce una protezione meccanica, ma probabilmente rifornisce anche le cellule del sistema nervoso centrale di sostanze nutritive [1], funge da mezzo di trasporto per le cellule immunitarie [2] e media il trasporto di antigeni tra il sistema nervoso centrale e i compartimenti periferici, come il sangue [3]. La frazione non cellulare del liquor viene prodotta come ultrafiltrato dal siero nel plesso della coroide nei ventricoli cerebrali, dove i soluti passano dal siero al liquor a seconda delle loro dimensioni. Il drenaggio del liquor (riassorbimento nella circolazione) avviene attraverso i sistemi venoso e linfatico [3,4]. Le cellule del liquor sono leucociti, chiamati leucociti del liquor o cellule del liquor. La concentrazione di cellule nel liquor è circa mille volte inferiore a quella del sangue periferico. In condizioni fisiologiche, il CSF contiene ≤4 leucociti CSF/µl (o <5/liucociti CSF/µl). Il profilo cellulare nel liquor è linfocitario e monocitico ed è caratterizzato da una dominanza di linfociti T CD4+. Rispetto al sangue periferico, le cellule della memoria e i linfociti T regolatori e le cellule natural killer (NK) sono aumentati nel liquor, mentre i linfociti B sono ridotti e le plasmacellule non sono presenti in condizioni fisiologiche [5,6]. Ciò suggerisce che la composizione cellulare del liquor forma un proprio compartimento, che è soggetto a una regolazione e a un controllo rigorosi e deve essere regolato indipendentemente dal sangue periferico. Poiché il liquor circonda il sistema nervoso centrale, è il compartimento più vicino al SNC che è accessibile nella pratica clinica per l’analisi diagnostica mediante puntura lombare. È noto che il liquor può fornire informazioni sui meccanismi cellulari delle malattie del SNC. L’immunofenotipizzazione delle cellule del liquor – come quella che presentiamo in questo articolo – può aiutare ad acquisire nuove conoscenze sulla fisiopatologia, a rendere più precise le analisi diagnostiche e a valutare meglio le prognosi individuali. In futuro, questo potrebbe aiutare a sviluppare nuovi approcci terapeutici per varie malattie del sistema nervoso [7,8].
Citometria a flusso delle cellule del liquor su una scala senza precedenti
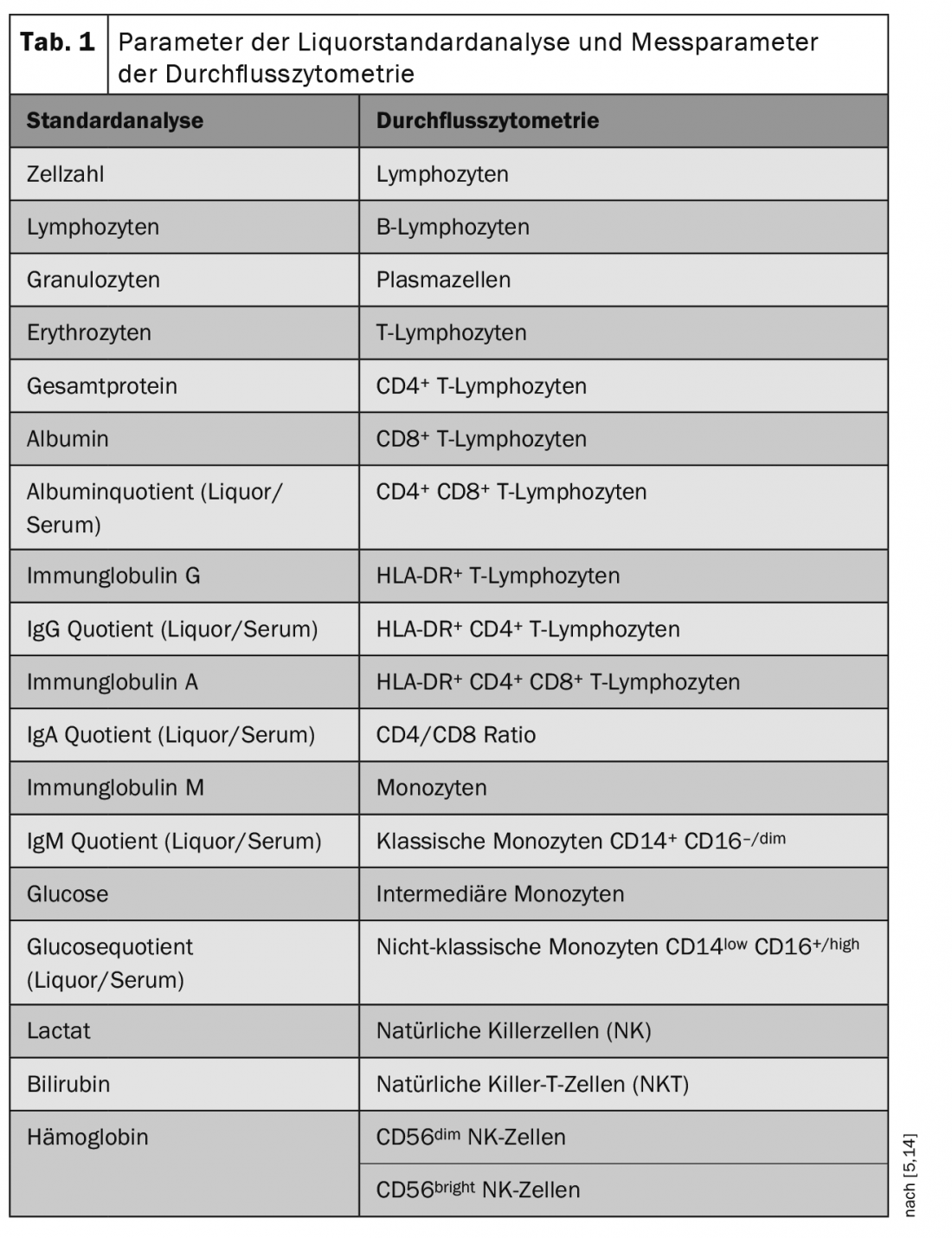
La citometria a flusso è un metodo per il rilevamento quantitativo e la caratterizzazione molecolare delle cellule. Orientata alle proprietà cellulari, questa procedura consente la classificazione in diverse classi cellulari (ad esempio, linfociti, monociti). Nella citometria a flusso, le cellule di una sospensione vengono registrate in un cosiddetto citometro a flusso. Ogni singola cellula passa attraverso un raggio laser, dal cui “profilo di risposta” è possibile rilevare le dimensioni delle cellule, la granularità delle cellule e l’espressione dei marcatori cellulari di ogni singola cellula. Combinazioni specifiche di marcatori determinano quale popolazione cellulare è coinvolta (Tab. 1) [5,14].
Nel laboratorio CSF del Dipartimento di Neurologia con l’Istituto di Neurologia Traslazionale dell’Ospedale Universitario di Münster, negli ultimi anni sono stati eseguiti esami citometrici a flusso molto estesi da campioni di sangue e, in particolare, anche da campioni CSF di alta qualità di pazienti con varie malattie neurologiche. Ogni anno, circa mille campioni di CSF sono stati analizzati con la citometria a flusso standardizzata e i set di dati sono stati raccolti in una biobanca. Questi dati hanno raggiunto una scala senza precedenti e sono disponibili per numerose reti di ricerca a livello nazionale e internazionale.
Nel primo lavoro scientifico che ne è derivato, sono state confrontate le cellule immunitarie nel liquido cerebrospinale e nel sangue di pazienti con malattie autoimmuni del sistema nervoso centrale e periferico [5,9]. L’analisi citometrica a flusso è stata utilizzata anche nei pazienti con malattie neurodegenerative come la demenza di Alzheimer e la demenza frontotemporale [7,10]. In collaborazione con il Dipartimento di Psichiatria dell’Ospedale Universitario di Münster, sono stati esaminati i leucociti provenienti da campioni di sangue e di liquido cerebrospinale di pazienti con disturbi psicotici primari e confrontati con i profili immunitari delle malattie neurologiche.
Il database del Dipartimento di Neurologia con l’Istituto di Neurologia Traslazionale dell’Ospedale Universitario di Münster continuerà ad essere ampliato con nuovi set di dati in futuro e servirà come fonte di informazioni per analisi più approfondite e diagnosi differenziali specifiche di varie malattie.
Neuropatie
Le neuropatie – malattie del sistema nervoso periferico – sono molto comuni e possono colpire le fibre nervose motorie, sensoriali e autonome. Dal punto di vista clinico, le neuropatie si differenziano in base al modello di distribuzione, al decorso clinico e alla genesi. A seconda della localizzazione dei nervi colpiti, si distingue tra mononeuropatie e polineuropatie (PNP). Esiste un ampio spettro di possibili cause di neuropatie, tra cui malattie metaboliche, tossiche, ereditarie, infettive, autoimmuni, vasculitiche, paraproteinemiche e maligne. La causa più comune di polineuropatia nel mondo occidentale è il diabete mellito, seguito dalla genesi etilica. Fino al 10% delle neuropatie sono causate da processi autoimmuni e sono quindi definite anche neuropatie immunitarie [11].
La diagnosi si basa principalmente sull’anamnesi e sull’esame fisico e neurologico. Si presta particolare attenzione alle infezioni precedenti, ad esempio gastroenterite e infezioni delle vie respiratorie superiori, alle malattie preesistenti e ai sintomi di altri sistemi organici, ad esempio i sintomi autonomici. Il primo esame di laboratorio è un test diagnostico standard. Con l’aiuto della diagnosi estesa di alcuni anticorpi gangliosidi (GM1, GM2, GQ1b, ecc.), la diagnosi di una neuropatia immunitaria autoimmune-mediata può essere supportata in caso di sospetto clinico. I parametri infiammatori, l’immunoelettroforesi, gli anticorpi reumatici (ANA, AN-CA) o gli anticorpi antineuronali (anti-Hu, anti-CV2/CRMP5, anti-amphiphysin, anti-Ma2) possono essere indicativi di una malattia sistemica o maligna come causa delle polineuropatie infiammatorie. Per escludere le infezioni virali o batteriche, si può aggiungere un’anamnesi completa e una diagnosi sierologica di patogeni virali (EBV, CMV, HSV, VZV, FSME, HBV, HIV, poliomielite) o batterici (Borrelia, Treponema pallidum). Le misurazioni elettrofisiologiche possono rilevare con maggiore precisione i modelli di distribuzione e di danno e consentire la classificazione in diversi sottotipi. L’elettromiografia può essere utilizzata per rilevare altri modelli di danno miogenico, come la denervazione, l’atrofia muscolare e l’attività spontanea. Le tecniche di imaging, come l’ecografia e la risonanza magnetica, possono visualizzare i modelli di danno e aiutare nella diagnosi di esclusione di altre cause di neuropatie, ad esempio tumori neuronali come gli schwannomi.
Neuropatie immunitarie
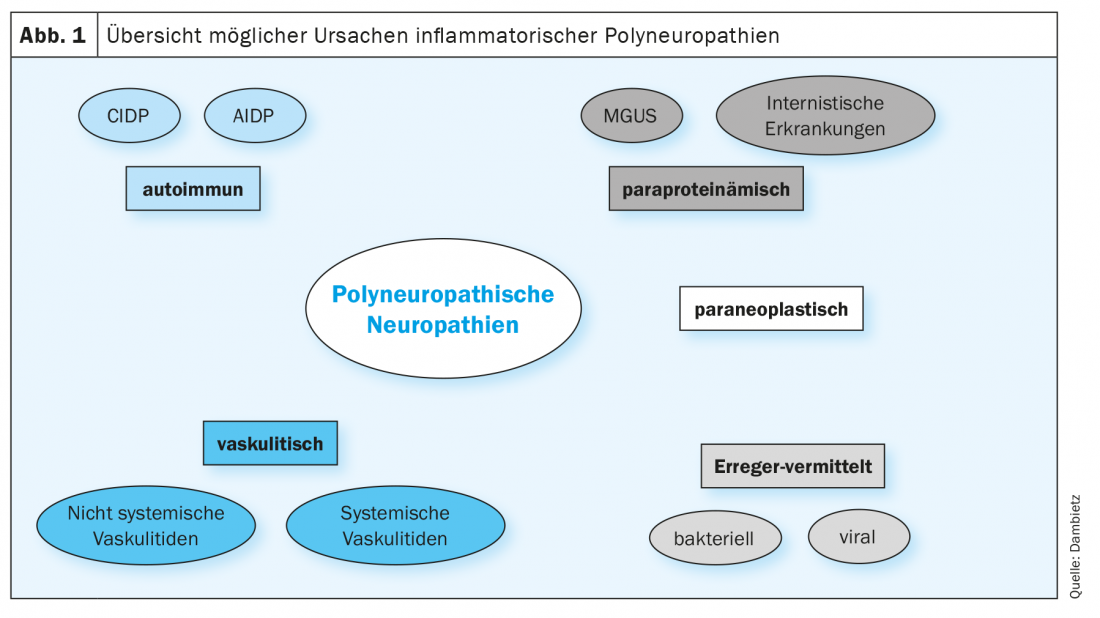
Le neuropatie immunitarie sono particolarmente importanti perché possono essere trattate se diagnosticate precocemente e se la terapia viene iniziata in modo appropriato. Principalmente, le neuropatie immunitarie si dividono in acute (≤ quattro settimane), subacute (da quattro a otto) o croniche (≥ otto settimane). La poliradiculoneuropatia demielinizzante infiammatoria acuta (AIDP) è chiamata sindrome di Guillain-Barré (GBS) ed è la forma più comune di neuropatie immunitarie acute, mentre la polineuropatia demielinizzante infiammatoria cronica (CIDP) è il prototipo delle neuropatie immunitarie croniche. La diagnosi differenziale delle polineuropatie infiammatorie è ancora oggi una grande sfida. Oltre alle neuropatie autoimmuno-mediate, devono essere prese in considerazione varie altre cause per la diagnosi differenziale (Fig. 1).
Differenziazione delle neuropatie immunitarie utilizzando i profili delle cellule immunitarie
La classificazione in neuropatie immunitarie acute e croniche è in parte artificiale e ci sono molte sovrapposizioni e transizioni fluide tra le due forme. Pertanto, la CIDP presenta un esordio acuto simile alla GBS in un massimo del 10% dei casi. Al contrario, un decorso subacuto di oltre quattro settimane è stato descritto in casi inizialmente classificati come GBS [12]. Finora non esistono parametri prognostici che permettano di prevedere un decorso acuto o cronico al momento della prima manifestazione clinica. Poiché le opzioni terapeutiche e la risposta alle diverse terapie immunomodulanti differiscono nella GBS e nella CIDP, la differenziazione precoce delle entità è importante e potrebbe avere un impatto positivo sul decorso e sulla prognosi delle malattie.
Nelle misurazioni standard del liquor nelle neuropatie infiammatorie, si può rilevare una cosiddetta “disseminazione citalbuminosa” con un aumento delle proteine totali nel liquor, con una conta cellulare normale e spesso un disturbo della barriera emato-encefalica.
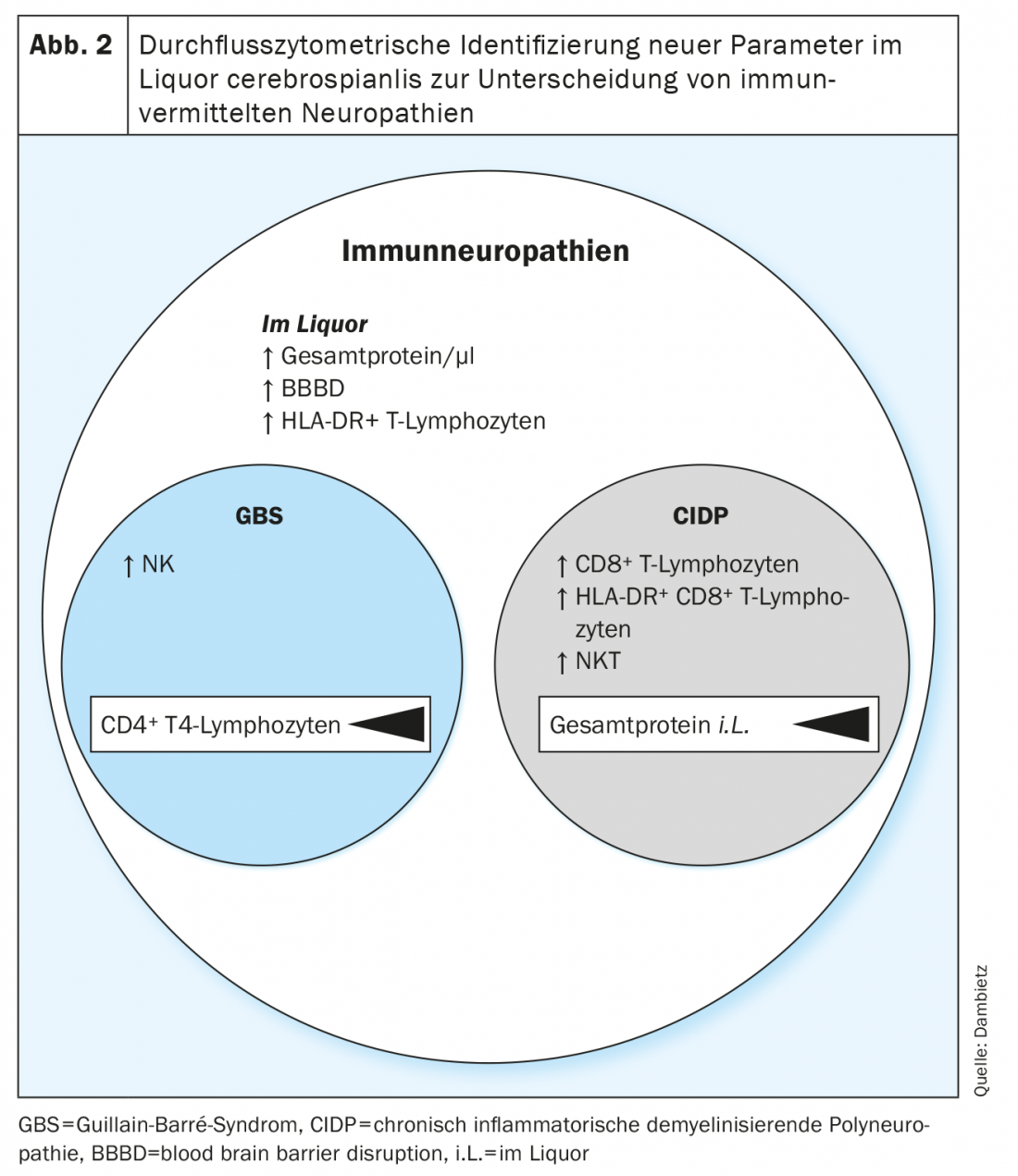
Ora, per la prima volta, utilizzando la citometria a flusso, sono state analizzate retrospettivamente e confrontate le composizioni di cellule immunitarie nel liquor dei pazienti con GBS e CIDP [13]. I profili eterogenei indicano il coinvolgimento di diverse popolazioni cellulari nella fisiopatologia delle neuropatie immunitarie acute e croniche.
Nella citometria a flusso, è stato registrato un numero maggiore di linfociti T attivati e non attivati (HLA-DR+ vs. HLA-DR-) nel liquor dei pazienti con neuropatie infiammatorie. Tuttavia, l’attivazione dei linfociti T, così come l’aumento delle proteine del liquor e l’alterazione della barriera emato-encefalica sono parametri non specifici per le neuropatie e sono solo poco adatti a distinguere tra GBS e CIDP, poiché l’attivazione dei linfociti T è frequentemente riscontrata nelle forme acute e croniche di neuropatie e può essere rilevata anche in altre malattie neurologiche. [14,15].
Più specificamente, nel liquor della sindrome di Guillain-Barré è stata rilevata un’aumentata proporzione di cellule natural killer (NK), mentre nella polineuropatia demielinizzante infiammatoria cronica è stato rilevato un aumento del numero di cellule natural T-killer (NKT) e di cellule CD8.+ I linfociti T sono aumentati (Fig. 2). In un confronto diretto tra la sindrome di Guillain-Barré e la polineuropatia demielinizzante infiammatoria cronica, il rilevamento delle cellule T natural killer, seguite dai monociti classici e intermedi, è stato definito come il parametro con la massima fiducia per differenziare le due entità neuropatiche. L’immunoprofilazione con le diverse proporzioni di cellule NK, NKT e T CD8+ rivela modelli specifici di malattia e sottotipo di cellule immunitarie nel liquor e fornisce un’indicazione del coinvolgimento di tipi di cellule citotossiche distinte nella fisiopatologia delle neuropatie immunitarie acute e croniche. Inoltre, con l’aiuto dei profili cellulari individuali, è possibile effettuare una valutazione prospettica tra decorso acuto e cronico al momento della prima manifestazione clinica, facilitando così la scelta della terapia.
Il trattamento di scelta per la sindrome di Guillain-Barré è la plasmaferesi. Inoltre, le immunoglobuline per via endovenosa sono disponibili come opzione terapeutica equivalente. Al giorno d’oggi, a causa della carenza ubiquitaria di immunoglobuline, queste sono solitamente utilizzate solo in seconda battuta nella pratica clinica quotidiana e sono applicate in particolare per l’escalation della terapia dopo la plasmaferesi con un miglioramento insufficiente dei sintomi clinici. Mentre i corticosteroidi non hanno mostrato alcun effetto nella GBS [16], è stata dimostrata una buona efficacia nella polineuropatia demielinizzante infiammatoria cronica, motivo per cui sono utilizzati come standard nel trattamento della CIDP [17–19].
I pazienti GBS e CIDP naïve alla terapia non hanno mostrato alcuna differenza significativa nei loro profili di cellule immunitarie liquorali rispetto ai pazienti già in terapia. In definitiva, ciò significa che la differenziazione citometrica a flusso delle neuropatie infiammatorie può avvenire anche durante la terapia e che i profili delle cellule immunitarie sottotipo-specifiche nel liquor non vengono alterati dall’uso di immunoglobuline o corticosteroidi, per esempio.
Per evidenziare la rilevanza clinica delle composizioni di cellule immunitarie sottotipo-specifiche, sono stati rilevati i parametri che riflettono la manifestazione clinica delle neropatie. La gravità delle malattie era basata sul punteggio di disabilità Hughes e sulla Scala Rankin modificata (mRS). Nella sindrome di Guillain-Barré, c’era una correlazione tra il numero di linfociti T CD4+ e di monociti non classici e la gravità clinica della malattia. Nella CIDP, il livello di proteine totali nel liquor è correlato alla gravità della malattia. La citometria a flusso del liquor ha stabilito un nuovo approccio diagnostico per identificare i cambiamenti specifici della malattia e del sottotipo nelle neuropatie infiammatorie autoimmuni-mediate, facilitando la differenziazione della CIDP dalla GBS. In futuro, questo potrebbe essere la base per la valutazione della prognosi e lo sviluppo di nuovi farmaci, e l’analisi immunocellulare potrebbe essere estesa ad altre varianti neuropatiche.
Immunofenotipi nello spettro delle malattie neurologiche
Sulla base dell’aumento delle informazioni attraverso l’uso della citometria a flusso in diversi compartimenti (sangue e CSF), la raccolta dei dati è stata estesa a uno spettro più ampio di malattie neurologiche. In uno studio retrospettivo trasversale, sono state analizzate le composizioni delle cellule immunitarie nei pazienti con malattie autoimmuni-mediate, neurodegenerative e vascolari. Come le neuropatie immunitarie, le malattie autoimmuni del sistema nervoso centrale rappresentano un gruppo eterogeneo di patologie neuroinfiammatorie che ancora oggi richiedono una classificazione più specifica e una diagnosi differenziale più precisa e i cui pato-meccanismi sottostanti non sono ancora stati completamente decifrati.
I singoli parametri sono stati rilevati mediante citometria a flusso e le caratteristiche che meglio differenziano le malattie neuroinfiammatorie dalle patologie neurodegenerative e vascolari sono state estratte mediante analisi multidimensionali [5].
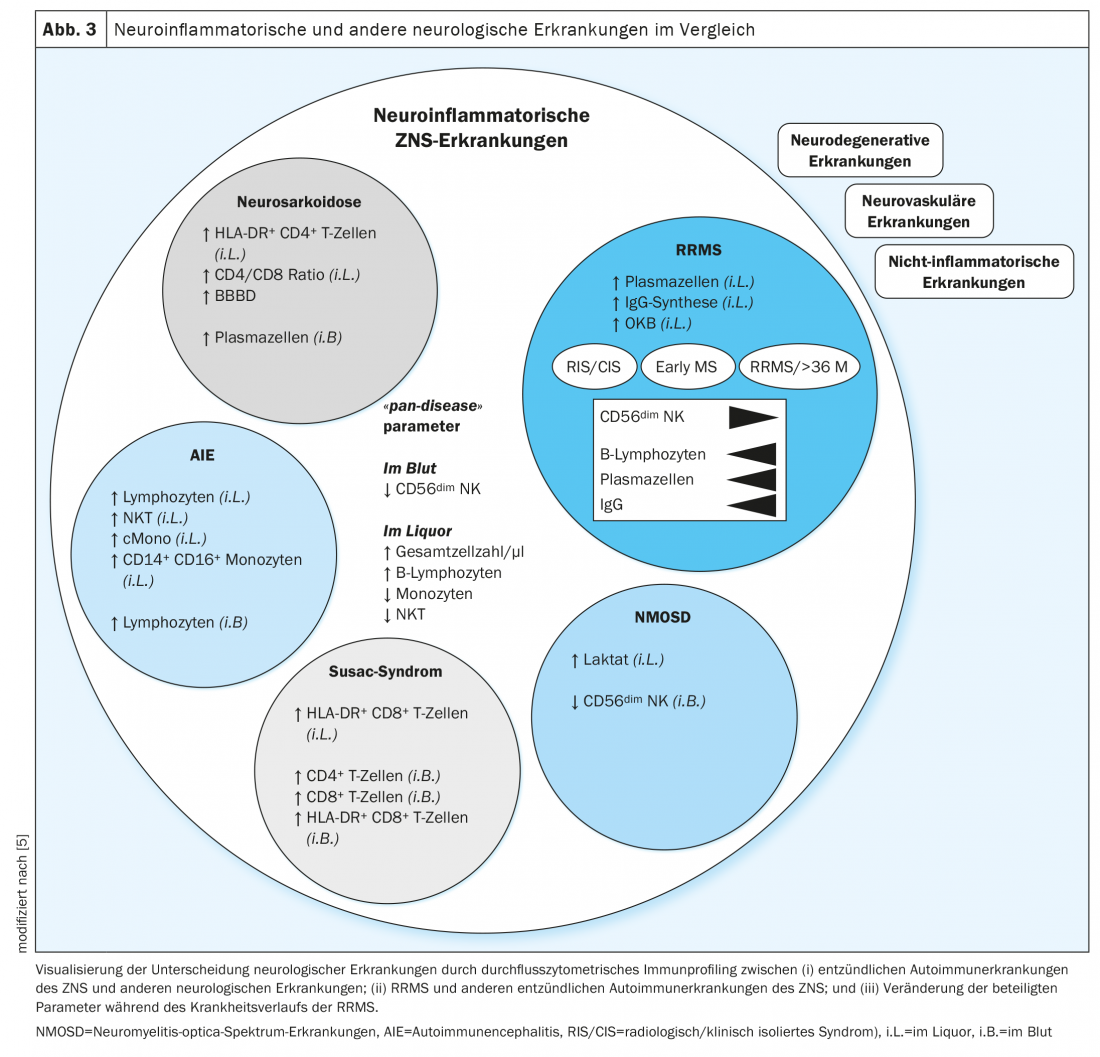
I profili delle cellule immunitarie delle malattie neuroinfiammatorie autoimmuni hanno mostrato somiglianze tra loro e differenze rispetto alle malattie neurodegenerative, vascolari e non infiammatorie (Fig. 3). Nei profili delle cellule immunitarie di tutte le malattie neuroinfiammatorie, il numero di cellule e la percentuale di linfociti B nel liquor sono aumentati, mentre i monociti, le cellule natural killer e le cellule T natural killer sono diminuite. Inoltre, è stato riscontrato che un numero ridotto di cellule NK CD56dim nel sangue è indicativo della presenza di una malattia infiammatoria del SNC. Queste caratteristiche sono state definite come parametri “pan-malattia” per le patologie autoimmuni del sistema nervoso centrale e quindi indicano cambiamenti tra le varie malattie (Fig. 3) . Nella sclerosi multipla, un aumento del numero di cellule nel liquor e un’espansione significativa delle cellule del lignaggio B sono noti da molti anni [20,21]. È interessante notare che questi parametri erano modificabili dalle immunoterapie e potrebbero essere utilizzati in futuro come biomarcatori di risposta alle terapie immunomodulanti e migliorare la valutazione prognostica e la gestione della terapia.
Composizioni di cellule immunitarie nelle malattie neuroinfiammatorie autoimmuni
Le firme delle cellule immunitarie specifiche della malattia nel liquor sono state studiate anche in diverse altre malattie neurologiche.
In uno studio retrospettivo, sono state confrontate le composizioni delle cellule immunitarie nella sclerosi multipla recidivante-remittente (SMRR) e nella neurosarcoidosi. La sarcoidosi è una malattia multisistemica autoimmune che si manifesta con granulomi epitelioidi in vari organi, dove provoca reazioni infiammatorie locali attraverso l’infiltrazione di macrofagi [22]. In circa il 25% dei pazienti, viene colpito anche il sistema nervoso centrale [23]. Spesso si manifesta con sintomi neurologici che possono essere simili a quelli di una ricaduta della SM. La diagnosi di sarcoidosi comprende un esame del sangue con determinazione dei parametri infiammatori, immunoglobulina G, ACE, recettore IL-2 solubile (sIL-2R) e neopterina, nonché un test di funzionalità polmonare, una broncoscopia con lavaggio broncoalveolare e biopsia transbronchiale, una radiografia del torace e, a seconda delle manifestazioni cliniche, ulteriori esami di imaging e interdisciplinari [24,25]. Per quanto riguarda la differenziazione da altre malattie infiammatorie, i parametri chimici di laboratorio (ACE, sIL-2R) si sono dimostrati non specifici e non sufficientemente sensibili [26,27]. Anche la distinzione tra neurosarcoidosi e sclerosi multipla non è sempre chiara sulla diagnostica per immagini, poiché le lesioni della SM (lesioni della materia bianca) e le alterazioni granulomatose della neurosarcoidosi spesso si assomigliano sulla risonanza magnetica [28]. Anche la “semplice” analisi standard del liquor mostra deviazioni simili, come una lieve pleocitosi [29]. La diagnosi finale di neurosarcoidosi può essere fatta a volte solo attraverso la biopsia di lesioni sospette di granuloma nel sistema nervoso centrale [30]. Tuttavia, tale biopsia è una procedura invasiva e rischiosa e dovrebbe essere eseguita solo dopo un’attenta valutazione dei rischi e dei benefici. Per evitare una misura così invasiva, è essenziale la creazione di nuovi strumenti diagnostici. La citometria a flusso da liquor e sangue di pazienti con neurosarcoidosi e sclerosi multipla è stata valutata retrospettivamente sotto questo aspetto.
Nella citometria a flusso, la neurosarcoidosi è stata sorprendentemente ben distinta dalla sclerosi multipla per un aumento della proporzione di plasmacellule, monociti intermedi e non classici nel sangue, mentre il numero di linfociti T nel sangue era ridotto nella neurosarcoidosi. Il liquor ha mostrato parametri in parte sovrapponibili in entrambe le malattie, per cui la proporzione di linfociti T CD4-positivi era specificamente aumentata nella neurosarcoidosi. La differenziazione delle due malattie è stata ottimizzata dall’integrazione multidimensionale delle composizioni cellulari immunologiche del liquor e del sangue (Fig. 3). La dominanza di linfociti T attivati CD4-positivi e un aumento del rapporto CD4/CD8 nel liquor, nonché un aumento della proporzione di plasmacellule nel sangue, sono stati definiti come caratteristiche della neurosarcoidosi [14]. Il rilevamento delle plasmacellule nel liquido cerebrospinale, così come la sintesi intratecale di IgG e le bande oligoclonali, è stato fondamentale per la sclerosi multipla.
Le composizioni immunocellulari individuali nel liquor consentono quindi una migliore differenziazione tra queste due malattie infiammatorie del sistema nervoso centrale e possono rendere possibile la rinuncia alle conferme diagnostiche bioptiche nella pratica clinica quotidiana e semplificare la scelta della terapia (immunosoppressori classici vs. terapie modulatrici della SM).
Inoltre, l’attenzione è stata posta sulla differenziazione di distinte malattie autoimmuni del sistema nervoso centrale e i profili delle cellule immunitarie sono stati confrontati nella sclerosi multipla, nei disturbi dello spettro della neuromielite optica (NMOSD), nell’encefalite autoimmune (AIE) e nella sindrome di Susac. La NMOSD è caratterizzata da neuriti ottiche e mieliti ricorrenti con lesioni infiammatorie di lunga durata [31]. L’encefalite autoimmune può manifestarsi clinicamente con cefalea, febbre, riduzione della vigilanza, crisi epilettiche, ma anche con deficit cognitivi. Nell’encefalite del recettore NMDA (NMDARE), spesso si verificano deficit cognitivi, disturbi mnestici e sintomi psicotici [32, 33]. La sindrome di Susac è un’endoteliopatia mediata dalle cellule T CD8+ dei piccoli vasi sanguigni del SNC ed è clinicamente caratterizzata da una triade di encefalopatia, perdita dell’udito e perdita della vista [34,35].
Mentre queste malattie mostrano cambiamenti simili tra loro nelle analisi standard del liquor [36], la citometria a flusso ha rivelato cambiamenti sottotipo-specifici nella composizione delle cellule immunitarie.
Oltre alla sintesi di IgG intratecale già nota, sono state identificate anche la sintesi di IgA e IgM intratecali come caratteristiche della SMRR. Nelle malattie dello spettro della neuromielite optica, erano particolarmente evidenti un numero ridotto di cellule NK CD56bright nel sangue e un aumento della concentrazione di lattato nel liquido cerebrospinale. La sindrome di Susac è stata caratterizzata dal rilevamento di linfociti T CD4+ e CD8+ nel sangue e da un aumento della proporzione di linfociti T CD8+ attivati (HLA-DR+) nel liquido cerebrospinale e nel sangue. Caratteristica dell’encefalite autoimmune è stata la rilevazione di un aumento del numero di linfociti nel liquor e nel sangue, nonché un aumento del numero di cellule T-killer naturali, monociti classici e monociti CD14+ CD16+ nel liquor.
Con l’aiuto dell’analisi citometrica a flusso delle cellule immunitarie dal liquido cerebrospinale, la SMRR può quindi essere differenziata dalle altre entità con un alto grado di fiducia. In un’analisi multidimensionale, le plasmacellule nel liquor e la sintesi intratecale di IgG sono state definite come i migliori parametri per differenziare la SMRR da altre malattie autoimmuni del SNC.
I profili delle cellule immunitarie dei pazienti con sclerosi multipla recidivante-remittente in diverse fasi della malattia sono stati esaminati in modo più dettagliato. Indipendentemente dallo stadio della malattia, i parametri ‘pan-malattia’ sono stati alterati nella stessa misura. Al contrario, con la progressione della malattia, si è verificata un’ulteriore riduzione del CD56dim cellule NK nel sangue e un aumento dei linfociti B intratecali, delle plasmacellule e della sintesi di IgG intratecali. (Fig. 3). Con l’aiuto di parametri specifici delle cellule immunitarie che si correlano con la gravità e la progressione della malattia, si potrebbero definire nuovi marcatori attraverso il monitoraggio continuo, che facilitano la valutazione dell’attività della malattia e consentono la modulazione precoce della terapia per influenzare positivamente il decorso della malattia. Ulteriori dati provenienti da studi longitudinali su più decenni potrebbero identificare i parametri che facilitano il rilevamento della transizione dalla SM recidivante-remittente a quella secondaria progressiva. Sono quindi ancora necessari studi prospettici di conferma.
L’analisi precisa dei profili variabili delle cellule immunitarie in diverse entità patologiche dovrebbe aiutare in futuro a comprendere meglio i pato-meccanismi comuni e distinti nelle singole malattie, ma l’identificazione di ulteriori parametri discriminanti richiede coorti più ampie, soprattutto di pazienti con malattie rare come la NMOSD o la sindrome di Susac. In futuro, la citometria a flusso non sarà limitata al campo della neurologia, ma sarà estesa ad altre discipline mediche.
Analisi delle cellule immunitarie nel campo interdisciplinare
Anche numerose malattie neuroinfiammatorie possono manifestarsi con sintomi psichiatrici, ad esempio le encefaliti autoimmuni come l’encefalite da recettore NMDA (NMDARE). Le diagnosi errate che classificano l’AIE come un disturbo primario del gruppo dei disturbi psichiatrici si ripetono. Le conseguenze che ne derivano possono essere gravi. Ancora oggi, la diagnosi differenziale tra malattie psichiatriche e autoimmuni neuroinfiammatorie rappresenta una sfida nella routine clinica della neurologia e della psichiatria. Inoltre, lo spettro dei disturbi psichiatrici comprende anche numerose entità la cui patogenesi non è ancora pienamente compresa [37]. Negli ultimi anni sono stati discussi anche meccanismi immunologici e autoimmuni, che possono contribuire allo sviluppo di disturbi psichiatrici [38–41]. Per questo motivo, abbiamo analizzato i dati della citometria a flusso nel contesto dei disturbi psichiatrici. Nella diagnosi delle malattie psichiatriche, l’analisi del liquido cerebrospinale è stata finora utilizzata soprattutto per escludere le malattie organiche.
In uno studio retrospettivo, sono stati raccolti dati sulla composizione delle cellule immunitarie nelle malattie dello spettro delle psicosi primarie (tra cui la schizofrenia, i disturbi deliranti, i disturbi psicotici acuti e transitori e i disturbi schizoaffettivi) e sono stati confrontati con le firme delle cellule immunitarie delle malattie neuroinfiammatorie, in particolare NMDARE – un sottotipo comune di AIE.
Con l’aiuto della citometria a flusso, sono stati rilevati i parametri e sono stati creati punteggi multidimensionali, che non solo servono alla diagnosi di esclusione, ma supportano e facilitano anche la diagnosi dei disturbi psicotici primari. Inoltre, la composizione di cellule immunitarie specifiche fornisce prove del coinvolgimento di alcune sottopopolazioni nella genesi e nei meccanismi patologici delle malattie psichiatriche. Ricerche precedenti hanno mostrato prove di un aumento della conta leucocitaria nel sangue dei pazienti con disturbi psicotici [42]. Le analisi standard del liquor hanno mostrato un aumento delle proteine del liquor nelle psicosi primarie e spesso la presenza di un disturbo della barriera emato-encefalica. Tuttavia, non esistono parametri di laboratorio e chimici del liquore specifici e finora non è stato possibile effettuare una differenziazione affidabile dalle malattie neurologiche mediante esami standard del sangue e del liquore.
La citometria a flusso ha mostrato cambiamenti compartimentali specifici nel liquor e nel sangue nei pazienti con psicosi primaria [43]. La composizione specifica delle cellule immunitarie nel liquor nei disturbi psicotici primari è stata caratterizzata da un aumento dei linfociti T CD8-positivi e dei monociti, soprattutto dei monociti non classici. D’altra parte, il numero di linfociti nel liquido cerebrospinale era ridotto (panoramica 1) . Il sangue ha mostrato un aumento del numero di cellule natural killer e di monociti. In particolare, il numero di monociti classici è aumentato, mentre la proporzione di monociti intermedi nel sangue è diminuita. L’encefalite del recettore NMDA (NMDARE) è spesso accompagnata da sintomi psicotici e può essere difficile da distinguere clinicamente dalle psicosi primarie. Nonostante la possibilità di determinare gli anticorpi specifici del recettore anti-NMDA, sono possibili diagnosi errate, poiché esistono anche varianti di encefalite autoimmune anticorpo-negativa [44]. Per questo motivo, le due malattie sono state confrontate in particolare. Il profilo delle cellule immunitarie con la citometria a flusso ha dimostrato che la NMADRE può essere ben differenziata dai disturbi psicotici primari grazie a un aumento della proporzione di linfociti, cellule B e monociti nel liquor e al rilevamento di plasmacellule nel sangue. (Panoramica 1). Inoltre, la citometria a flusso ha rilevato un aumento della percentuale di cellule natural killer nel sangue dei pazienti con sintomi psicotici positivi.
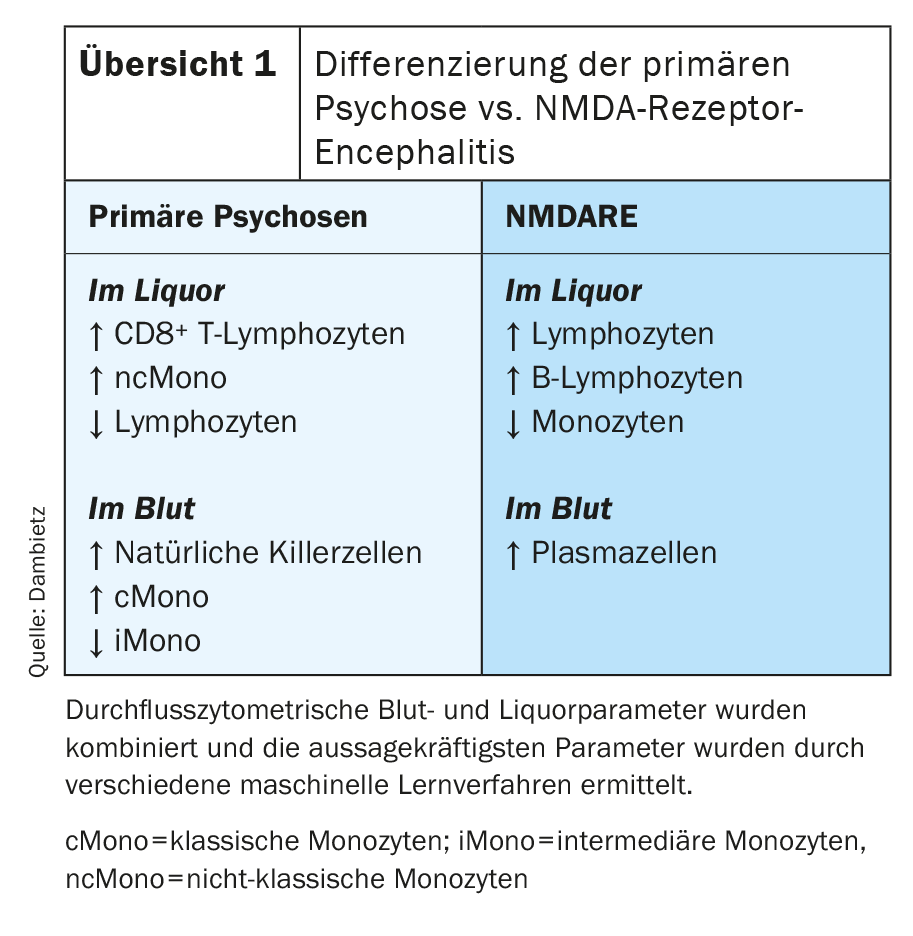
I disturbi psicotici primari sono un gruppo eterogeneo, la cui complessa fisiopatologia non è ancora stata compresa e non è stata esplorata nel dettaglio in molti aspetti. Ricerche precedenti indicano una disregolazione del sistema immunitario e componenti infiammatorie nel sistema nervoso centrale nei pazienti con disturbi psicotici primari. I risultati della citrometria a flusso mostrano cambiamenti nella composizione delle cellule immunitarie nel liquido cerebrospinale e suggeriscono che i meccanismi immunologici, soprattutto l’immunità innata, insieme a una funzione di barriera disturbata della barriera emato-encefalica, contribuiscono allo sviluppo dei disturbi psicotici primari. La citometria a flusso ha identificato cambiamenti tipici della malattia nella composizione delle cellule immunitarie nel liquor e nel sangue, che sono alla base della diagnosi di psicosi primaria e supportano l’ipotesi immunitaria della psicosi primaria.
Sommario
Con l’aiuto della citometria a flusso dal liquido cerebrospinale, è stata stabilita la possibilità di nuove analisi delle cellule immunitarie specifiche della malattia e del sottotipo. Gli esami citometrici a flusso del liquor hanno permesso una classificazione specifica delle malattie neuroinfiammatorie del sistema nervoso centrale e periferico. La composizione delle cellule immunitarie nel liquor dei pazienti con GBS rispetto a quelli con CIDP può distinguere le due entità con maggiore sicurezza. Inoltre, al momento della diagnosi iniziale di neuropatia infiammatoria, è possibile effettuare una valutazione precoce del decorso della malattia (acuta-monofasica vs. cronica-recidivante).
Inoltre, le malattie infiammatorie autoimmuni del sistema nervoso centrale mostrano cambiamenti individuali nelle sottopopolazioni cellulari nel sangue e nel liquido cerebrospinale. Queste variazioni specifiche della malattia dovrebbero migliorare la classificazione nelle singole entità in futuro e quindi facilitare la diagnosi differenziale. Soprattutto in caso di risultati poco chiari in altri esami, ad esempio nella diagnostica per immagini o in caso di cambiamenti chimici di laboratorio non specifici, l’analisi citometrica a flusso del liquido cerebrospinale può essere rivoluzionaria. Per esempio, quando si rilevano lesioni non specifiche nella risonanza magnetica, ad esempio lesioni ischemiche rispetto a lesioni della materia bianca (nella SM, nella NMOSD o nella sindrome di Susac), o granulomi nel sistema nervoso centrale rispetto a lesioni della SM, la diagnosi può essere integrata con l’analisi delle cellule immunitarie.
Inoltre, una diagnosi precoce può aprire la strada a decisioni terapeutiche, come l’uso di farmaci immunomodulatori, e l’influenza sul decorso della malattia può essere ottimizzata attraverso una scelta determinata della terapia. L’obiettivo delle future analisi citometriche a flusso del liquor potrebbe essere il rilevamento di variabili immunocellulari che riflettono gli effetti terapeutici e consentono una migliore valutazione della progressione della malattia.
Inoltre, il riconoscimento di firme di cellule immunitarie specifiche per la malattia indica il coinvolgimento di determinate popolazioni cellulari nello sviluppo di malattie neurologiche e nei meccanismi autoimmuni nel sistema nervoso centrale e periferico. Costituisce quindi la base per analisi più approfondite dei processi fisiopatologici.
In sintesi, la citometria a flusso dal liquor rappresenta una nuova opzione diagnostica per l’analisi di profili specifici di cellule immunitarie. La citometria a flusso dei pazienti con neuropatie immunitarie, malattie neuroinfiammatorie autoimmuni del SNC o disturbi psicotici ha mostrato cambiamenti immunocellulari specifici della malattia nei comparti periferici e intratecali, suggerendo il coinvolgimento del sistema immunitario innato e dei meccanismi immunologici nell’eziologia delle malattie. In particolare, è stato dimostrato che non solo i componenti cellulari nel sangue, ma anche le cellule immunitarie specifiche nel liquor svolgono un ruolo decisivo nella fisiopatologia delle malattie neurologiche.
Con la creazione di un database unico di dati citometrici a flusso di campioni di liquido cerebrospinale di alta qualità, nel Dipartimento di Neurologia dell’Ospedale Universitario di Münster sono state create le basi per futuri progetti di ricerca più approfonditi.
Identificando i parametri singolari e stabilendo punteggi multifattoriali, in futuro si potrebbero generare profili di cellule immunitarie specifici per la malattia e la sottoclasse, che potrebbero essere utilizzati come nuovi strumenti diagnostici nella pratica clinica quotidiana e rivoluzionare la diagnosi e la terapia delle neuropatie immunitarie e di altre malattie.
Messaggi da portare a casa
- La citometria a flusso delle cellule del liquido cerebrospinale consente di identificare i profili delle cellule immunitarie specifiche della malattia.
- Alcune popolazioni leucocitarie sono state identificate come marcatori di singole malattie e possono essere coinvolte nei singoli meccanismi patologici, ad esempio le cellule T natural killer per differenziare le neuropatie immunitarie acute da quelle croniche. I monociti nel liquido cerebrospinale potrebbero distinguere la psicosi primaria dall’encefalite da recettore NDMA.
- Le analisi prospettiche delle cellule del liquor potrebbero migliorare la selezione e il monitoraggio delle terapie nella pratica clinica quotidiana.
- La citometria a flusso delle cellule del liquor può migliorare la diagnosi di malattie con manifestazioni cliniche non specifiche e sintomi sovrapposti, facilitando così le decisioni terapeutiche.
Letteratura:
- Iliff JJ, et al: Un percorso paravascolare facilita il flusso del liquor attraverso il parenchima cerebrale e l’eliminazione dei soluti interstiziali, compresa l’amiloide beta. Sci Transl Med 2012; 4(147): 147ra111.
- Schlager C, et al.: Traffico di cellule T effettrici tra le leptomeningi e il liquido cerebrospinale. Natura 2016; 530(7590): 349-353.
- Engelhardt B, Vajkoczy P, Weller RO: I movimenti e le forme del privilegio immunitario del SNC. Nat Immunol 2017; 18(2): 123-131.
- Louveau A, et al.: Caratteristiche strutturali e funzionali dei vasi linfatici del sistema nervoso centrale. Natura 2015; 523(7560): 337-341.
- Gross CC, et al.: Classificazione delle malattie neurologiche mediante analisi multidimensionale del liquor. Brain, 2021. 144(9): 2625-2634.
- Han S, et al: Immunofenotipizzazione completa delle cellule del liquido cerebrospinale nei pazienti con malattie neuroimmunologiche. J Immunol 2014; 192(6): 2551-2563.
- Pawlowski M, et al.: Rilevanza dei livelli elevati di monociti nel liquido cerebrospinale nei pazienti con demenza frontotemporale. Neurobiol Aging 2018; 62: 45-52.
- Alvermann S, et al: Immunofenotipizzazione delle cellule del liquido cerebrospinale nella sclerosi multipla: alla ricerca di biomarcatori. JAMA Neurol 2014; 71(7): 905-912.
- Gross CC, et al: L’alterata regolazione mediata dalle NK dell’attività delle cellule T nella sclerosi multipla è ricostituita dalla modulazione del recettore IL-2. Proc Natl Acad Sci USA 2016; 113(21): E2973-2982.
- Lueg G, et al.: Rilevanza clinica dell’attivazione specifica delle cellule T nel sangue e nel liquido cerebrospinale dei pazienti con malattia di Alzheimer lieve. Neurobiol Aging 2015; 36(1): 81-89.
- Wiendl HK, Kieseier B, Meuth S: Domande e risposte sulla neuroimmunologia 2015: 191-215.
- van Doorn PA: Diagnosi, trattamento e prognosi della sindrome di Guillain-Barre (GBS). Press Med 2013; 42(6 Pt 2): e193-201.
- Heming M, et al: Il profilo delle cellule immunitarie del fluido cerebrospinale fornisce approfondimenti patogenetici sulle neuropatie infiammatorie. Front Immunol 2019; 10: 515.
- Heming M, et al: I profili leucocitari nel sangue e nel liquor distinguono la neurosarcoidosi dalla sclerosi multipla. J Neuroimmunol 2020; 341: 577171.
- Li S, et al: IL-17 e IL-22 nel liquido cerebrospinale e nel plasma sono elevati nella sindrome di Guillain-Barre. Mediatori Infiammatori 2012; 2012: 260473.
- Studio in doppio cieco di metilprednisolone per via endovenosa nella sindrome di Guillain-Barre. Guillain-Barre Syndrome Steroid Trial GrouLancet, 1993. 341(8845): 586-590.
- Kieseier BC, et al: Neuropatie immunomediate. Nat Rev Dis Primers 2018; 4(1): 31.
- Nobile-Orazio E, Gallia F: Aggiornamento sul trattamento della poliradiculoneuropatia demielinizzante infiammatoria cronica. Curr Opin Neurol 2015; 28(5): 480-485.
- Nobile-Orazio E, et al: Immunoglobulina per via endovenosa rispetto a metilprednisolone per via endovenosa per la poliradiculoneuropatia demielinizzante infiammatoria cronica: uno studio randomizzato controllato. Lancet Neurol 2012; 11(6): 493-502.
- Kraus J, et al: Linfociti CD45RA+ ICAM-3+ nel liquido cerebrospinale e nel sangue come marcatori dell’attività della malattia nei pazienti con sclerosi multipla. Acta Neurol Scand 2000; 102(5): 326-332.
- Cepok S, et al: I modelli di patologia del liquido cerebrospinale sono correlati alla progressione della malattia nella sclerosi multipla. Brain 2001; 124(Pt 11): 2169-2176.
- Chen ES, Moller DR: Sarcoidosi – progressi scientifici e sfide cliniche. Nat Rev Rheumatol 2011; 7(8): 457-467.
- Iannuzzi MC, Rybicki BA, Teirstein AS: Sarcoidosi. N Engl J Med 2007; 357(21): 2153-2165.
- Bradshaw MJ, et al: Neurosarcoidosi: fisiopatologia, diagnosi e trattamento. Neurol Neuroimmunol Neuroinflamm, 2021. 8(6).
- Seve P, et al: Sarcoidosi: una panoramica clinica dai sintomi alla diagnosi, Cells 2021; 10(4).
- Bharwani KD, et al: Livelli plasmatici elevati di sIL-2R nella sindrome del dolore regionale complesso: un ruolo patogeno per i linfociti T? Mediatori Infiammatori 2017: 2764261.
- Cai B, et al.: Microinfiammazione caratterizzata da un equilibrio Treg/Teff disturbato con aumento di sIL-2R nei pazienti con diabete di tipo 2. Exp Clin Endocrinol Diabetes 2013; 121(4): 214-219.
- Spencer TS, et al: Manifestazioni cliniche e di risonanza magnetica della neurosarcoidosi. Semin Arthritis Rheum 2005; 34(4): 649-661.
- Pawate S, Moses H, Sriram S: Presentazioni ed esiti della neurosarcoidosi: uno studio di 54 casi. QJM 2009; 102(7): 449-460.
- Wegener S, et al: Neurosarcoidosi clinicamente isolata: un percorso diagnostico consigliato. Eur Neurol 2015; 73(1-2): 71-77.
- Jarius S, Wildemann B, Paul F: Neuromielite optica: caratteristiche cliniche, immunopatogenesi e trattamento. Clin Exp Immunol 2014; 176(2): 149-164.
- Dalmau J, Graus F: Encefalite mediata da anticorpi. N Engl J Med 2018; 378(9): 840-851.
- Dalmau J, et al: Un aggiornamento sull’encefalite da recettori anti-NMDA per neurologi e psichiatri: meccanismi e modelli. Lancet Neurol 2019; 18(11): 1045-1057.
- Vishnevskia-Dai V, et al: Sindrome di Susac: caratteristiche cliniche, classificazione clinica e prognosi a lungo termine. Medicine (Baltimora), 2016; 95(43): e5223.
- Gross CC, et al: L’endoteliopatia mediata dalle cellule T CD8(+) è un meccanismo bersaglio dell’infiammazione neurologica nella sindrome di Susac. Nat Commun 2019; 10(1): 5779.
- Toledano M, Weinshenker BG, Solomon AJ: Un approccio clinico alla diagnosi differenziale della sclerosi multipla. Curr Neurol Neurosci Rep 2015; 15(8): 57.
- Fritz B: Sulla diagnosi sierologica della schizofrenia dal liquido cerebrospinale secondo il metodo di Lehmann-Facius. 1939/12. 165: 462-467.
- van Kesteren CF, et al: Coinvolgimento immunitario nella patogenesi della schizofrenia: una meta-analisi sugli studi cerebrali post mortem. Transl Psychiatry 2017; 7(3): e1075.
- Mazza MG, et al: Rapporto neutrofili-linfociti, rapporto monociti-linfociti e rapporto piastrine-linfociti nella psicosi non affettiva: una meta-analisi e una revisione sistematica. World J Biol Psychiatry 2020; 21(5): 326-338.
- Fernandez-Egea E, et al: Popolazioni di cellule immunitarie periferiche associate a deficit cognitivi e sintomi negativi della schizofrenia resistente al trattamento. PLoS One 2016; 11(5): e0155631.
- Doorduin J, et al: Neuroinfiammazione nella psicosi legata alla schizofrenia: uno studio PET. J Nucl Med 2009; 50(11): 1801-1807.
- Steiner J, et al: Cellule immunitarie innate e proteina C-reattiva nella psicosi acuta del primo episodio e nella schizofrenia: relazione con la psicopatologia e il trattamento. Schizophr Bull 2020; 46(2): 363-373.
- Rauber S, et al.: La citometria a flusso del liquido cerebrospinale distingue i disturbi dello spettro psicotico dalle diagnosi differenziali. Mol Psychiatry 2021; 26(12): 7661-7670.
- Dalmau J, et al: Encefalite da recettori anti-NMDA: serie di casi e analisi degli effetti degli anticorpi. Lancet Neurol 2008; 7(12): 1091-1098.
InFo NEUROLOGIA & PSICHIATRIA 2022; 20(3): 6-14