La carenza di ferro è la malattia da carenza più comune in tutto il mondo. In Europa, la prevalenza è del 5-10% ed è una delle cause più comuni di anemia, circa il 50%. Uno squilibrio tra la domanda e l’assunzione porta inizialmente a una carenza di ferro di deposito; se c’è un apporto insufficiente di precursori eritropoietici, questo porta a un’eritropoiesi con deficit di ferro, mentre l’emoglobina è ancora normale. Solo quando l’emoglobina scende al di sotto dei valori normali si parla di anemia da carenza di ferro.
La carenza di ferro è la malattia da carenza più comune in tutto il mondo. In Europa, la prevalenza è del 5-10% ed è una delle cause più comuni di anemia, circa il 50%. La carenza di ferro si divide in tre fasi. Uno squilibrio tra la domanda e l’assunzione porta inizialmente a una carenza di ferro di deposito (fase I), se l’apporto dei precursori eritropoietici è insufficiente, si verifica un’eritropoiesi con carenza di ferro (fase II), con emoglobina ancora normale. Solo quando l’emoglobina scende al di sotto dei valori normali (uomini adulti: 13 g/dl, donne: 12 g/dl) si parla di anemia da carenza di ferro (stadio III). Questa stadiazione si concentra principalmente sull’eritropoiesi, ma ogni nostra cellula ha bisogno di ferro. L’eritropoiesi viene alimentata in modo preferenziale in caso di carenza di ferro, ma questo significa anche che il ferro è già carente in altri sistemi prima che si manifesti l’anemia. I disturbi legati alla carenza di ferro possono presentarsi già negli stadi I e II.
Fisiologia e fisiopatologia del metabolismo del ferro
Il corpo di un adulto sano contiene 3 -5 g di ferro, la maggior parte del quale è sotto forma di ferro emoglobinico, un’altra percentuale come ferro di deposito (uomini adulti 500 -1000 mg, donne in premenopausa 200 – 400 mg) e solo una minima percentuale sotto forma di ferro plasmatico. Il nostro corpo ottiene la maggior parte del suo fabbisogno giornaliero di ferro riciclando dalle riserve interne di ferro, ma si affida all’assorbimento enterale per evitare un bilancio negativo. In una dieta normale ed equilibrata, l’assorbimento medio di 1-2 mg/giorno (circa il 5 -10% del ferro contenuto negli alimenti in una normale dieta mista) compensa la perdita fisiologica. Nelle donne durante il periodo mestruale, il bilancio del ferro diventa spesso negativo con una perdita giornaliera di ferro fino a 3 mg. Per mantenere l’omeostasi del ferro, è necessaria un’assunzione giornaliera di 8 mg (uomini) e 18 mg (donne in età fertile), a causa dell’assorbimento solo parziale del ferro [1]. La maggior parte del ferro alimentare viene espulso nelle feci.
La nostra alimentazione contiene ferro in diverse forme. Mentre il ferro della carne è costituito in gran parte da ferro bivalente ematico, nelle verdure e nei cereali è presente in forma trivalente. L’assorbimento avviene prevalentemente nel duodeno. Il ferro ematico derivato dalla carne viene assunto tramite un recettore (proteina portatrice di eme 1) sulla superficie degli enterociti. A livello intracellulare, il ferro viene scisso da un’emossigenasi e legato alla mobilferrina. Da qui, può essere utilizzato per i processi cellulari o rilasciato nel sangue tramite la ferroportina 1 sulla membrana basale degli enterociti. L’assorbimento del ferro ematico è meno suscettibile di interruzioni e più efficace rispetto all’assorbimento del ferro dalle verdure e dai prodotti a base di cereali. Il ferro trivalente deve prima essere convertito in ferro bivalente dal DCYTB (citocromo B duodenale). L’assorbimento negli enterociti avviene tramite il DMT-1 (trasportatore di metalli divalenti). 1), uno speciale trasportatore di ferro dipendente dal pH. Questo processo può essere ostacolato da numerose sostanze (tra cui antiacidi, calcio, ossalati, fosfati). Dagli enterociti, il ferro bivalente entra anche nel flusso sanguigno tramite la ferroportina 1-. Prima Rilasciato nel sangue portale, il ferro bivalente viene ossidato in trivalente dall’efestina o dalla coeruloplasmina e legato all’apo-transferrina formata nel fegato (apo-transferrina+2Fe3+ -> transferrina). In condizioni normali, il 16-45% delle molecole di transferrina nel plasma sono sature di ferro. L’assorbimento nelle cellule bersaglio avviene tramite i recettori della transferrina (TfR), il cui numero sulla superficie cellulare è regolato dal fabbisogno di ferro della rispettiva cellula.
L’immagazzinamento del ferro avviene prevalentemente attraverso la ferritina, che si trova in tutte le cellule e i fluidi del corpo. Rappresenta una riserva disponibile molto rapidamente e la sua concentrazione sierica si correla bene con le riserve di ferro disponibili negli individui sani. La regolazione dell’assorbimento del ferro dal cibo avviene tramite un ormone peptidico formato nel fegato, l’epcidina. Porta alla downregulation della DMT-1 e alla degradazione della ferroportina 1. L’innalzamento dell’epcidina provoca una diminuzione dell’assorbimento dal cibo e una diminuzione del rilascio dagli enterociti nel sangue portale.
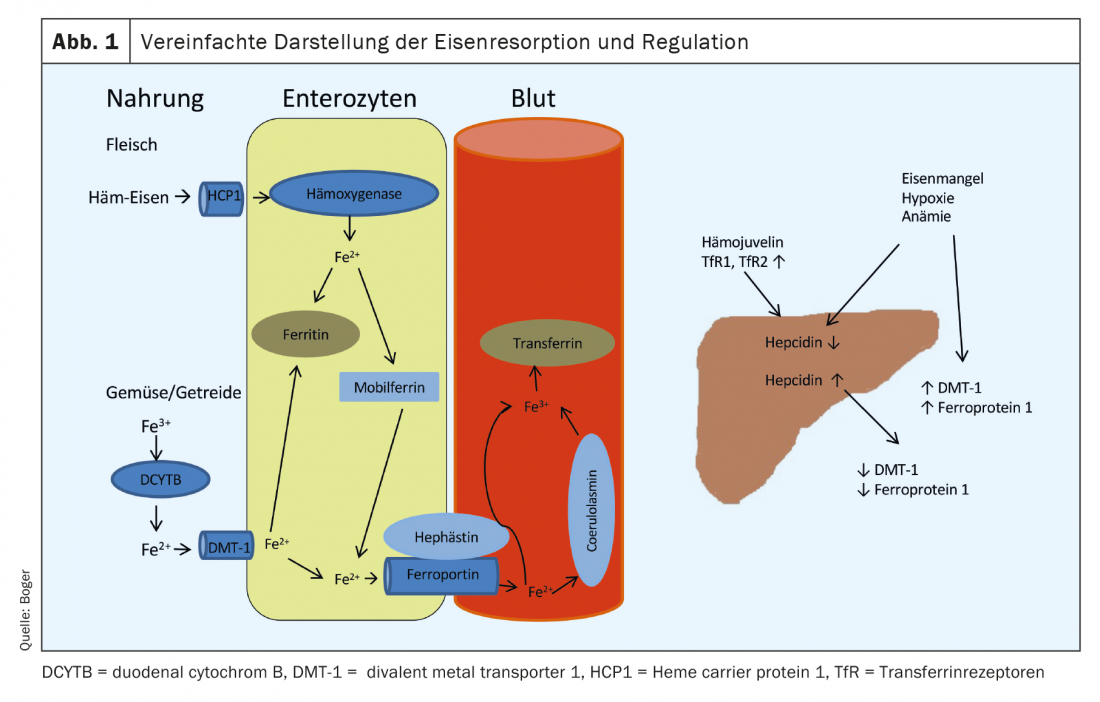
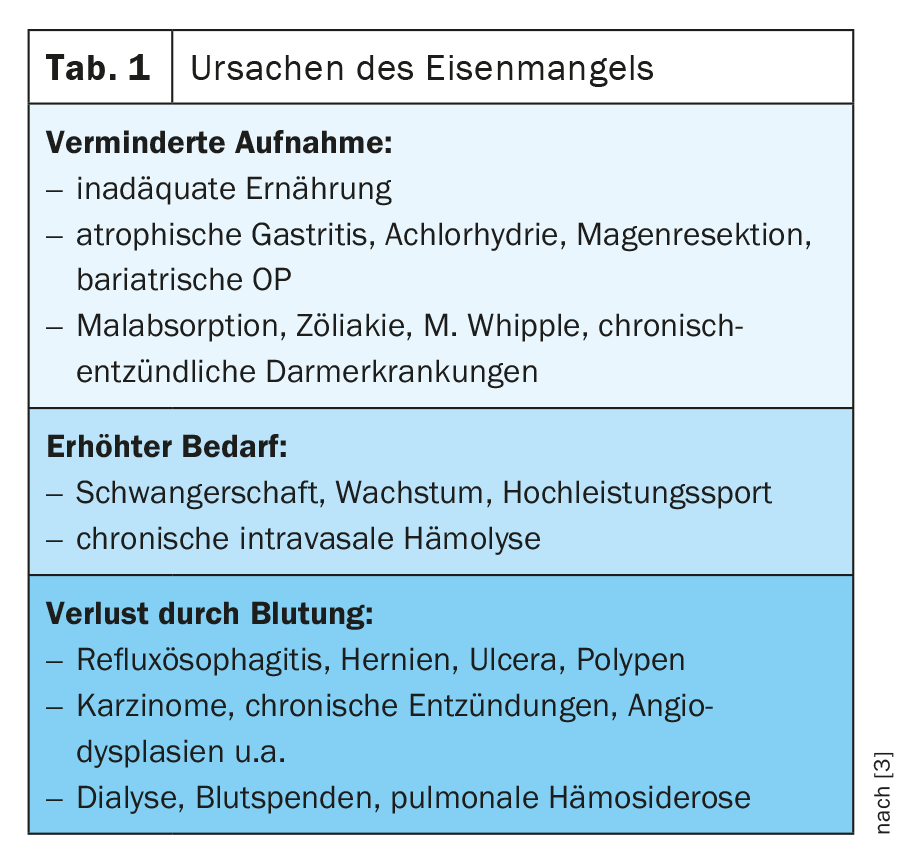
In presenza di anemia, carenza di ferro o ipossia, la produzione di epcidina nel fegato si riduce e aumenta l’espressione di DMT-1, DCYTB, efestina, ferroportina 1 e HCP1 negli enterociti [1] (Fig. 1). Una panoramica delle cause di carenza di ferro è riportata nella tabella 1 .
Carenza funzionale di ferro
Per il disturbo intrinseco dell’utilizzo del ferro, negli ultimi anni si è affermato il termine carenza funzionale di ferro. Il termine è stato sviluppato per la prima volta per l’anemia renale, ma oggi include anche l’anemia nelle malattie croniche (tumori, infezioni, malattie autoimmuni). Tra l’altro, il rilascio di citochine infiammatorie (ad esempio, interleuchina-1α, interleuchina-1β, interleuchina-6, fattore di necrosi tumorale-α) porta all’induzione dell’epcidina, che si traduce in un ridotto riassorbimento e in un alterato trasferimento interno alla proteina di trasporto transferrina e spiega così la ridotta saturazione della transferrina (TSAT) come risultato diagnostico di laboratorio di tendenza.
Diagnosi di carenza di ferro
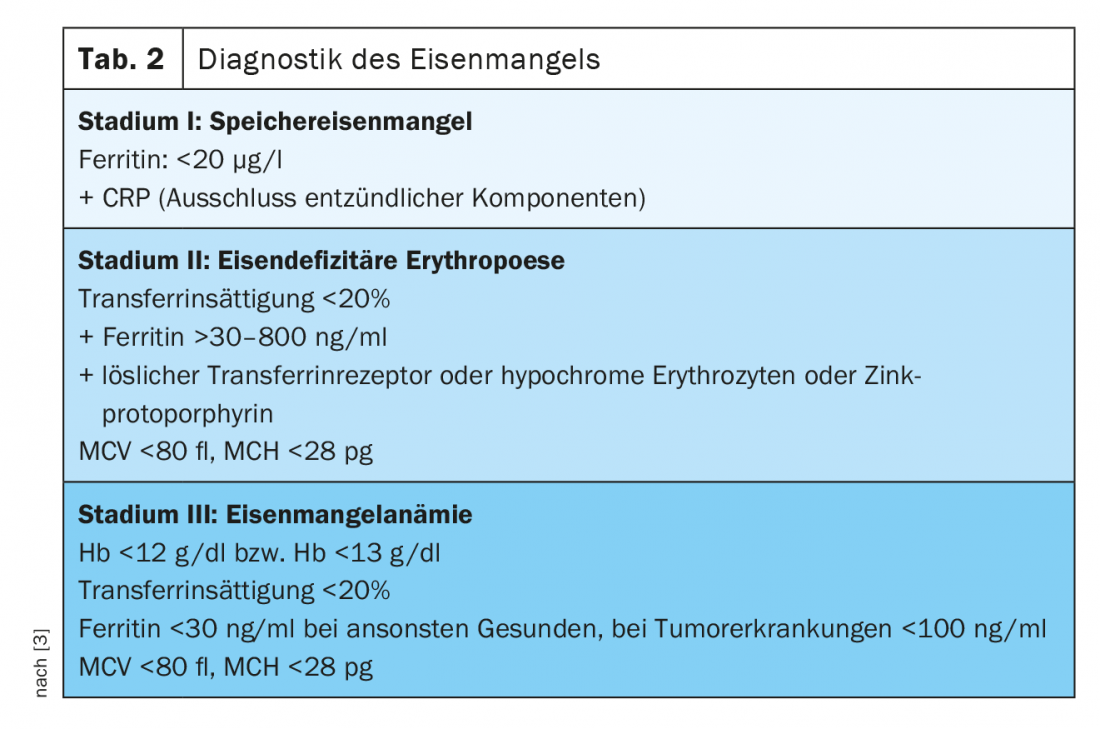
Stadio I (carenza di ferro di deposito)
La ferritina nel siero si correla con lo stato delle riserve di ferro nelle persone sane e può già diagnosticare la carenza di ferro nello -stadio I. Mentre si parla di carenza di ferro nelle persone sane quando il livello è inferiore a 20 µg/l, sappiamo che i pazienti con neoplasie solide e comprovata carenza di ferro possono avere livelli di ferritina da 100 a 800 µg/l, e in un quarto dei pazienti anche superiori a 800 µg/l [2].
Anche se la colorazione blu di Berlino dello striscio di midollo osseo, basata sulla proporzione di sideroblasti (eritroblasti con evidenza di granuli di ferro intracellulari), consente un’eccellente valutazione del contenuto di ferro, questo metodo diagnostico invasivo non è il metodo di scelta per una semplice carenza di ferro. Tuttavia, se si effettua una puntura in pazienti oncologici, in particolare a causa di un problema diverso, questa colorazione può essere effettuata anche se la causa dell’anemia non è chiara.
Stadio II (eritropoiesi con deficit di ferro)
La saturazione della transferrina (TSAT), come misura del ferro funzionale disponibile, è soggetta a fluttuazioni circadiane e può essere ridotta nei processi infiammatori, nonostante i livelli normali di ferritina. È un parametro della carenza funzionale di ferro (TSAT [%]=ferro sierico [µg/dl]/transferrina sierica [mg/dl]×70,9). In condizioni fisiologiche, fino al 45% delle molecole di transferrina sono cariche di ferro. Se la percentuale è inferiore al 20%, si deve ipotizzare una situazione di carenza di ferro.
La concentrazione dei recettori solubili della transferrina (sTfR) nel siero dipende dall’attività dell’eritropoiesi e dallo stato del ferro. Se c’è una carenza di ferro puramente accumulativa, è nella norma. Nell’eritropoiesi da carenza di ferro, i livelli sierici aumentano. Pertanto, servono molto bene come parametri per differenziare l’eritropoiesi con deficit di ferro e la carenza funzionale di ferro. Il cosiddetto indice TfR-F può essere calcolato dai valori del recettore solubile della transferrina e della ferritina sierica, il che consente una maggiore sensibilità e specificità rispetto a una dichiarazione di eritropoiesi con deficit di ferro. Un altro parametro per diagnosticare l’eritropoiesi da deficit di ferro è la percentuale di reticolociti ipocromici (HYPO). Con un apporto di ferro sufficiente o con una carenza di ferro di stadio I, la percentuale di eritrociti ipocromici è inferiore al 2,5%. Se questo valore è superiore al 10%, si tratta di una prova di eritropoiesi con deficit di ferro. Anche la determinazione del contenuto di emoglobina dei reticolociti (CHr) è un parametro molto precoce dell’eritropoiesi da carenza di ferro.
Un parametro non ancora ampiamente utilizzato nella pratica quotidiana è la protoporfirina di zinco (ZPP). Se non c’è ferro disponibile per la sintesi ematica, lo zinco viene invece metabolizzato e si forma la globina ZPP. La ZPP si forma a partire dalla fase II della carenza di ferro. Una misurazione molto economica mediante ematofluorimetria, che può essere utilizzata come diagnostica point-of-care, consente di diagnosticare e quantificare l’eritropoiesi da deficit di ferro, sebbene i diversi metodi di misurazione e la mancanza di standardizzazione rendano difficile un’ampia implementazione [3]. La misurazione dell’epcidina permette anche di differenziare la carenza assoluta di ferro dalla carenza funzionale di ferro nel contesto delle malattie croniche. In assenza di standardizzazione, questo parametro non viene utilizzato nella pratica clinica quotidiana.
Nello stadio III , con una concentrazione di Hb di <12 g/dl nelle donne e <13 g/dl negli uomini, c’è un’anemia manifesta con eritrociti ipocromici (MCH <28 pg) e microcitici (MCV <80 fl). In questo contesto, non di rado si riscontra una trombocitosi reattiva come espressione della reattività incrociata della trombopoiesi all’aumento dei livelli di eritropoietina (per una panoramica sulla diagnostica della carenza di ferro, vedere la Tabella 2).
Gli aspetti specifici del paziente oncologico
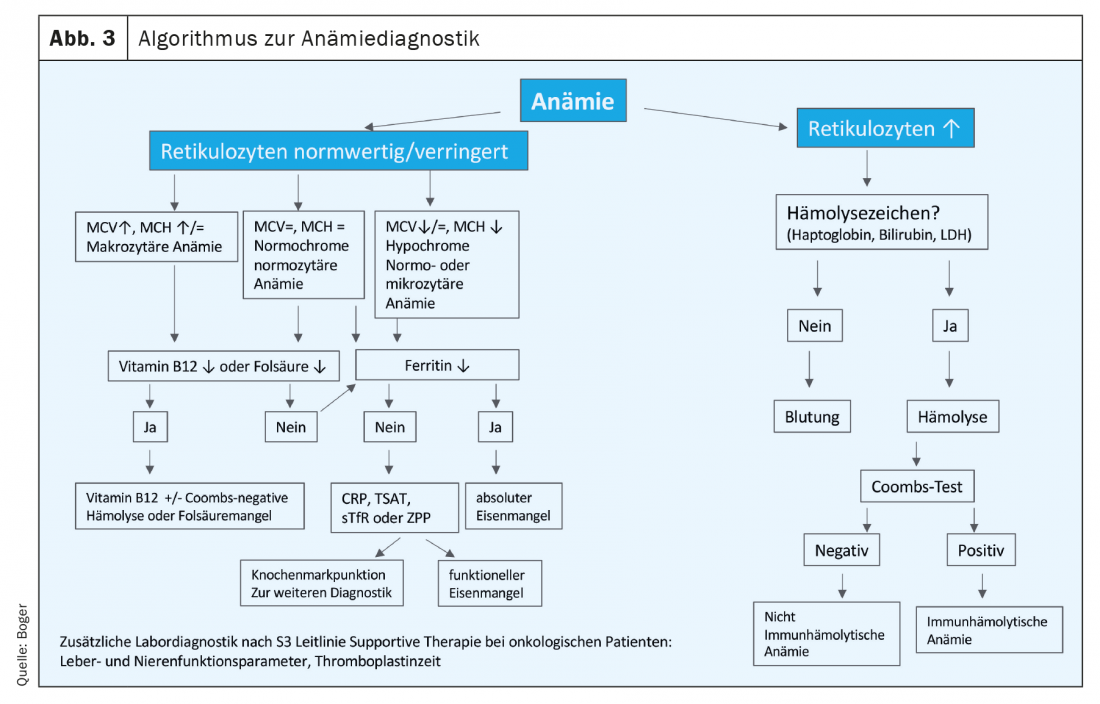
Nei pazienti oncologici, la carenza di ferro assoluta e funzionale si trova spesso sovrapposta a causa dell’infiammazione, della nutrizione disturbata e della perdita di sangue o del ridotto tempo di sopravvivenza degli eritrociti (Fig. 2).Nella linea guida tedesca S3 Terapia di supporto nei pazienti oncologici, si raccomanda una diagnosi appropriata già al momento della diagnosi iniziale. Devono essere chiarite anche altre cause di anemia non specifiche al tumore [4]. Un algoritmo per la diagnosi dell’anemia è riportato nella figura 3.
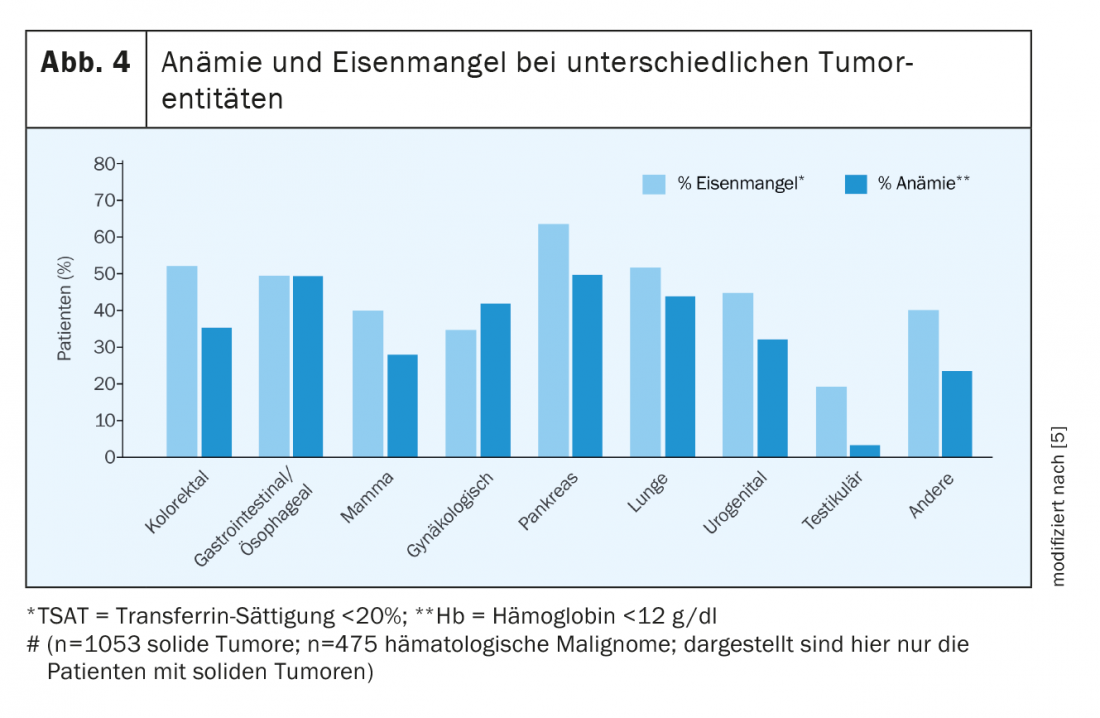
Già al momento della diagnosi, la metà dei pazienti con tumore presenta sia anemia che carenza di ferro. Sotto terapia, i numeri aumentano in modo significativo. Non tutti i tumori causano anemia o carenza di ferro nella stessa misura. In La Figura 4 offre una panoramica della prevalenza di diverse malattie tumorali [5,6].
L’emorragia cronica si verifica soprattutto nei tumori gastrointestinali o ginecologici. La perdita di sangue stimola l’eritropoiesi iperrigenerativa attraverso l’induzione di eritropoietina reattiva e quindi richiede più ferro. Se, inoltre, è presente una carenza funzionale di ferro nell’infiammazione cronica e l’eritropoiesi è anche inibita dalla terapia tumorale a base di farmaci o dalle radiazioni, l’eritropoietina è spesso elevata in presenza di una funzione renale normale, ma l’aumento non è sufficiente a compensare l’anemia multi-causale.
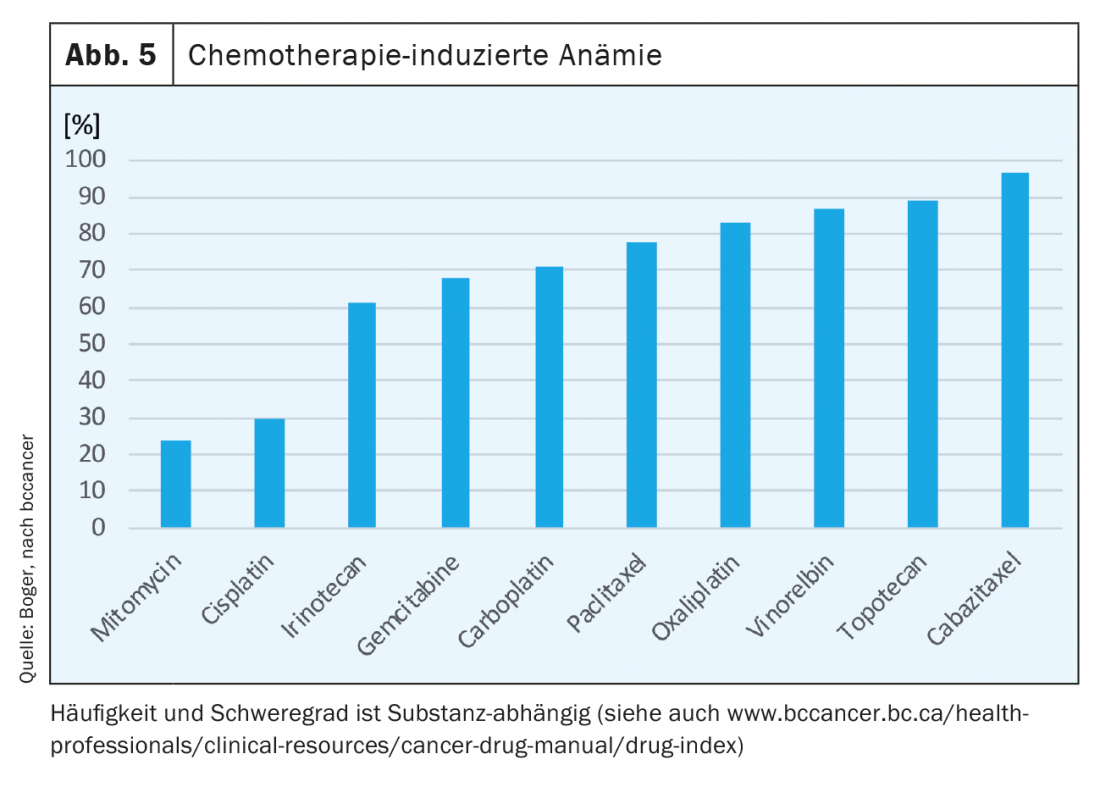
Fino al 75% di tutti i pazienti oncologici, l’anemia si verifica nel corso del trattamento. Con la sola radioterapia, a seconda dell’entità del tumore, fino al 50% dei pazienti. Gli agenti chemioterapici sopprimono l’eritropoiesi e, a seconda della sostanza, causano anemia (Fig. 5) . Con le terapie combinate si osserva un effetto additivo e con il numero di cicli si verifica spesso un aumento dell’anemia [7].
Terapia della carenza di ferro e dell’anemia sideropenica nei pazienti con tumore
Sostituzione del ferro
Una carenza assoluta di ferro è una chiara indicazione per la sostituzione. Per il calcolo del fabbisogno di ferro, si è affermato il calcolo secondo Ganzoni:
|
Deficit totale di ferro (mg) = [Soll-Hb – Patienten Hb (g/dl)] × peso corporeo (kg) × 2,4 + ferro di deposito* (mg) * |
Sostituzione orale
Per la sostituzione orale, sono disponibili preparazioni con ferro bivalente e trivalente. I dosaggi variano fino a 200 mg al giorno. Anche con un’ottima tolleranza, l’organismo può sopportare un massimo. Il 10% dei quali viene assorbito. I pazienti oncologici hanno spesso un fabbisogno molto elevato e di solito una carenza funzionale di ferro, motivo per cui la sostituzione orale provoca effetti collaterali inutili (tolleranza gastrointestinale) quando l’assorbimento è compromesso , senza reintegrare in modo efficiente le riserve di ferro. Prima di decidere la terapia sostitutiva orale, è necessario determinare lo stato di infiammazione e le possibili ulteriori controindicazioni alla sostituzione orale (ad esempio, resezione gastrica, disturbi da malassorbimento, costipazione cronica, scarsa aderenza alla terapia). Costipazione, ridotta aderenza alla terapia).
Le sostanze frequentemente utilizzate nell’integrazione orale sono il fumarato di ferro(II), il gluconato di ferro(II) e il solfato di ferro(II). Recentemente, sono apparse sul mercato sostanze alternative con un potenziale di assorbimento migliore e un profilo di tollerabilità più favorevole (ma un profilo di costo meno favorevole): complessi polisaccaridici di maltolo ferrico e formulazioni ferriche liposomiali [8].
Già 14 giorni dopo l’inizio della sostituzione, si dovrebbe verificare un aumento dell’emoglobina di ≥1 g/dl. In caso contrario, si deve passare a una preparazione endovenosa [9]. Dopo la normalizzazione dei livelli di emoglobina, la sostituzione orale deve essere continuata per almeno tre mesi per reintegrare le riserve di ferro.
Sostituzione endovenosa
La sostituzione per via endovenosa deve essere preferita nei pazienti con tumore con disturbi accertati dell’utilizzo del ferro e con eritropoiesi o anemia da carenza di ferro. Soprattutto in caso di terapia simultanea con sostanze stimolanti l’eritropoiesi, è consigliabile l’uso preferenziale di formulazioni endovenose per un’integrazione efficace [3].
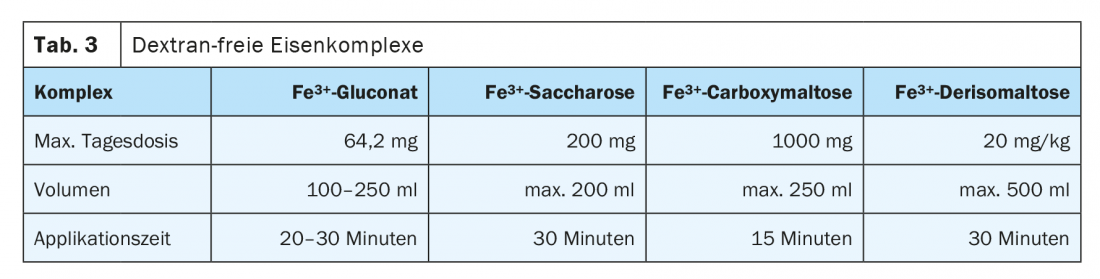
Esiste un rischio di reazione anafilattica con tutti i preparati di ferro per via parenterale, a causa dei partner che legano il Fe, ma è molto basso con le sostanze moderne. L’Agenzia Europea dei Medicinali (EMA) ha già stabilito nel 2013, in una procedura di valutazione del rischio, che i benefici superano i possibili rischi. Il rischio è maggiore con le preparazioni contenenti destrano, per cui sono da preferire le preparazioni senza destrano. Un profilo di effetti collaterali significativamente più favorevole esiste per il gluconato ferrico, l’idrossido ferrico di saccarosio e il carbossimaltosio ferrico. Si tratta di nanoparticelle dissolte colloidalmente. Questi vengono assorbiti e scomposti nel fegato e nella milza dal sistema reticoloendoteliale. Il ferro rilasciato viene immagazzinato o distribuito nell’organismo dalla transferrina. La somministrazione per via endovenosa deve avvenire preferibilmente come infusione breve. Un’applicazione troppo rapida può superare la capacità di legame della transferrina e causare sintomi di arrossamento. Il volume di applicazione, la quantità di ferro legato al complesso per infusione e il dosaggio singolo o multiplo differiscono in modo significativo e determinano la frequenza della terapia e gli intervalli di controllo. La Tabella 3 elenca diverse preparazioni senza destrano che possono essere somministrate per via endovenosa.
Trasfusione di concentrati di globuli rossi
L’indicazione alla trasfusione viene fatta in base alle condizioni cliniche, ai fattori di rischio del paziente, alla gravità dei sintomi dell’anemia, al valore di Hb (o ematocrito), alla natura acuta della perdita di sangue e alle possibilità di compensazione [4]. Nei pazienti con perdita di sangue acuta, tumore solido o emoblastosi, l’indicazione alla trasfusione deve essere verificata a partire da un valore di emoglobina ≤8 g/dl. I pazienti con anemia cronica a volte hanno valori di Hb compresi tra 6 e 8 g/dl senza alcun sintomo e quindi senza un’indicazione trasfusionale convincente. Nei pazienti con malattia cardiaca o polmonare concomitante, il livello di emoglobina deve essere stabilizzato a 10 g/dl.
Terapia con agenti stimolanti l’eritropoiesi
Nell’anemia indotta dalla chemioterapia, gli agenti stimolanti l’eritropoiesi (ESA) sono approvati per l’anemia sintomatica con un valore di Hb -≤10 g/dl [4]. La combinazione di ESA e integrazione di ferro per via endovenosa durante la chemioterapia può ridurre significativamente il numero di trasfusioni di sangue [10]. Il momento dell’integrazione di ferro dovrebbe precedere la terapia con ESA. Tuttavia, occorre considerare attentamente i rischi in termini di profilo di rischio trombofilico e il beneficio individuale della terapia con ESA per il paziente [11].
Altri approcci terapeutici per la carenza funzionale di ferro nei pazienti con tumore, come la terapia con androgeni o l’uso di antagonisti dell’epcidina e della proteina morfogenetica ossea (BMP), sono attualmente oggetto di ricerca clinica [12].
Sommario
La carenza di ferro e l’anemia sono difficili da considerare separatamente nei pazienti oncologici. Sia l’anemia che la carenza di ferro hanno solitamente diverse cause sottostanti. È quindi sempre importante escludere o trattare altre cause non specifiche del tumore. La maggior parte dei pazienti oncologici è a rischio di malnutrizione e un’indagine qualificata sullo stato nutrizionale e una consulenza regolare sulla nutrizione durante il trattamento oncologico dovrebbero essere effettuate in una fase iniziale. Tuttavia, la maggior parte dei pazienti sviluppa una carenza di ferro nonostante l’assunzione orale ottimizzata. In caso di carenza di ferro causata da emorragie croniche e infiammazioni croniche, l’aumentato fabbisogno dell’organismo non può e non deve essere soddisfatto dalla sostituzione orale.
La chemioterapia sopprime l’eritropoiesi e la secrezione di eritropoietina propria dell’organismo non è sufficiente a soddisfare i requisiti di stimolazione a un equilibrio eritropoietico negativo permanente. La terapia trasfusionale deve essere utilizzata solo per la correzione immediata dell’anemia (emorragia, rischio cardiocircolatorio) a causa degli effetti tossici e del potenziale prognostico negativo. L’integrazione di ferro per via endovenosa è la terapia preferita per prevenire o correggere l’anemia.
Messaggi da portare a casa
- Se la malattia maligna viene diagnosticata per la prima volta, è necessario eseguire un’analisi del substrato dell’eritropoiesi e una diagnostica dell’anemia.
- Hb, stato del ferro (TSAT, ferritina sierica) e CRP devono essere determinati all’inizio e prima di ogni ciclo di chemioterapia.
- La carenza funzionale di ferro nei pazienti oncologici è caratterizzata da un’alterata utilizzazione delle riserve intrinseche di ferro.
- Il ferro orale deve essere preso in considerazione solo nei pazienti con carenza assoluta di ferro (ferritina <30 ng/ml) e condizione non infiammatoria (CRP <5 mg/l).
- L’integrazione di ferro per via endovenosa è la terapia di ferro preferita nel paziente oncologico.
Letteratura:
- Finberg KE: Regolazione dell’omeostasi sistemica del ferro. Current opinion in hematology 2013; 20(3): 208-214.
- Ludwig HE, et al: Metabolismo del ferro e integrazione di ferro nei pazienti oncologici. Wien Klin Wochenschr 2015; 127(23-24): 907-919.
- Hastka J, et al: Carenza di ferro e anemia da carenza di ferro. Onkopedia Leilinien 2020; www.onkopedia.com/de/onkopedia/guidelines/eisenmangel-und-eisenmangelanaemie/@@guideline/html/index.html, consultato il 29.06.2020.
- Jordan K, et al.: Richtlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): Supportive Therapie bei onkologischen PatientenInnen – Langversion 1.3.2020; www.leitlinienprogrammonkologie.de/leitlinien/supportive-therapie, consultato il 29.06.2020.
- Ludwig H, et al: Prevalenza della carenza di ferro in diversi tumori e la sua associazione con lo scarso rendimento, lo stato di malattia e l’anemia. Annali di oncologia: rivista ufficiale della Società Europea di Oncologia Medica/ESMO 2013; 24(7): 1886-1892.
- Ludwig H, et al: L’European Cancer Anaemia Survey (ECAS): una grande indagine prospettica multinazionale che definisce la prevalenza, l’incidenza e il trattamento dell’anemia nei pazienti oncologici. Eur J Cancer 2004; 40(15): 2293-2306.
- Xu H, et al: Incidenza dell’anemia nei pazienti con diagnosi di tumori solidi sottoposti a chemioterapia, 2010-2013. Clin Epidemiol 2016; 8: 61-71.
- Farrag K, et al: Nuove opzioni per la sostituzione orale del ferro. Terapia farmacologica 2019; 37(4): 105-112.
- Okam MM, et al: Supplemento di ferro, risposta nell’anemia da carenza di ferro: analisi di cinque studi. The American journal of medicine 2017; 130(8): 991 e991-991 e998.
- Bastit L, et al: Studio randomizzato, multicentrico, controllato che confronta l’efficacia e la sicurezza di darbepoetina alfa somministrata ogni 3 settimane con o senza ferro per via endovenosa nei pazienti con anemia indotta da chemioterapia. Journal of clinical oncology: official journal of the American Society of Clinical Oncology 2008; 26(10): 1611-1618.
- Aapro M, et al: Gestione dell’anemia e della carenza di ferro nei pazienti con cancro: Linee guida di pratica clinica ESMO. Annali di oncologia: rivista ufficiale della Società Europea di Oncologia Medica/ESMO 2018; 29(Suppl 4): iv96-iv110.
- Gilreath JA, Rodgers GM: Come tratto l’anemia da cancro. Blood 2020; doi: 10.1182/blood.2019004017.
PRATICA GP 2020; 15(10): 6-11