Ancora una volta, la Conferenza europea sul cancro al polmone si è svolta a Ginevra. Anche questa volta, l’attenzione si è concentrata principalmente sul cancro al polmone non a piccole cellule. Le terapie che mirano alle varianti mutate e non mutate dell’EGFR sono in fase di studio da sole o in combinazione con la chemioterapia. Molti di questi farmaci sono già approvati nell’UE e negli USA. Inoltre, un approccio innovativo dal campo dell’immunologia era in discussione con una terapia nel campo del mesotelioma.
Stanno accadendo delle cose nel trattamento del carcinoma polmonare non a piccole cellule (NSCLC). Da un lato, i risultati degli studi su osimertinib sono stati discussi al congresso. Si tratta di un potente inibitore irreversibile della tirosin-chinasi EGFR di terza generazione, già approvato negli Stati Uniti e nell’Unione Europea (non ancora in Svizzera). Due abstract di recente pubblicazione hanno confermato la sua efficacia nel NSCLC mutato da EGFR, in particolare in presenza di una mutazione T790M. Un aggiornamento di AURA P1 (fase I) e i dati raggruppati di AURA extension e AURA 2 (entrambi studi di fase II) hanno mostrato i seguenti risultati per osimertinib alla dose raccomandata di 80 mg/d (orale):
- Dei 63 pazienti in AURA P1, il 71% ha avuto una risposta obiettiva che è durata una mediana di 9,6 mesi. La sopravvivenza libera da progressione è stata di 9,7 mesi. Gli effetti collaterali causali più comuni comprendevano rash cutaneo (37%, nessuno di grado 3) e diarrea (35%, di cui il 2% di grado 3).
- Dei 411 pazienti nei due studi di fase II raggruppati, il 66% ha avuto una risposta obiettiva (secondo una revisione indipendente) che è durata una mediana di 12,5 mesi. La sopravvivenza libera da progressione è stata di 11 mesi. Dopo un anno, il 47,5% dei partecipanti era ancora libero da progressione. Anche in questo caso, l’eruzione cutanea (41%, compreso l’1% di grado 3) e la diarrea (38%, compreso l’1% di grado 3) sono stati tra gli effetti collaterali causali più comuni.
I dati della fase II in comune confermerebbero chiaramente i risultati di AURA P1 e delle pubblicazioni precedenti, hanno detto i relatori. Nei pazienti con NSCLC avanzato e mutazione EGFR T790M che sono progrediti con una precedente terapia con EGFR TKI, osimertinib 80 mg/d fornisce un alto tasso di risposta per una durata relativamente lunga, con un’incoraggiante sopravvivenza libera da progressione (soprattutto rispetto ai quattro-cinque mesi della chemioterapia) e un profilo di effetti collaterali gestibile.
Secondo gli autori, la diagnostica molecolare della mutazione T790M dovrebbe essere ormai standard. I dati dimostrerebbero chiaramente che i pazienti con un meccanismo di resistenza corrispondente beneficiano di osimertinib.
Osimertinib è efficace anche in prima linea
La seconda presentazione ha mostrato i dati di due coorti di fase I con osimertinib alla dose di 80 o 160 mg/d, questa volta somministrati come terapia di prima linea, cioè in 60 pazienti naïve alla terapia. Si tratta anche di un aggiornamento dello studio AURA. I pazienti avevano un NSCLC mutato in EGFR localmente avanzato o metastatico (cinque di loro erano T790M-positivi). Il follow-up mediano è stato di 16,6 mesi. Il tasso di risposta obiettiva complessiva è stato del 77% (67% nella coorte da 80 mg e 87% nella coorte da 160 mg). I pazienti sono rimasti liberi da progressione per una mediana di 19,3 mesi. Dopo un anno e mezzo, un totale di 55% risp. nessuna progressione nel 57% (80 mg) e nel 53% (160 mg) a seconda della coorte.
Gli eventi avversi più comuni sono stati diarrea (60% e 87%, rispettivamente, di cui 0% e 7% di grado 3 o superiore), stomatite (43% e 50%, rispettivamente, di cui 0% e 3% di grado 3 o superiore) e paronichia (30% e 53%, rispettivamente, di cui 0% e 7% di grado 3 o superiore). Al 10% (80 mg) risp. Il 47% (160 mg) dei pazienti ha dovuto ridurre la dose per tenere sotto controllo gli effetti collaterali.
L’assunzione di osimertinib modifica la biologia del tumore?
Osimertinib ha mostrato un potenziale anche nel trattamento di prima linea, hanno concluso gli autori. Si tratta di uno dei migliori tassi di risposta complessiva raggiunti con le terapie di prima linea per il NSCLC mutato in EGFR, e anche la sopravvivenza libera da progressione supera di gran lunga l’esperienza con i corrispondenti farmaci di prima e seconda generazione (circa 10-13 mesi). Molti pazienti non hanno ancora mostrato progressione e continuano a beneficiare di osimertinib.
Inoltre, nei soggetti con malattia progressiva, la mutazione T790M non sembra essere responsabile della resistenza, secondo i dati iniziali. È possibile che l’uso in prima linea di osimertinib modifichi la biologia del tumore. Il profilo di sicurezza è buono, soprattutto al dosaggio inferiore (approvato); un tasso del 10% di pazienti con riduzioni della dose è considerato basso.
Ulteriori studi in preparazione
L’inibizione dell’EGFR è attualmente lo standard di cura per i pazienti affetti da NSCLC con mutazioni attivanti l’EGFR. Attraverso la mutazione T790M, il 50-60% dei pazienti sviluppa resistenza al trattamento. Osimertinib è particolarmente utile per questi pazienti, in quanto inibisce in modo potente le mutazioni EGFR originali (esone 19 e 21), ma anche la mutazione EGFR T790M. Con osimertinib, la resistenza può essere ritardata, il tumore apparentemente deve cercare nuovi meccanismi di resistenza oltre alla mutazione EGFR T790M. Per fare chiarezza sui vantaggi dell’inibitore di terza generazione in prima linea, è ora necessario uno studio di fase III con oltre 500 pazienti, in cui osimertinib viene confrontato con erlotinib e gefitinib. I risultati sono attesi tra circa un anno e mezzo.
Necitumumab – i pazienti con tumori che esprimono l’EGFR ne traggono i maggiori benefici
Oltre a osimertinib, sono stati presentati nuovi dati su necitumumab. Questo anticorpo monoclonale ha come bersaglio anche l’EGFR e viene somministrato insieme alla chemioterapia (gemcitabina e cisplatino) nei pazienti NSCLC con carcinoma a cellule squamose avanzato. Necitumumab è già approvato negli Stati Uniti e nell’Unione Europea.
I dati presentati al congresso provengono dallo studio SQUIRE (fase III) e riguardano il sottogruppo di pazienti con tumori che esprimono EGFR (95% della popolazione valutata [n=982]). Mentre il 5% dei pazienti senza proteina EGFR non ha mostrato alcun beneficio, il 95% con tumori che esprimono EGFR ha mostrato un miglioramento significativo della sopravvivenza globale e libera da progressione, rispettivamente del 21% e del 16% (rispetto alla sola chemioterapia) – un beneficio leggermente maggiore rispetto alla popolazione generale. Dato il meccanismo d’azione del necitumumab, si tratta di un risultato ovvio: in assenza di recettore e quindi di bersaglio, il farmaco non può legarsi. Secondo l’EMA, necitumumab è quindi approvato solo per i pazienti con tumori che esprimono EGFR, mentre l’FDA ha deciso in base alla popolazione totale di SQUIRE e non ha specificato ulteriormente l’approvazione.
Anche questa analisi di sottogruppo non consente di trarre una conclusione definitiva, poiché il gruppo di pazienti senza tumori che esprimono l’EGFR era chiaramente troppo piccolo (5% o solo 47 pazienti) e il disegno dello studio non era rivolto a questi pazienti. Bisogna attendere studi più ampi per poter dire con certezza se anche i pazienti con tumori EGFR-negativi traggono beneficio dal necitumumab o meno.
Un batterio aiuta a combattere il mesotelioma?
Il mesotelioma pleurico maligno è una malattia rara ma molto aggressiva con una prognosi infausta. Il trattamento è difficile e attualmente consiste nella chemioterapia con pemetrexed e platino come standard. Si ottengono tassi di risposta di circa il 30%, ma il beneficio in termini di sopravvivenza è basso. Sono quindi necessari nuovi approcci terapeutici. Una di queste promette l’immunoterapia con un batterio vivo chiamato CRS-207, una forma attenuata di Listeria monocytogenes con due delezioni geniche, per ridurre la patogenicità. Il batterio è stato ingegnerizzato per esprimere la mesotelina, un antigene che è sovraespresso da vari tumori, compreso il mesotelioma, ed è importante per la sopravvivenza delle cellule. Si pensa quindi che il CRS-207 induca una risposta antimesotelina e quindi una risposta immunitaria endogena, adattativa e specifica del tumore. Insieme alla chemioterapia, viene alterato il microambiente tumorale e viene resa possibile l’uccisione immunomediata delle cellule tumorali.
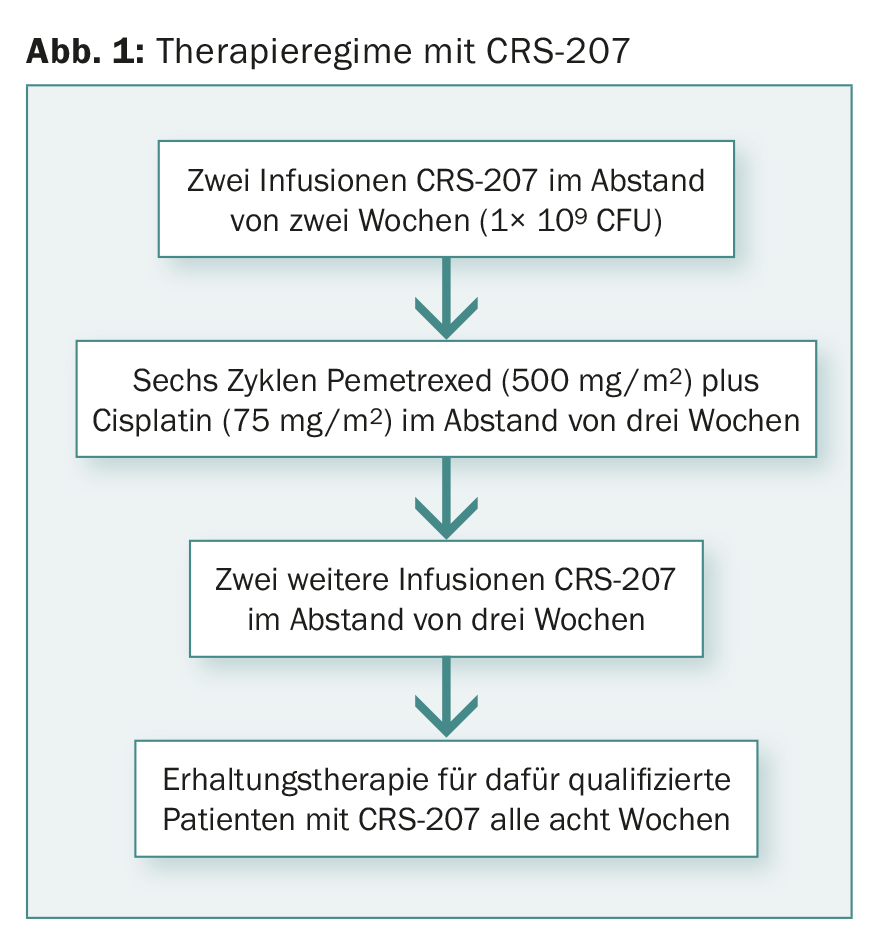
I pazienti naïve alla chemioterapia con plauramesotelioma avanzato e non resecabile hanno partecipato allo studio di fase Ib. Al momento della presentazione, sono stati valutati i dati di 38 pazienti. La Figura 1 mostra il regime terapeutico.
L’immunoistochimica ha rilevato un aumento dei linfociti infiltranti il tumore dopo il trattamento con CRS. Dopo un follow-up mediano di 9,4 mesi, il 59% delle persone trattate ha mostrato una risposta parziale. Nel 35%, la malattia era stabile. Insieme, questo dà un tasso di controllo della malattia del 94%. In media, i pazienti hanno vissuto 8,5 mesi senza progressione.
Nessun effetto collaterale grave o decesso è stato associato al trattamento. Febbre, abbassamento della temperatura/rigore, ipotensione, nausea e vomito sono stati segnalati con maggiore frequenza (grado 1 e 2). La maggior parte degli effetti collaterali erano legati all’infusione stessa e si sono attenuati dopo 24 ore.
La risposta immunitaria viene effettivamente stimolata
Una risposta di quasi il 60% con un tasso di controllo complessivo della malattia superiore al 90% è stata incoraggiante, hanno riassunto i relatori. Inoltre, il nuovo approccio non solo ha misurato i linfociti infiltranti il tumore, ma anche i cambiamenti corrispondenti nelle cellule immunitarie circolanti e nei biomarcatori del siero. Ad esempio, è stato misurato un aumento dei macrofagi, delle cellule CD8+ infiltranti e delle cellule natural killer. La risposta immunitaria mirata, specifica e non specifica, con il conseguente controllo sinergico del tumore in combinazione con la chemioterapia, potrebbe quindi essere effettivamente avviata.
La terapia sarà ora ulteriormente studiata in studi di fase III, poiché sembra produrre risultati significativamente migliori rispetto alla sola chemioterapia. Anche il profilo di sicurezza e tollerabilità del nuovo approccio è sorprendentemente buono; non sembrano verificarsi tossicità cumulative.
Fonte: Conferenza europea sul cancro del polmone ELCC 2016, 13-16 aprile 2016, Ginevra.
InFo ONCOLOGIA & EMATOLOGIA 2016; 4(4): 30-32