Al congresso DGHO di Vienna, sono stati affrontati vari aspetti nella pratica clinica del carcinoma polmonare non a piccole cellule (NSCLC), del carcinoma a cellule renali (RCC) e della leucemia mieloide cronica. In particolare, è stata discussa la situazione attuale della ricerca sui nuovi inibitori della tirosin-chinasi, crizotinib, sunitinib e bosutinib.
Il tumore al polmone non a piccole cellule (NSCLC) di solito è asintomatico per un lungo periodo di tempo. Più della metà dei pazienti è già in fase avanzata quando riceve la prima diagnosi.
“La terapia farmacologica per il NSCLC metastatico non è attualmente molto efficace, i classici citostatici sono stati esauriti. Il tempo di sopravvivenza negli studi attuali senza biologici è di 10-12 mesi”, afferma il Prof. Norbert Frickhofen, Wiesbaden, Germania. “Tuttavia, la genetica è ben compresa. L’ALK traslocato è un potente oncogene e un fattore chiave nella carcinogenesi in una parte dei pazienti con NSCLC. Di solito si verifica con il partner di fusione EML4, ma ci sono anche partner più rari come KIF5B e TFG. Nel NSCLC con un gene di fusione ALK, l’inibizione mirata è quindi una buona opzione terapeutica, perché la fusione descritta comporta l’attivazione costitutiva della chinasi ALK”.

Crizotinib provoca una tale inibizione della tirosin-chinasi ALK. È un’aminopiridina orale che blocca anche MET e ROS1. In Svizzera è approvato come Xalkori®. L’FDA l’ha autorizzato nel 2011 per il NSCLC localmente avanzato o metastatico ALK-positivo (valutato da un test approvato dall’FDA). L’EMA l’ha approvato nel 2012 come terapia per il NSCLC ALK-positivo pre-trattato localmente avanzato o metastatico.
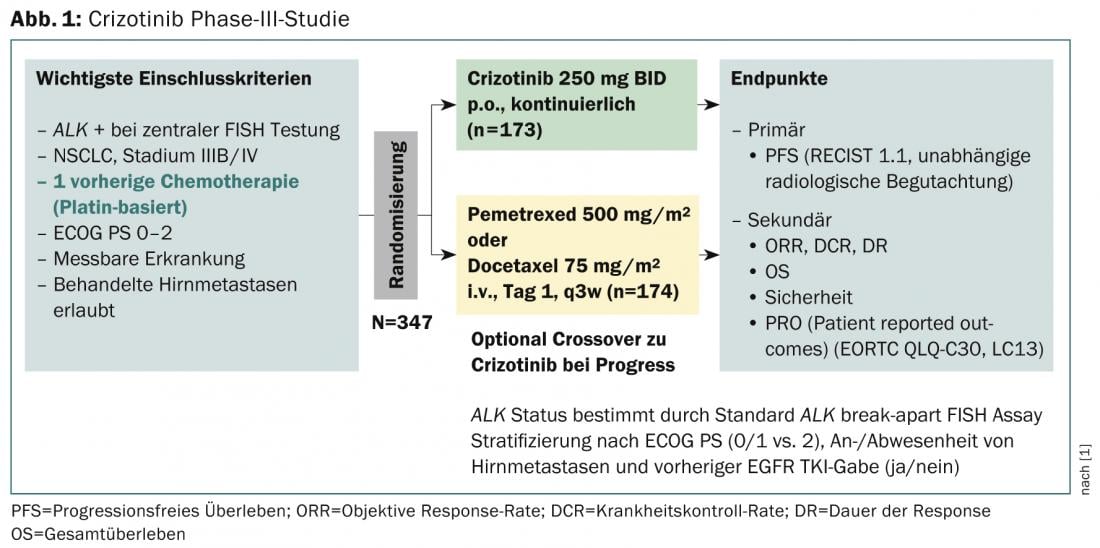
Uno studio di fase III con l’endpoint primario della sopravvivenza libera da progressione (RECIST 1.1, valutazione radiologica indipendente) ha esaminato l’efficacia dopo la pre-terapia (Fig. 1) [1]. Conclude che crizotinib è superiore alla chemioterapia standard nei pazienti con NSCLC ALK-positivo precedentemente trattati. La sopravvivenza mediana libera da progressione è stata di 7,7 mesi nel gruppo crizotinib (n=173) e di tre mesi nel gruppo chemioterapia (n=174); i risultati sono statisticamente significativi (p<0,001). Anche i tassi di risposta sono stati significativamente più alti con crizotinib (65 vs. 20%, p<0,001) e il tempo mediano alla risposta è stato più rapido (6,3 vs. 12,6 settimane). Tuttavia, un’analisi ad interim non ha mostrato un miglioramento significativo della sopravvivenza globale. Gli effetti collaterali più comuni sono stati disturbi visivi, effetti collaterali gastrointestinali e aumento dei livelli di aminotransferasi epatica. Nel complesso, i pazienti che hanno assunto crizotinib rispetto alla chemioterapia hanno notato una maggiore riduzione dei sintomi del tumore al polmone e un maggiore miglioramento della qualità di vita complessiva.
Crizotinib nella pratica
In pratica, la domanda è: chi dovrebbe essere testato per ALK? “La risposta è: ogni paziente per il quale l’inibizione di ALK è un’opzione terapeutica. La diagnostica di ALK procede attraverso lo screening IHC e lo screening FISH. Per quanto riguarda gli effetti collaterali, i disturbi visivi come i traccianti nel campo visivo periferico con luce borderline, gli oggetti che si bloccano, i lampi di luce senza riferimento o le inversioni di contrasto sono funzionali e non critici. L’effetto collaterale più critico è l’epatotossicità, che raggiunge il grado 3/4 nel 16%, che può provocare la morte e che quindi deve essere controllata attentamente e affrontata rapidamente. Se si verifica un aumento dell’alanina aminotransferasi (ALT) o dell’aspartato aminotransferasi (AST) di grado 3 o 4 e della bilirubina totale ≤grado 1, si raccomanda l’interruzione fino al recupero a ≤grado 1 o al livello basale, quindi riprendere con 2×200 mg/d. Se anche la bilirubina totale sale al grado 2, 3 o 4 (in assenza di colestasi o emolisi), è necessario interrompere la terapia”, dice il Prof. Frickhofen. “Nel complesso, la terapia specifica con crizotinib è efficace e tollerabile nel NSCLC ALK-positivo”.
Opzioni per il mRCC
“Le possibilità di una terapia per il carcinoma a cellule renali metastatizzato devono essere esaurite in modo ottimale. In concreto, questo significa un trattamento coerente con una sostanza per il maggior tempo possibile e il raggiungimento della migliore remissione possibile. Inoltre, la seconda linea dovrebbe essere già considerata nella terapia di prima linea. La gestione degli effetti collaterali deve essere ottimizzata e si deve promuovere l’educazione e il coinvolgimento del paziente e dei co-terapeuti (medici di base)”, afferma il PD Dr. med. Jochen Casper, Oldenburg.
Per la prima linea, sunitinib, bevacizumab più IFN e pazopanib possono essere presi in considerazione se c’è un’istologia a cellule chiare e una prognosi buona/intermedia. Sebbene non si tratti di uno studio comparativo testa a testa, il dottor Casper ha dimostrato che i tre fattori di sopravvivenza libera da progressione e globale, nonché la risposta, tendono ad essere migliori con sunitinib (Sutent®) rispetto alle altre opzioni terapeutiche, sulla base di diversi studi randomizzati di fase III in contesti a rischio basso e intermedio. Un’analisi retrospettiva [2] su sunitinib conclude anche che la risposta è correlata alla sopravvivenza globale. Era significativamente più alta nei responder, con una lunga sopravvivenza globale anche nei responder tardivi.
“Non solo la contrazione del tumore è correlata alla sopravvivenza globale sia in prima che in seconda linea, ma anche la risposta e l’entità della risposta sono importanti. Per quanto è stato studiato, questo effetto è indipendente dalla terapia utilizzata (inibitore della tirosin-chinasi [TKI], mTOR, citochina). L’inclusione della terapia di prima linea o la giusta sequenza nella scelta del trattamento di seconda linea possono avere un impatto significativo sulla sopravvivenza globale. Sono necessari ulteriori studi in quest’area. Ma l’obiettivo deve sempre essere la sopravvivenza globale, che è migliorata in modo significativo dall’introduzione dei TKI”, conclude il dottor Casper.
Ottimizzare la terapia con TKI anche nella CML
Il PD Dr. med. Philipp le Coutre, Berlino, ha parlato della leucemia mieloide cronica (LMC). Un nuovo inibitore della tirosin-chinasi approvato dalla FDA nel 2012 per il trattamento della CML si chiama bosutinib. Viene utilizzato nei pazienti per i quali altri TKI non funzionano o sono scarsamente tollerati. In Europa, il principio attivo è stato approvato in modo condizionale dalla Commissione Europea nel 2013 come medicinale per il trattamento di una malattia orfana (non ancora approvato in Svizzera).
“Questa nuova opzione terapeutica potrebbe offrire una potenziale alternativa nei casi di risposta inadeguata e di resistenza, di comorbidità o fattori di rischio specifici del paziente e di intolleranza alle terapie precedenti”, ha concluso la presentazione il dottor le Coutre.
Fonte: “Evidenza e pratica clinica in NSCLC, RCC e CML”, simposio satellite di Pfizer Pharma GmbH al Congresso DGHO, 18-22 ottobre 2013, Vienna.
Letteratura:
- Shaw AT, et al: Crizotinib rispetto alla chemioterapia nel carcinoma polmonare ALK-positivo avanzato. N Engl J Med 2013; 368: 2385-2394.
- Molina AM, et al: Risposta obiettiva di Sunitinib nel carcinoma a cellule renali metastatico: analisi di 1059 pazienti trattati in studi clinici. Eur J Cancer 2013 Sep 16. pii: S0959-8049(13)00789-2. doi: 10.1016/j.ejca.2013.08.021. [Epub ahead of print].
InFo Oncologia & Ematologia 2014; 2(2): 36-38











