In occasione del Grande Aggiornamento SGIM a Interlaken, sono stati discussi i problemi e le sfide più comuni che i medici di base devono affrontare quando si occupano di pazienti affetti da linfoma. È difficile dare nomi significativi: come si fa a dare un nome alle oltre 70 entità di linfomi maligni in modo che rimanga comprensibile per il paziente e i suoi familiari? Anche la diagnosi e il follow-up sono di competenza del medico di base.
Il Prof. Dr. med. Andreas Lohri dell’Ospedale Cantonale di Basilea ha aperto la sua presentazione con i dati epidemiologici: “I registri svizzeri dei tumori contano circa 1600 linfomi maligni all’anno, un buon terzo dei casi si conclude in modo fatale. Questo fa sì che i linfomi siano insieme uno dei tipi di cancro più diffusi, ma se si segue la classificazione dell’OMS, questo gruppo si divide in più di 70 entità diverse”.
Oltre il 70% dei pazienti affetti da linfoma di Hodgkin sono liberi da malattia dopo dieci anni; per i linfomi a cellule B, che sono i linfomi più comuni, la percentuale è del 40%, e per le varianti a cellule T solo del 20%. Tra il 2001 e il 2010, ci sono stati in totale 16.000 nuovi casi di linfoma, di cui circa 6000 pazienti sono sopravvissuti alla malattia.
“Se si vuole dare un nome all’entità specifica, diventa difficile. Mentre è ancora relativamente chiaro nel caso del linfoma di Hodgkin, il medico di base di solito non sa quale nome dare al linfoma diffuso a grandi cellule B (DLBCL), per esempio, in modo che la condizione sia comprensibile anche per il paziente e i suoi familiari. Di solito poi ricorre al termine, in realtà obsoleto, di “linfoma non-Hodgkin”. L’organizzazione svizzera per i pazienti affetti da linfoma e i loro familiari fornisce quindi al paziente informazioni specifiche sui dodici linfomi più comuni, compresi i nomi”, afferma il Prof. Lohri.
Riconoscerebbe un linfoma?
I sintomi possono essere poco chiari o portare nella direzione sbagliata. Un’indagine mondiale che ha coinvolto 1606 pazienti con diverse patologie linfatiche ha mostrato che circa il 50% si è recato dal medico per la prima volta perché aveva comunque un appuntamento di controllo, o perché in generale non si sentiva bene. “Quindi i sintomi iniziali sono piuttosto aspecifici e lo studio ha anche mostrato che ci sono voluti più di cinque mesi perché il 30% dei pazienti ricevesse una diagnosi corretta dalla prima visita dal medico”, ha spiegato il Prof. Lohri. “Circa la metà di tutti i linfomi sono extranodali e presentano un’ampia varietà di sintomi: neurologici come nei linfomi del sistema nervoso centrale, cutanei come nei linfomi a cellule T, o renali e cardiaci nei linfomi che producono amiloide. I tipici sintomi B si manifestano piuttosto tardi, ma anche prima, alcuni pazienti lamentano stanchezza e depressione”.
Una diagnosi corretta, preferibilmente fatta in collaborazione con uno specialista, è quindi fondamentale. Fondamentalmente, questo include:
- un’anamnesi medica (sintomi B, anamnesi familiare)
- un laboratorio (Hb, Lc, Tc, CRP, EBV, HBV, HCV, HIV, Toxoplasma, Bartonella)
- uno stato (linfonodi, reparti, dimensioni della milza, fegato, ORL, pelle)
- una biopsia (sono disponibili diversi esami dei tessuti: IHC, FACS, citogenetica, PCR, FISH).
- imaging.
“La PET fornisce dati molto buoni sulla progressione della malattia, dà indicazioni sulla prognosi e facilita le decisioni sul trattamento”, afferma il Prof. Lohri.
In che modo il medico di famiglia accompagna la terapia?
Una volta confermata la diagnosi, il trattamento viene solitamente effettuato dallo specialista; il medico di famiglia può occuparsi dell’emocromo intermedio e della somministrazione di fattori di crescita e antibiotici.
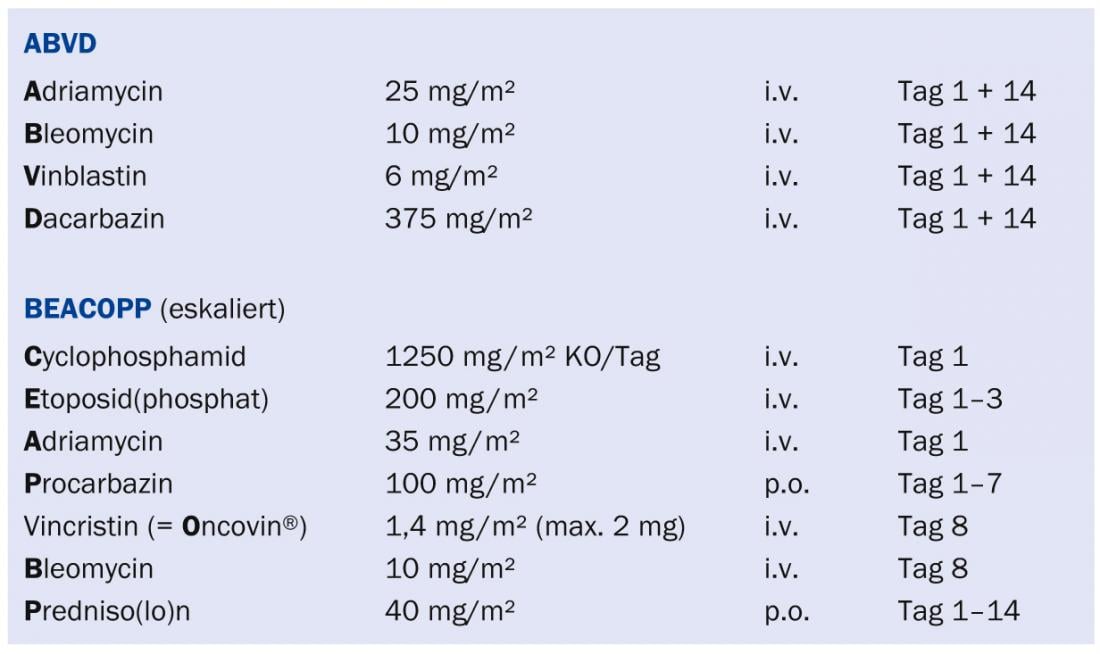
“Gli algoritmi terapeutici dovrebbero essere pianificati in modo ottimale in una conferenza interdisciplinare. Fondamentalmente, la terapia mira a curare il paziente con un regime il più possibile non tossico e che non provochi effetti collaterali in seguito. Questo obiettivo non è stato raggiunto finora. Sono quindi necessarie nuove vie di ricerca per ottimizzare ulteriormente il trattamento. Tuttavia, non bisogna dimenticare i grandi progressi compiuti con i regimi terapeutici attualmente utilizzati (soprattutto con il regime ABVD per il linfoma di Hodgkin limitato e il regime BEACOPP per il linfoma di Hodgkin avanzato) (vedere riquadro) . Per i linfomi a cellule B e molti altri linfomi, il regime R-CHOP (con l’anticorpo rituximab) si è dimostrato molto efficace. Per le forme indolenti, le combinazioni di bendamustina stanno diventando sempre più importanti. Questo farmaco ha un eccellente indice terapeutico; le sue principali tossicità sono le citopenie e le eruzioni cutanee. Le radioterapie sono oggi meno utilizzate nel contesto curativo, perché gli effetti tardivi possono essere considerevoli”, ha spiegato il Prof. Lohri.
Per quanto tempo sono necessari gli esami di follow-up?
Prima del 2000, molti pazienti affetti da Hodgkin hanno ricevuto dosi di radiazioni, alcune delle quali elevate. Secondo studi recenti, l’irradiazione mediastinica aumenta significativamente il rischio di malattia cardiaca da 10 a 25 anni dopo il trattamento [1]. Poiché il medico di base è responsabile del follow-up dei cosiddetti “sopravvissuti al linfoma”, ha anche il ruolo decisivo di riconoscere e diagnosticare correttamente tali complicazioni tardive.
Nel follow-up dei pazienti irradiati, l’American College of Radiology raccomanda lo screening mediante test da sforzo ed ecocardiografia da cinque a dieci anni dopo il trattamento, a causa dell’aumento del rischio cardiaco.
Anche il rischio di un secondo tumore aumenta dopo la radioterapia: uno studio ha dimostrato che circa il 10% delle pazienti che hanno ricevuto la radioterapia a 20 anni ha sviluppato un tumore al seno a circa 50 anni [2]. Una risonanza magnetica del seno e una mammografia sono quindi raccomandate a partire da dieci anni dopo la radioterapia.
Uno sguardo al futuro
Infine, il Prof. Lohri ha parlato di alcune innovazioni rilevanti nella terapia e nella diagnosi del linfoma:
- La PET consentirà una cura con trattamenti meno aggressivi in futuro.
- In futuro, la radioterapia sarà evitata nel contesto curativo.
- Sono in fase di sviluppo molti nuovi farmaci molecolari e immunoterapici: come gli inibitori della tirosin-chinasi (ibrutinib), gli immunomodulatori, gli anticorpi di seconda generazione.
“Il medico di base deve sempre avere il linfoma nel suo radar diagnostico se rileva affaticamento, prurito cronico, anemia, sintomi sistemici di epatite virale o infezione cronica da EBV o HIV. Ma è anche il referente centrale nella gestione a lungo termine del paziente con linfoma guarito e quindi assume un ruolo importante nella diagnosi precoce degli effetti tardivi associati”, ha concluso il Prof. Lohri.
Fonte: “Linfoma: cosa deve sapere il medico di famiglia”, Seminario al SGIM Great Update, 14-15 novembre 2013, Interlaken
Letteratura:
- Galper S, et al: Malattia cardiaca clinicamente significativa nei pazienti con linfoma Hodgkin trattati con irradiazione mediastinica. Sangue 2011; 117: 412-418.
- Dores GM, et al: Seconde neoplasie maligne tra i sopravvissuti a lungo termine alla malattia di Hodgkin: una valutazione basata sulla popolazione in 25 anni. J Clin Oncol 2002; 20(16): 3484-3494.
PRATICA GP 2014; 9(3): 36-37











