L’angiosarcoma associato alle radiazioni è più comune di quanto ci si aspetti intuitivamente. La diagnosi iniziale deve essere fatta il prima possibile. Paradossalmente, anche con questo tumore indotto dalle radiazioni, la re-radiazione è una buona opzione terapeutica.
L’angiosarcoma associato alle radiazioni (RAAS) è così raro che non esistono studi prospettici. Pertanto, tutti i risultati precedenti si basano su serie di casi retrospettivi e case report. A causa della pubblicazione selettiva dei casi, le raccomandazioni terapeutiche basate su di essi possono essere fatte solo con cautela. D’altra parte, bisogna accontentarsi di questo fino a quando non saranno disponibili numeri di casi più grandi e osservazioni a lungo termine da registri tumorali, alcuni dei quali sono solo in fase di costituzione.
Gli angiosarcomi sono tumori altamente maligni delle cellule endoteliali, che rappresentano solo l’1-2% circa di tutti i sarcomi dei tessuti molli [1]. L’angiosarcoma del seno può essere primario o secondario a un linfedema cronico dopo la mastectomia (sindrome di Stewart-Treves) [2] o all’interno di un RAAS in un precedente campo di radiazioni [3]. Gli angiosarcomi primari sembrano avere una prognosi migliore rispetto al RAAS [4–6]. I criteri modificati di Cahan sono solitamente utilizzati per la differenziazione [7,8]. Questi includono:
- Istologia diversa del tumore primario iniziale e del tumore secondario
- Sviluppo di un tumore secondario nel campo di irradiazione precedente.
- Latenza tra il tumore primario e quello secondario superiore a tre anni.
In genere, viene riportata una latenza mediana di sei anni tra la radioterapia (RT) del tumore primario e l’insorgenza del RAAS [1,9]. Questo lasso di tempo è significativamente più breve rispetto ad altri sarcomi associati alle radiazioni, che di solito compaiono solo dopo 10-20 anni [10,11]. Si può ipotizzare una certa predisposizione genetica, anche se non è stata dimostrata [12].
Un’analisi del database SEER di quasi 275.000 pazienti con cancro al seno ha mostrato un’incidenza cumulativa di RAAS dello 0,09% dopo 15 anni [9]. Questo sembra essere in aumento a causa della RT adiuvante eseguita di routine dopo la terapia di conservazione del seno (BET) per il carcinoma mammario o il DCIS [1]. La misura in cui le terapie sistemiche intensificate contribuiscono alla genesi rimane poco chiara.
Il tasso di sopravvivenza a 5 anni è basso e si parla del 27-35% in base al database SEER [9]. Le ragioni di questa prognosi negativa sono molteplici. Le colorazioni rossastre-livide, in parte bidimensionali, che compaiono nel precedente campo di irradiazione, attirano l’attenzione del paziente troppo tardi. Oltre all’infestazione macroscopica, si verifica precocemente una metastasi microscopica occulta “simile a un salto della pulce” nella pelle. Difficilmente può essere contrastato chirurgicamente, poiché può manifestarsi di nuovo e rapidamente in un’altra sede dopo l’escissione dei reperti macroscopici [10,13,14].
Non esistono raccomandazioni terapeutiche uniformi. L’attenzione è rivolta alla procedura chirurgica. La più ampia revisione fino ad oggi, basata su 222 pazienti con un RAAS, mostra un intervallo libero da recidiva locale a 5 anni del 32% e un tasso di sopravvivenza a 5 anni del 43% [1], che è superiore rispetto al database SEER (27-35%). Questo probabilmente perché i pazienti analizzati provenivano da case report e serie di casi con risposte prevalentemente eccezionali e terapie combinate, e la prognosi è quindi sovrastimata a causa del bias di pubblicazione. Al contrario, questo potrebbe indicare un possibile miglioramento della prognosi attraverso le terapie combinate.
Rapporto sul caso
Riportiamo il caso di una paziente che ha 79 anni e che ha un RAAS. 11/2006 è stato diagnosticato un carcinoma duttale invasivo del seno sinistro. La BET è stata eseguita con tumorectomia e linfoadenectomia ascellare sentinella con uno stadio di pT1c pN0 (0/1 sn) cMO ER/PR positivo, HER2 negativo. Dopo l’intervento, è stata eseguita una RT adiuvante normofrazionata dell’intera mammella con campi tangenziali fino a 50 Gy e un boost locale di 16 Gy, seguita da terapia ormonale.
08/2011 la paziente ha notato un’ampia discromia livido-giallastra in tutto il seno sinistro, con riacutizzazioni di noduli e incipienti esulcerazioni. Il capezzolo non era più riconoscibile (Fig. 1). Istologicamente, è stato rilevato un emangiosarcoma scarsamente differenziato (G3), confermato da una seconda valutazione.
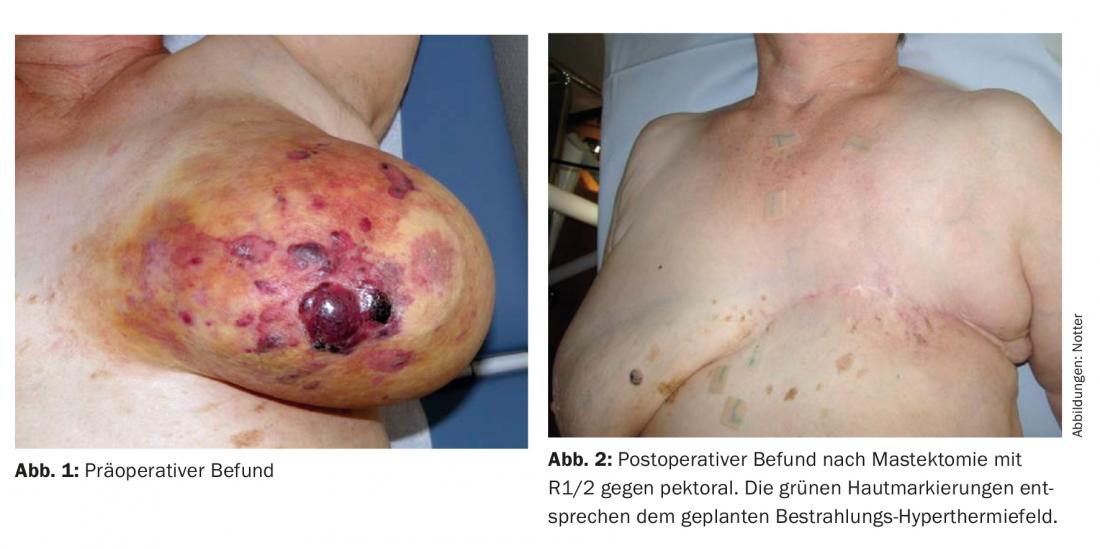
La strategia terapeutica è stata discussa prima dell’intervento dalla commissione tumori, che ha raccomandato una mastectomia seguita da re-irradiazione (re-RT) combinata con ipertermia (HT) su larga scala. Postoperatoriamente, si è vista una resezione R1/R2 nell’area della cicatrice e verso il pettorale (Fig. 2). Non è stata eseguita una resezione. Successivamente, è stata eseguita una ri-TR ipofrazionata con 5× 4 Gy, 1×/settimana, in concomitanza con la TOS di superficie, in analogia con uno schema terapeutico consolidato per le recidive del seno e della parete toracica [15] (Fig. 3).
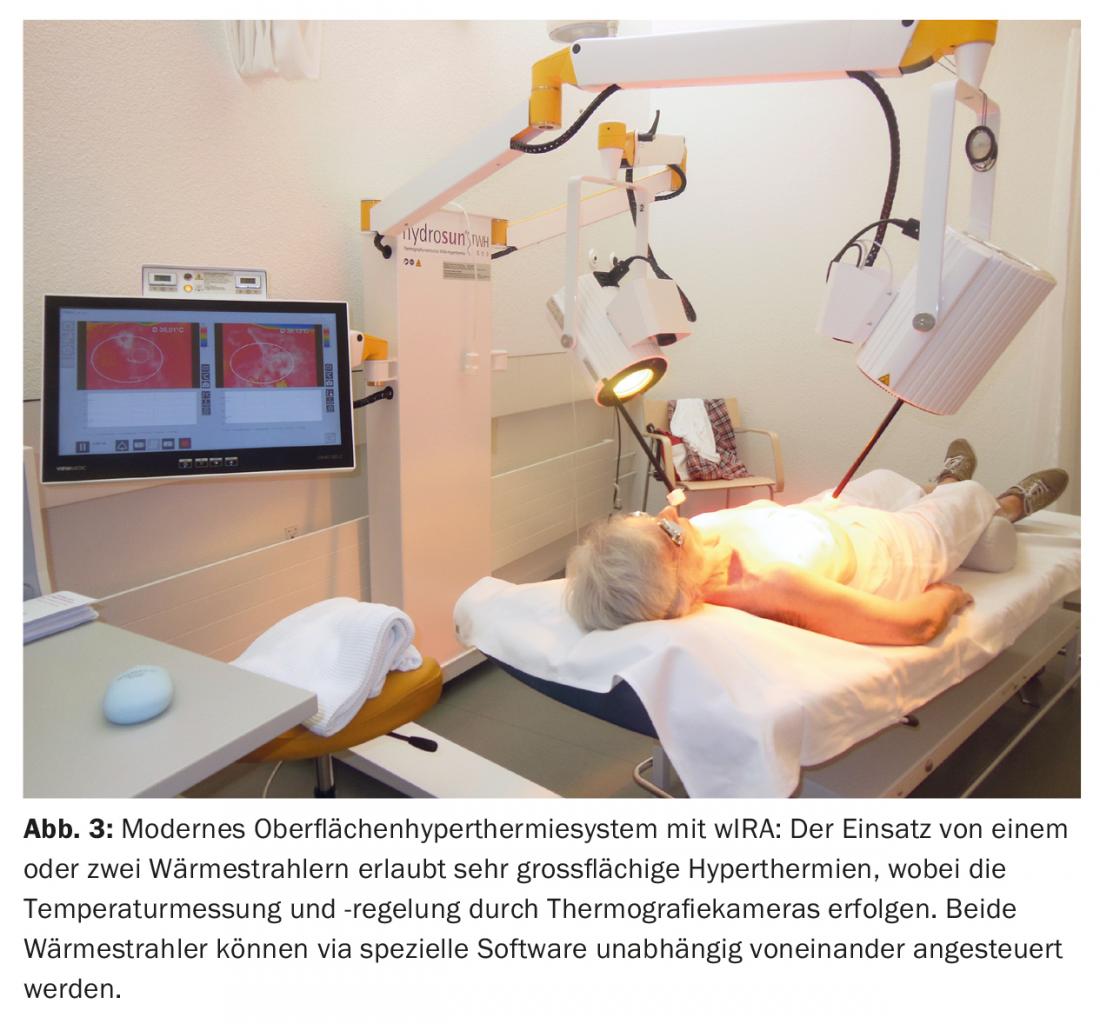
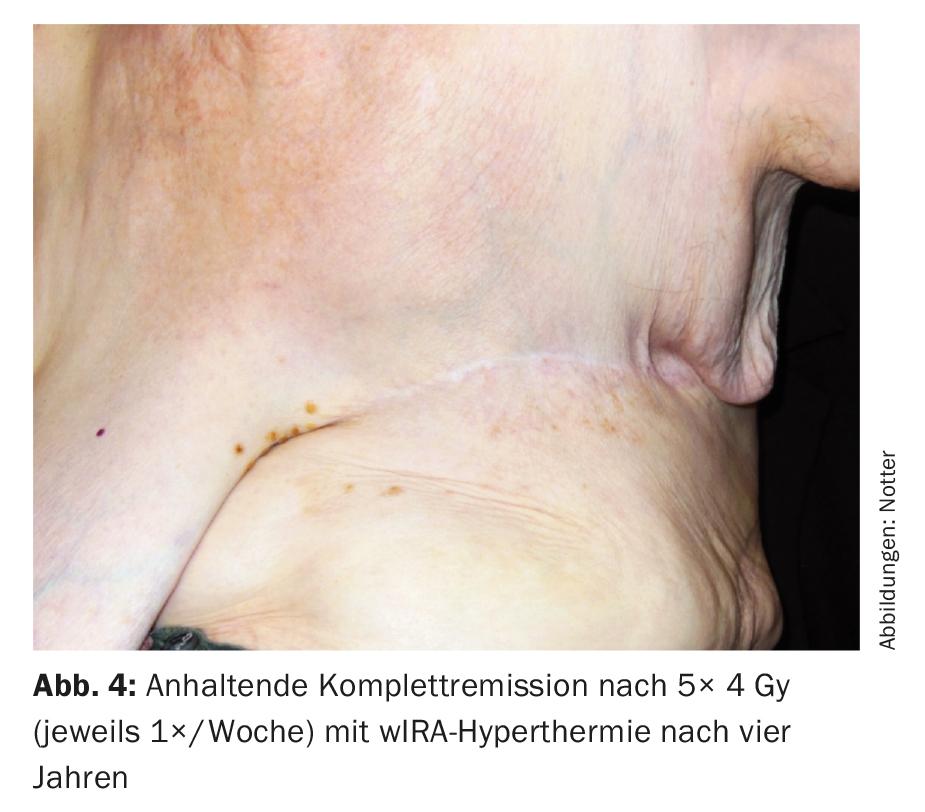
Questo è stato sempre somministrato lo stesso giorno prima della RT con termografia controllata a infrarossi filtrati ad acqua A (wIRA) per 45 minuti. La RT è stata eseguita entro due minuti dal completamento della HT con 4 Gy (9 elettroni MeV) ciascuno e una dose totale di 20 Gy. L’obiettivo primario era la regione R1/R2, con l’intenzione profilattica di irradiare l’intera parete toracica sinistra su un’ampia area per trattare le metastasi occulte. Questo trattamento è stato ben tollerato, con solo un lieve rossore cutaneo transitorio (grado CTCAE 1) come effetto collaterale. Anche quattro anni dopo, c’è stata una remissione completa (Fig. 4), che è durata fino a sei anni dopo (08/2017). Questo è insolito in quanto i parametri rilevanti (resezione R1/2, tumore >10 cm, multifocalità, G3) indicherebbero un rischio di recidiva locale molto elevato.
Discussione
A causa della sua rarità, la RAAS del seno viene solitamente diagnosticata troppo tardi e spesso non viene discussa inizialmente/preoperatoriamente in modo interdisciplinare. Lo standard di cura è la resezione chirurgica R0 come parte di una mastectomia o di una resezione locale della parete toracica con generosi margini di sicurezza, anche se nonostante la radicalità R0 il rischio di recidiva locale è considerevole, fino al 66% [13]. Sono stati descritti vari approcci per ridurre il rischio di recidiva locale, con resezioni ancora più estese (“superradicali”/”a margini ampi”) e corrispondenti deficit funzionali e mutilazioni. È stato dimostrato che la resezione R0 è prognostica sia nell’intervento iniziale che in caso di recidiva, ma che le recidive possono derivare da cellule microscopicamente disseminate nonostante la resezione R0 [13,14,16]. La misura in cui la distanza di resezione nei soggetti sani è un fattore determinante rimane poco chiara. Ci sono rapporti che non hanno potuto dimostrare una differenza prognostica tra un margine di resezione libero <1 cm e >1 cm [14]. Un recente studio chirurgico retrospettivo su 76 pazienti mostra che la chirurgia “radicale”, con l’asportazione di almeno tutta la pelle precedentemente irradiata, ha una prognosi significativamente migliore rispetto a quella “conservativa” (tasso di recidiva locale a 5 anni del 23% contro il 76%) [16]. Tuttavia, si sono verificate più complicazioni della ferita. Va inoltre ricordato che nelle operazioni “radicali” è stato somministrato un numero significativamente maggiore di chemioterapie (ChT) in concomitanza, il che potrebbe aver agito da confonditore.
In definitiva, il controllo delle metastasi microscopiche occulte nella “zona a rischio” sembra essere il principale fattore prognostico per la successiva recidiva. Ciò solleva la questione se il controllo dell’ampia “area a rischio” debba necessariamente essere effettuato chirurgicamente e se esistano opzioni meno mutilanti. Le opzioni sarebbero quindi sia la chemioterapia neoadiuvante che quella adiuvante (ChT). Nell’analisi più ampia con RAAS e ChT con 95 pazienti, la sola chirurgia è stata confrontata retrospettivamente con la ChT aggiuntiva (neo)adiuvante. La ri-ritenzione è stata considerata controindicata. Con una piccola possibilità preoperatoria di resezione R0/R1, è stata eseguita una ChT neoadiuvante. La ChT adiuvante postoperatoria è stata eseguita per le lesioni tumorali di grandi dimensioni, G3 o distanze di resezione <1 cm. Sorprendentemente, il gruppo prognosticamente peggiore con chirurgia e ChT ha mostrato un miglioramento significativo della sopravvivenza libera da recidiva locale a 5 anni del 62,8% rispetto al 36,9% con la sola chirurgia, ma senza un impatto significativo sui tassi di sopravvivenza a 5 anni [10]. Sulla base di questi dati, purtroppo non è possibile formulare una raccomandazione sicura per la ChT, poiché da un lato non è stato utilizzato un regime uniforme di ChT e dall’altro non è possibile un’analisi di sottogruppo a causa del numero troppo ridotto di casi. Un ulteriore fattore limitante da considerare è che molte donne titolari di brevetto difficilmente potrebbero tollerare una ChT aggressiva a causa della loro età e delle loro condizioni generali.
Può essere offerta una ri-trattamento nonostante una condizione preesistente significativa? Per diverse cliniche e commissioni tumori, una precedente esposizione è ancora erroneamente considerata una controindicazione a causa delle possibili tossicità [10,14,16]. Come dimostra l’esempio della ri-trattamento (con HT) delle recidive al seno e alla parete toracica, questo non è giustificato [15,17–20]. Il profilo degli effetti collaterali dipende dal frazionamento, dalla dose totale e dalla latenza tra la RT primaria e la ri-RT pianificata. I dati ad oggi sembrano supportare l’uso della re-RT nel RAAS [21]. Analogamente alle classiche recidive della parete toracica, è interessante la combinazione della ri-RT con l’ipertermia di superficie (HT).
Nel carcinoma mammario recidivante, una meta-analisi di 2110 pazienti ha mostrato un tasso di remissione completa del 60% con un basso tasso di effetti collaterali quando si combinavano la ri-trattamento e l’HT [19]. L’ipertermia/re-radioterapia (HTreRT) per la recidiva del seno o della parete toracica è inclusa nelle linee guida NCCN come “evidenza di categoria 3”. L’HT è definito come un riscaldamento controllato del tessuto a una temperatura di 39-43°C e agisce principalmente come un radio-sensibilizzatore tramite
- Inibizione della riparazione del danno al DNA indotto dalle radiazioni
- Miglioramento della microperfusione tumorale con sensibilizzazione delle cellule ipossiche e quindi radioresistenti [19].
Quest’ultima è particolarmente utile in una parete toracica fibrosa e quindi scarsamente rifornita di capillari, precaricata radiogenicamente [15].
In una revisione di 222 pazienti con RAAS, l’intervento chirurgico con ri-trattamento adiuvante ha ottenuto un controllo locale migliore rispetto alla sola chirurgia. Tuttavia, l’HT è stata somministrata in aggiunta alla ri-TR nel 30% dei casi [1].
Nel RAAS, è stata descritta una buona risposta alla suddetta HTreRT combinata, utilizzando altri regimi di RT e un’applicazione di HT diversa rispetto al nostro caso [22,23]. Sono stati inclusi pazienti dopo recidive multiple, con un basso tasso di sopravvivenza a 5 anni dell’11% ad un’età mediana di 70 anni, ma un buon effetto palliativo con tassi di controllo a 3 anni del 46% (postoperatorio) e del 22% (HTreRT da sola).
Conclusione
In sintesi, un confronto diretto tra le diverse opzioni terapeutiche non è fattibile in modo affidabile a causa del basso numero di casi e della raccolta retrospettiva dei dati. In un’entità come la RAAS del seno, dove la chirurgia spesso “insegue” la malattia, si dovrebbe cercare una terapia interdisciplinare proattiva e ben coordinata. Sarebbe vantaggioso se l’HTreRT post-operatoria fosse discussa al momento della diagnosi, per coprire la “zona a rischio” in una fase precoce. Il RAAS fa parte di una commissione specializzata sui tumori.
Messaggi da portare a casa
- L’angiosarcoma associato alle radiazioni (RAAS), con un’incidenza di circa lo 0,1%, è più comune nelle pazienti con tumore al seno irradiato rispetto a quelle intuitive.
- previsto e si verifica molto prima rispetto ad altri sarcomi associati alle radiazioni.
- La diagnosi iniziale deve essere fatta il più presto possibile e la terapia combinata deve essere inizialmente pianificata in modo interdisciplinare presso un comitato tumori esperto.
- Paradossalmente, anche con questo tumore indotto dalle radiazioni, la re-irradiazione è una buona opzione di trattamento con un basso profilo di effetti collaterali.
- Nel caso di RAAS del torace/ parete toracica, c’è molto da dire sulla terapia interdisciplinare con la chirurgia e la radioterapia semi-profilattica adiuvante a largo raggio.
- Il valore di un’ulteriore terapia sistemica neo- o adiuvante deve essere ulteriormente valutato.
Letteratura:
- Depla AL, et al: Trattamento e fattori prognostici dell’angiosarcoma associato alle radiazioni (RAAS) dopo un tumore primario al seno: una revisione sistematica. Eur J Cancer 2014; 50: 1779-1788.
- Stewart FW, Treves N: Linfangiosarcoma nel linfedema postmastectomia; un rapporto di sei casi in elefantiasi chirurgica. Cancro 1948; 1: 64-81.
- Huang J, Mackillop WJ: Aumento del rischio di sarcoma dei tessuti molli dopo la radioterapia nelle donne con carcinoma mammario. Cancro 2001; 92: 172-180.
- Fraga-Guedes C, et al: Angiosarcomi primari e secondari del seno: un’esperienza di un solo istituto. Breast Cancer Res Treat 2012; 132: 1081-1088.
- Fury MG, et al: Una revisione retrospettiva di 14 anni dell’angiosarcoma: caratteristiche cliniche, fattori prognostici e risultati del trattamento con chirurgia e chemioterapia. Cancer J 2005; 11: 241-247.
- Vorburger SA, et al: Angiosarcoma del seno. Cancro 2005; 104: 2682-2688.
- Cahan WG, et al: Sarcoma insorto nell’osso irradiato; rapporto di 11 casi. Cancro 1948; 1: 3-29.
- Arlen M, et al: Sarcoma dell’osso indotto da radiazioni. Cancro 1971; 28: 1087-1099.
- Yap J, et al: Il sarcoma come seconda neoplasia dopo il trattamento del cancro al seno. Int J Radiat Oncol Biol Phys 2002; 52: 1231-1237.
- Torres KE, et al: Esiti a lungo termine nelle pazienti con angiosarcomi della mammella associati a radiazioni, dopo la chirurgia e la radioterapia per il cancro al seno. Ann Surg Oncol 2013; 20: 1267-1274.
- Manner J, et al: L’amplificazione genica MYC di alto livello è una caratteristica distintiva degli angiosarcomi dopo l’irradiazione o il linfedema cronico. Am J Pathol 2010; 176: 34-39.
- Nestle-Kramling C, et al.: [Emangiosarcoma dopo la terapia conservativa del seno per il cancro al seno: rapporto di quattro casi con diagnosi genetica molecolare e revisione della letteratura]. Strahlenther Onkol 2011; 187: 656-664.
- Seinen JM, et al: Angiosarcoma associato alle radiazioni dopo il cancro al seno: alto tasso di recidiva e scarsa sopravvivenza nonostante il trattamento chirurgico con resezione R0. Ann Surg Oncol 2012; 19: 2700-2706.
- Lehnhardt M, et al: [Radiation-induced angiosarcoma of the breast]. Handchir Microchir Plast Chir 2017; 49: 103-110.
- Notter M, Piazena H, Vaupel P: Re-irradiazione ipofrazionata del carcinoma mammario recidivo di grandi dimensioni con ipertermia a infrarossi-A controllata con termografia e filtrata ad acqua senza contatto: uno studio retrospettivo su 73 pazienti. Int J Hyperthermia 2016; 1-10.
- Li GZ, et al: Angiosarcoma cutaneo del seno associato a radiazioni: la radicalità della chirurgia influisce sulla sopravvivenza. Ann Surg 2017; 265: 814-820.
- Wahl AO, et al: Revisione multi-istituzionale dell’irradiazione ripetuta della parete toracica e del seno per il cancro al seno ricorrente. Int J Radiat Oncol Biol Phys 2008; 70: 477-484.
- Vernon CC, et al: Radioterapia con o senza ipertermia nel trattamento del carcinoma mammario superficiale localizzato: risultati di cinque studi controllati randomizzati. Gruppo Internazionale di Ipertermia Collaborativa. Int J Radiat Oncol Biol Phys 1996; 35: 731-744.
- Datta NR, et al: Ipertermia e radioterapia nei tumori al seno ricorrenti locoregionali: revisione sistematica e meta-analisi. Int J Radiat Oncol Biol Phys 2016; 94: 1073-1087.
- Datta NR, et al: Ipertermia e reirradiazione per le recidive locoregionali nei tumori al seno preirradiati: un’esperienza in un unico istituto. Swiss Med Wkly 2015; 145: w14133.
- Ghareeb ER, et al: Angiosarcoma mammario primario e indotto da radiazioni: predittori clinicopatologici di esito e impatto della radioterapia adiuvante. Am J Clin Oncol 2016; 39: 463-467.
- Linthorst M, et al.: Effetto di una terapia combinata di chirurgia, re-irradiazione e ipertermia sul tasso di controllo locale nell’angiosarcoma radioindotto della parete toracica. Strahlenther Onkol 2013; 189: 387-393.
- de Jong MA, et al: Reirradiazione e ipertermia per il sarcoma associato alle radiazioni. Cancro 2012; 118: 180-187.
InFo ONCOLOGIA & EMATOLOGIA 2017; 5(4): 28-32











