Tra le altre cose, sono state presentate le nuove scoperte sulla terapia del linfoma diffuso a grandi cellule B. Lo studio FLYER di fase III ha confrontato la terapia standard (6xR-CHOP) con un trattamento ridotto da due cicli di chemioterapia. Un altro studio è riuscito a sviluppare un nuovo metodo genetico molecolare come base per una strategia terapeutica personalizzata.
Il linfoma diffuso a grandi cellule B (DLBCL) è il linfoma non-Hodgkin più comune al mondo e appartiene ai cosiddetti linfomi non-Hodgkin aggressivi. La terapia standard finora è l’immunochemioterapia 6xR-CHOP. La 6xR-CHOP combina anticorpi monoclonali (R) con farmaci citostatici (CHOP) in sei cicli [1]. La base empirica di questo regime di trattamento deriva dallo studio MINT [3]. Nei pazienti con un punteggio dell’indice prognostico aggiustato per l’età (aaIPI) pari a 0 e senza massa tumorale, sei cicli di terapia hanno determinato una EFS a 3 anni dell’89% e una PFS a 3 anni del 95%, e una OS a 3 anni del 98% [3].
Nello studio FLYER, è stato dimostrato che due cicli di chemioterapia possono essere omessi senza avere un effetto negativo sul decorso della malattia. Una durata più breve della chemioterapia significa che i pazienti possono tornare alla normale routine quotidiana e al lavoro più rapidamente, come spiega la prima autrice dello studio, la dottoressa Viola Poeschel, della Saarland University Medical School di Homburg/Saar (Germania) [1].
Studio multicentrico FLYER: riduzione della chemioterapia senza effetti negativi
Lo studio multicentrico prospettico internazionale FLYER (n=588) ha analizzato come la riduzione dei cicli di trattamento citostatico della terapia standard influisca sui parametri rilevanti per la malattia. A questo scopo, 6xR-CHOP (n=295) è stato confrontato in un periodo di undici anni (2005-2016) con la terapia secondo il regime 4xR-CHOP+2xR (n=293) in un disegno randomizzato e bilanciato di non inferiorità. I pazienti di età compresa tra i 18 e i 60 anni avevano un DLBCL di stadio I o II senza massa tumorale e sono stati assegnati in modo casuale a uno dei due bracci di studio (sei contro quattro cicli di CHOP e sei dosi di rituximab ciascuno). I cicli R-CHOP sono stati eseguiti a intervalli di 21 giorni. L’endpoint primario era la non inferiorità nella sopravvivenza libera da progressione (PFS). Gli endpoint secondari erano vari parametri rilevanti per la malattia. La 4xR-CHOP+2xR si è dimostrata non inferiore alla 6xR-CHOP standard; l’eliminazione delle cellule tumorali e la prevenzione delle ricadute sono state comparabilmente efficaci con quattro cicli di chemioterapia e con sei cicli. Per quanto riguarda la tollerabilità, la riduzione della chemioterapia di due cicli ha avuto un effetto favorevole [1].
Il tasso di PFS a 3 anni (endpoint primario) dopo un follow-up mediano di 66 mesi è stato del 94% (95% CI, 91-97) nella condizione 6xR-CHOP (n=295) e del 96% (95% CI, 94-99) nella condizione 4xR-CHOP+2xR (n=293). I risultati differivano solo leggermente anche in termini di tasso di OS a 3 anni dopo un follow-up mediano di 67 mesi: 98% (95% CI, 96-99) con sei cicli contro 99% (95% CI, 98-100) con quattro cicli [1].
Per quanto riguarda la tollerabilità, i risultati sono stati i seguenti: Rispetto alla condizione 6xR-CHOP (1295 AE), il numero totale di AE nella condizione 4xR-CHOP+2xR (835 AE) era inferiore di circa un terzo [1]. Il numero totale di eventi avversi non ematologici (AE) di grado 3 e 4 è stato più elevato nel braccio di trattamento 6xR-CHOP (70 AE) rispetto al braccio a 4 cicli (46 AE) [1,4]. Per quanto riguarda gli AE ematologici, nella condizione 6 R-CHOP, il numero di individui colpiti è stato maggiore rispetto a 4xR-CHOP+2xR: leucopenia di grado 3 o 4 (110 vs. 80), anemia (8 vs. 2) e trombocitopenia (7 vs. 5). Inoltre, nella condizione 6xR-CHOP, più pazienti sono stati colpiti da parestesie di grado 3 e 4 (14 contro 12), nausea (12 contro 6), infezione (23 contro 20), vomito (7 contro 1) e mucosite (3 contro 1). Per poter affermare se la riduzione del numero di cicli R-CHOP influisce sugli effetti negativi a lungo termine della chemioterapia, è necessario un monitoraggio per un ulteriore periodo di cinque anni [1].
Personalizzazione del trattamento: nuove analisi genetiche molecolari
I linfomi diffusi a grandi cellule B possono essere suddivisi in base a criteri morfologici (centroblastici, immunoblastici, anaplastici), in base all’espressione genica (“cellule B del centro germinale (GCB)-like”, “activated B-cell (ABC)-like”), in base alle caratteristiche immunoistochimiche (in particolare CD5, CD30, MYC, BCL2, BCL6, GCB-like, non-GCB-like) e in base alle anomalie genetiche (in particolare traslocazione di MYC, BCL2 e/o BCL6). Nella più recente edizione della classificazione dell’OMS, la definizione dei tipi di linfoma è stata rivista per includere i risultati dei nuovi metodi di analisi molecolare, come il “sequenziamento di nuova generazione” (Tab. 1) [5].
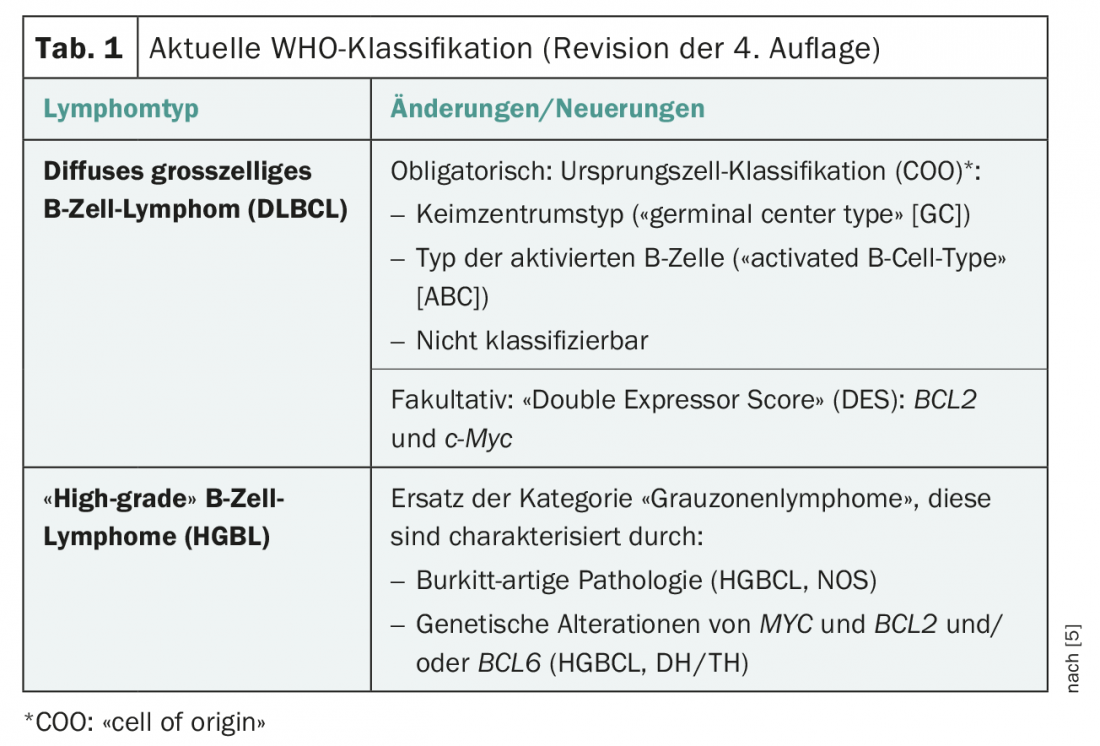
L’identificazione di sottogruppi molecolari è una possibile base per personalizzare il trattamento. Uno studio presentato all’ASH, apparso in parallelo sul Journal of Oncology, riprende questo approccio [2]. All’interno della variante DLBCL simile alle cellule B del centro germinale (GCB), è stato identificato un sottogruppo che si differenzia clinicamente e biologicamente per una firma di espressione genica HGBL-DH/TH-BCL2. Lo sfondo di questo studio è stata la scoperta che i linfomi a cellule B di alto grado con MYC e BCL2 e/o BCL6 (HGBL-DH/TH) rispondono male alla terapia standard (chemioimmunoterapia). Per analizzare le caratteristiche molecolari di HGBL-DH/TH con BCL2 (HGBL-DH/TH-BCL2), nonché la morfologia del DLBCL, è stata sviluppata una firma a doppio hit di 104 geni (DHITsig) come caratteristica distintiva tra HGBL-DH/TH-BCL2 e altri GCB-DLBCL.
DHITsig identifica i tumori che differiscono nelle caratteristiche biologiche che possono essere rilevanti per la progressione e la terapia. I tumori DHITsig-pos sono caratterizzati da un COO della zona intermedia/scura del tipo centro germinale (GC) e hanno un’espressione significativamente inferiore dei geni della zona chiara rispetto ai tumori DHITsig-neg (p<0,001) (Fig. 1). È stato dimostrato che i pazienti DHITsig-positivi avevano un esito peggiore dopo l’immunochemioterapia R-CHOP rispetto ai pazienti DHITsig-negativi (tasso di sopravvivenza libera da progressione a 5 anni, 57% e 81%, rispettivamente; p<0,001), indipendentemente dallo stato HGBL-DH/TH-BCL2.
L’espressione di MYC nelle cellule del centro germinale normale è limitata alle cellule situate all’interno della LZ per il rientro nella DZ. Gli autori dello studio suggeriscono che queste cellule di riciclo rappresentano la controparte fisiologica delle cellule tumorali DHITsig-pos. Oltre ad un’alta incidenza di mutazioni all’interno dei geni che modificano la cromatina, hanno un’alta incidenza di bassa espressione di MHC-I e MHC-II e un alto livello di espressione di geni associati alla fosforilazione ossidativa.
Secondo gli autori, queste caratteristiche biologiche possono fornire una base per lo sviluppo di sostanze attive mirate, oltre all’attuale focus sugli induttori di BCL2. I possibili approcci terapeutici che ne possono derivare riguardano la differenziazione cellulare (“inibitori dell’enhancer of zeste homolog 2”), la riduzione dell’evasione immunitaria (“inibitori dell’istone deacetilasi”), l’aumento dell’attivazione delle cellule T (anticorpi anti-CD20 di nuova generazione), nonché la fosforilazione ossidativa e il proteasoma. Gli alti livelli di espressione di alcuni geni indicano anche che gli inibitori specifici possono essere utili (ad esempio, gli inibitori dell’arachidonato 5-lipossigenasi).
L’analisi dei sottogruppi mediante la firma di espressione genica DHITsig sviluppata in questo studio può essere utilizzata per le indagini sui campioni bioptici in un contesto clinico.
Fonte: 60° Meeting ASH, 1-4 dicembre 2018, San Diego (USA)
Letteratura:
- Poeschel V, et al: Eccellente esito dei pazienti giovani (18-60 anni) con linfoma diffuso a grandi cellule B (DLBCL) a prognosi favorevole, trattati con 4 cicli di CHOP più 6 applicazioni di rituximab: risultati dei 592 pazienti dello studio FLYER del Dshnhl/GLA. Abstracts orali e poster, Abstract n. 781: Sessione: 626. Presentato a: Riunione annuale ed esposizione ASH; 4-8 dicembre 2018; San Diego, California. Estratto 781, https://ash.confex.com/ash/2018/webprogram/Paper112403.html
- Ennishi D, et al: La doppia firma di espressione genica definisce un sottogruppo distinto di linfoma diffuso a grandi cellule B simile al centro germinale. Journal of Clinical Oncology 2018; Dec 3:JCO1801583. doi: 10.1200/JCO.18.01583. [Epub ahead of print], Presentato alla 60esima Conferenza annuale della Società Americana di Ematologia, San Diego, CA, 1-4 dicembre 2018.
- Pfreundschuh M, Truemper L, Osterborg A, et al: Chemioterapia CHOP-like più rituximab rispetto alla sola chemioterapia CHOP-like nei pazienti giovani con linfoma diffuso a grandi cellule B a buona prognosi: uno studio randomizzato controllato del Gruppo Mabthera International Trial (MInT). Lancet Oncology 2006; 7(5): 379-391.
- NIH: Istituto Nazionale del Cancro. Divisione di Trattamento e Diagnosi del Cancro. Criteri di terminologia comune per gli eventi avversi, https://ctep.cancer.gov/protocolDevelopment/electronic_applications/ctc.htm#ctc_40, ultimo accesso 19.12.2018.
- Menter T, Dirnhofer S: OMS 2017: progresso, regressione o passo laterale? Switzerland Med Forum 2018; 18(03): 52-54 DOI: https://doi.org/10.4414/smf.2018.03150.
InFo ONcOLOGIA & EMATOLOGIA 2019; 7(1): 30-31