Non solo per la sua elevata mortalità, l’endocardite infettiva richiede un trattamento completo. Per ottenere i migliori risultati possibili è necessaria una stretta collaborazione interdisciplinare.
L’endocardite infettiva è una malattia complessa associata a un’elevata mortalità. Una stretta collaborazione interdisciplinare, soprattutto tra cardiologi, infettivologi, radiologi e cardiochirurghi, è necessaria per garantire il miglior trattamento possibile. La pubblicazione di nuovi articoli, i miglioramenti nelle tecniche di imaging e le discrepanze tra le precedenti linee guida europee e americane hanno portato all’aggiornamento delle linee guida europee nel 2015 [1]. Questo articolo riassume queste linee guida.
Prevenzione
Le indicazioni per la profilassi dell’endocardite sono state limitate già alcuni anni fa. Le attività quotidiane, come lavarsi i denti, causano una batteriemia ripetitiva e debole, che presumibilmente rappresenta un rischio più elevato per lo sviluppo dell’endocardite rispetto alla rara batteriemia nel corso di un intervento (dentale) [2]. Si presume quindi che la profilassi antibiotica dell’endocardite sia in grado di prevenire solo un piccolo numero di casi di endocardite, se non addirittura nessuno. La profilassi dell’endocardite è quindi ora raccomandata solo per i pazienti a più alto rischio di contrarre e di avere un decorso sfavorevole dell’endocardite. Secondo le linee guida europee, si tratta di pazienti con valvole protesiche o con valvole ricostruite (se viene utilizzato materiale protesico), di pazienti che hanno subito un’endocardite o di pazienti con cianosi, cure palliative o viziatura congenita corretta da materiale estraneo (per 6 mesi dopo l’intervento) [1]. Le linee guida svizzere raccomandano inoltre la profilassi per i pazienti con un difetto del setto ventricolare, un dotto botalli persistente o per i pazienti con viziatura della valvola nei cuori trapiantati. Mentre le linee guida europee prevedono solo la profilassi prima delle procedure odontoiatriche, in Svizzera la profilassi è raccomandata anche prima di alcune procedure sul tratto gastrointestinale, urogenitale e respiratorio [3].
Diagnosi
La clinica, la microbiologia (in particolare le emocolture) e l’ecocardiografia sono le pietre miliari nella diagnosi di endocardite. Inoltre, altre tecniche di imaging possono fornire informazioni importanti.
Quadro clinico: il quadro clinico dell’endocardite è variabile e dipende dal tipo di a.o. I risultati dipendono dall’agente patogeno e dalle varie caratteristiche del paziente. Il sintomo più comune è la febbre, che si verifica fino al 90% dei casi. Un soffio cardiaco può essere auscultato fino all’85% dei casi. Le complicazioni emboliche si riscontrano in circa il 25% dei pazienti al momento della diagnosi [1]. Le classiche stigmate periferiche di genesi vascolare (ad esempio, lesioni di Janeway, emorragie da schegge) e immunologica (ad esempio, noduli di Osler, macchie di Roth) sono diventate più rare, in quanto sono v.a. sono presenti nei casi subacuti e oggi i pazienti tendono a presentarsi nella fase acuta dell’endocardite.
Microbiologia: se si sospetta un’endocardite, si devono prelevare almeno tre coppie di emocolture da vene periferiche a intervalli di 30 minuti prima di iniziare la terapia antibiotica. In quasi 1/3 dei casi di endocardite, queste emocolture sono negative. Il motivo più comune è una precedente terapia antibiotica. In queste situazioni, è indicata una finestra temporale senza antibiotici con successiva ripetizione del prelievo di emocoltura, se giustificabile dal punto di vista clinico. Altre cause di emocolture iniziali negative sono i funghi e i batteri difficili da coltivare o intracellulari (ad esempio, Coxiella burnetii, Bartonella spp.) In caso di emocolture iniziali negative e di sospetto persistente di endocardite, le colture su terreni speciali, gli esami sierologici o i test di “reazione a catena della polimerasi” possono contribuire alla diagnosi [4]. Se l’intervento chirurgico viene eseguito su una valvola infetta, l’esame microbiologico del materiale asportato è di importanza diagnostica.
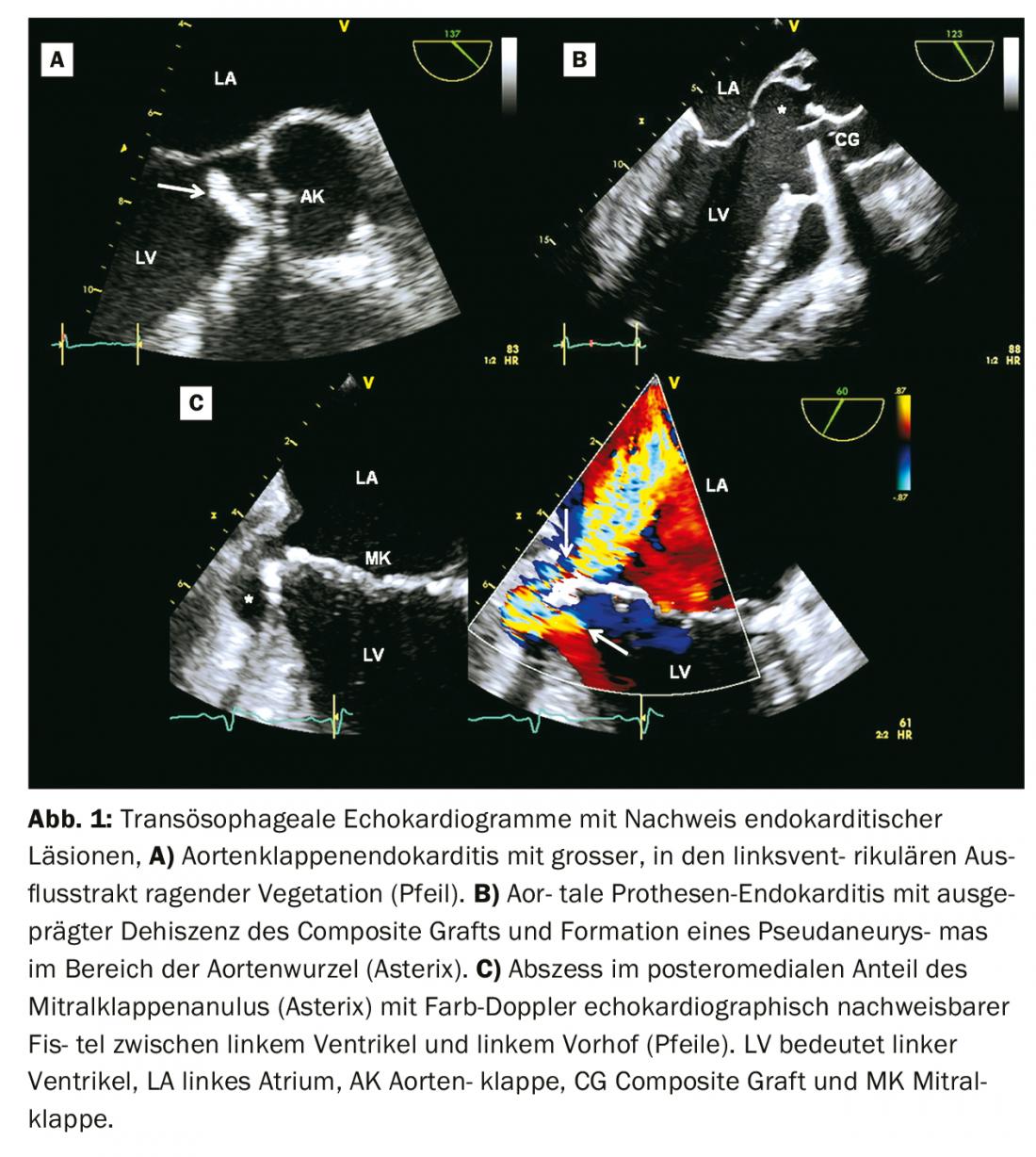
Ecocardiografia: l ‘ecocardiografia è l’imaging di scelta per il sospetto di endocardite [5]. Di norma, viene eseguito prima un ecocardiogramma transtoracico (TTE) . Un ecocardiogramma transoesofageo (TEE) è solitamente indicato come follow-up, tranne nei casi di TTE negativo e di sospetto clinicamente basso di endocardite. Secondo i criteri di Duke e secondo i criteri diagnostici modificati delle linee guida europee, le vegetazioni, le complicazioni paravalvolari (ascesso, pseudaneurismi, fistole) o una nuova deiscenza di una protesi valvolare sono considerati criteri ecocardiografici principali per l’endocardite. (Fig. 1, Tab. 1) [1,6]. Nello schema diagnostico modificato delle linee guida europee, le insufficienze valvolari appena rilevate non sono più considerate un segno diagnostico, mentre le perforazioni valvolari e gli aneurismi valvolari sono considerati criteri principali (Tabella 1) [1].

La sensibilità per la diagnosi di vegetazioni mediante TTE è del 70% per le valvole native e del 50% per le valvole protesiche. Per il TEE, i valori corrispondenti sono 96 e 92%. La specificità è di circa il 90% per entrambe le modalità [5]. La sensibilità per la diagnosi di ascessi nella TTE è del 50% e nella TEE del 90% [5].
Se la valutazione ecocardiografica iniziale non rivela alcun risultato diagnostico e persiste un elevato sospetto clinico di endocardite, si raccomanda di ripetere la TTE e la TEE dopo 5-7 giorni [1]. Inoltre, l’imaging supplementare deve essere preso in considerazione in queste situazioni, soprattutto nei casi difficili dal punto di vista ecocardiografico, come i pazienti con valvole protesiche o con dispositivi elettronici intracardiaci.
Altre modalità di imaging: La tomografia computerizzata cardiaca (TC) può essere utile nella diagnosi delle complicanze paravalvolari (Tab. 1) [1], soprattutto nell’endocardite protesica. La TAC è adatta anche per rilevare le complicanze extracardiache dell’endocardite (ad esempio, lesioni ischemiche dovute all’embolizzazione di una vegetazione, ascessi). La risonanza magnetica (RM) è particolarmente adatta a rilevare le lesioni cerebrali. Le lesioni cerebrali sono comuni e di solito sono di natura embolico-ischemica. Anche i pazienti neurologicamente poco appariscenti mostrano lesioni alla risonanza magnetica in almeno il 50% dei casi [7]. Nello schema diagnostico modificato delle linee guida europee, le lesioni paravalvolari alla TAC cardiaca sono considerate criteri principali e le com- plicanze vascolari rilevate dalla diagnostica per immagini (TAC o RM) sono considerate criteri minori (Tabella 1) [1].
Anche le tecniche di imaging nucleare, come la 18F-FDG PET/CT o la SPECT/CT leucocitaria, possono essere utili nei casi diagnosticamente difficili. Secondo dati recenti, questi esami possono migliorare l’accuratezza diagnostica dell’endocardite nelle valvole protesiche e nei dispositivi intracardiaci [8]. Tuttavia, quando si valuta con la 18F-FDG PET/CT, l’intervento chirurgico alla valvola deve essere avvenuto almeno 3 mesi fa, poiché è possibile un’attività metabolica non specifica nell’area della protesi poco dopo l’intervento. La SPECT/CT è più specifica della 18F-FDG PET/CT nel rilevare l’endocardite [9]; tuttavia, è una tecnologia di imaging complessa e che richiede molto tempo.
Nello schema diagnostico modificato delle linee guida europee, il rilevamento di un’attività periprotesica anomala nell’imaging nucleare è considerato un criterio importante (Tab. 1) [1].
Terapia
Terapia antibiotica: la terapia antibiotica viene somministrata per via endovenosa. La durata dipende dall’agente patogeno e dalla complessità dell’endocardite. Nelle valvole native, si raccomanda una terapia empirica iniziale con amoxicillina 6 × 2 fino all’ottenimento dei risultati microbiologici. g i.v., gentamicina 3 mg/kg i.v. e fluocloxacillina 6 × 2 g i.v. al giorno, nelle valvole native e nell’allergia alla penicillina con vancomicina 2 × 15 mg/kg i.v. e gentamicina 3 mg/kg i.v. al giorno e per le valvole protesiche si raccomanda vancomicina 2 × 15 mg/kg i.v., gentamicina 3 mg/kg i.v. e rifampicina 2 × 450 mg p.o. al giorno [1].
Indicazioni chirurgiche: L’insufficienza cardiaca è la complicazione più comune e la causa di morte più frequente nell’endocardite [10]. L’infezione da Staphylococcus aureus aumenta il rischio di insufficienza cardiaca. A condizione che non vi siano gravi comorbidità, di solito è indicata una procedura chirurgica precoce (Tab. 2) [1].
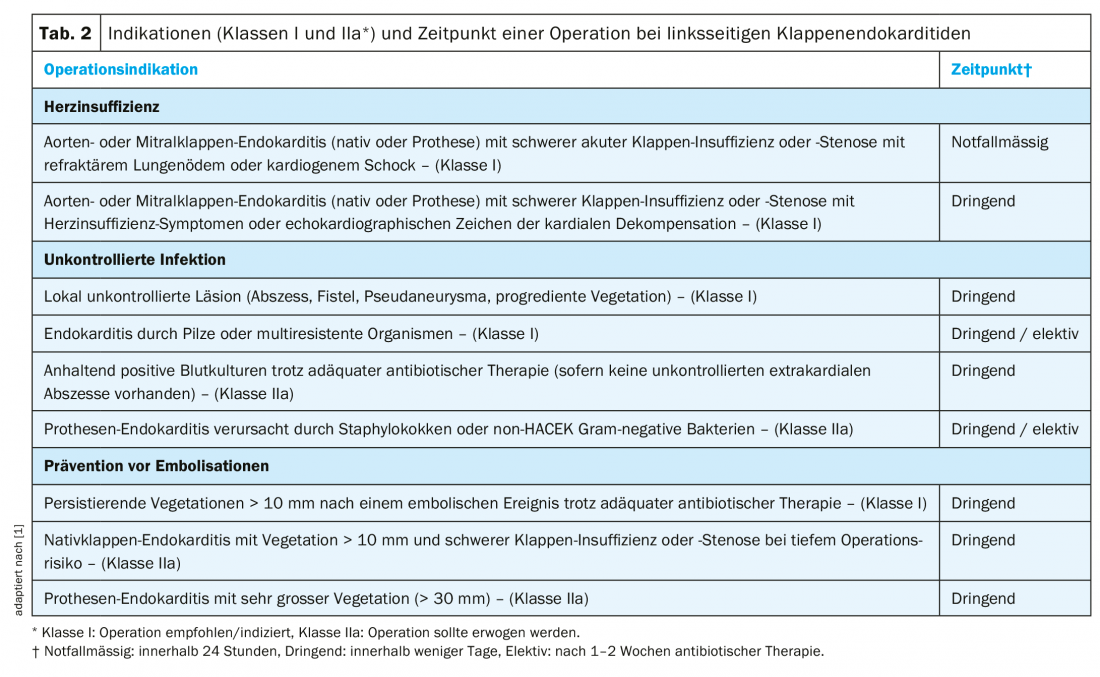
La seconda causa più comune di intervento chirurgico per endocardite è un’infezione incontrollata (Tab. 2) [1,10]. Nella maggior parte dei casi, ciò è dovuto a un’estensione paravalvolare dell’infezione (ascesso, pseudoaneurisma, fistola). Le indicazioni cliniche di una complicanza paravalvolare sono la febbre persistente o il blocco atrioventricolare di nuova insorgenza.
Un’altra complicanza temuta che può portare a un intervento chirurgico alla valvola è l’embolizzazione sistemica della vegetazione (Tabella 2) [1]. Gli eventi embolici si verificano nel 20-50% dei pazienti con endocardite. Tuttavia, il rischio di nuovi eventi in caso di terapia antibiotica adeguata è inferiore (6-21%) e diminuisce fortemente dopo la prima settimana di terapia antibiotica [11,12]. Le dimensioni e la mobilità della vegetazione sono importanti fattori di rischio per l’embolizzazione (Tab. 2) [1,11,12].
Complicazioni neurologiche: Le complicanze neurologiche sintomatiche si verificano in circa il 15-30% dei pazienti con endocardite [13]. Un insulto cerebrale è associato a un aumento della mortalità. La diagnosi rapida e l’inizio di una terapia antibiotica adeguata sono di grande importanza per la prevenzione delle complicanze neurologiche nell’endocardite [12]. Dopo un primo insulto ischemico, la chirurgia cardiaca necessaria (Tab. 2) non è controindicata e non deve essere ritardata se il danno neurologico non è grave [14]. Nel caso di un’emorragia cerebrale rilevante, invece, è necessario trattare almeno un’emorragia. attendere 1 mese prima di sottoporsi a un intervento di cardiochirurgia [15].
Infezione dei dispositivi elettronici intracardiaci: L’endocardite associata a un pacemaker o a un defibrillatore è spesso una sfida diagnostica ed è associata a un’elevata mortalità [1,16]. Il trattamento di solito prevede una terapia antibiotica prolungata (di solito 4-6 settimane) e la rimozione completa del corpo estraneo [1]. Se possibile, gli elettrodi devono essere rimossi per via transvenosa [17]. Quando si impianta un dispositivo elettronico intracardiaco, si raccomanda la profilassi antibiotica di routine, di solito con una cefalosporina i.v. (a partire da 1 ora prima dell’impianto, somministrata per 24-36 ore) [18].
Messaggi da portare a casa
- La profilassi dell’endocardite è ora raccomandata solo per i pazienti cardiaci ad alto rischio, che presentano il rischio più elevato di contrarre l’endocardite e di avere un decorso sfavorevole.
- L’ecocardiografia è l’imaging di scelta nella diagnosi di endocardite. In primo luogo, si esegue una TTE; di solito è seguita da una TEE, tranne nel caso di una TTE negativa e di un sospetto clinicamente basso.
- Una TAC cardiaca, una PET/CT 18F-FDG o una SPECT/CT possono essere utili come imaging complementare, soprattutto se si sospetta un’endocardite associata a protesi o dispositivi.
- Le indicazioni per l’intervento chirurgico sono endocardite complicata con segni di insufficienza cardiaca, infezione non controllata o rischio di embolia sistemica.
- L’insulto cerebrovascolare ischemico non è una controindicazione e non deve ritardare l’intervento cardiochirurgico necessario in assenza di un grave danno neurologico.
- In caso di endocardite associata al dispositivo, si raccomanda la rimozione del corpo estraneo e una terapia antibiotica prolungata.
Letteratura:
- Habib G, Lancellotti P, Antunes MJ, et al: Linee guida ESC 2015 per la gestione dell’endocardite infettiva: la Task Force for the Management of Infective Endocarditis della Società Europea di Cardiologia (ESC). Appoggiato da: Associazione Europea di Chirurgia Cardio-Toracica (EACTS), Associazione Europea di Medicina Nucleare (EANM). Eur Heart J 2015; 36: 3075-3128.
- Lockhart B, Brennan MT, Sasser HC, et al: Batteriemia associata allo spazzolamento dei denti e all’estrazione dentale. Circolazione 2008; 117: 3118-3125.
- Flückiger U, Jaussi A: Linee guida svizzere riviste per la profilassi dell’endocardite. Medicina cardiovascolare 2008; 11: 392-400.
- Raoult D, Casalta JP, Richet H, et al.: Contributo del test sierologico sistematico nella diagnosi di endocardite infettiva. J Clin Micro- biol 2005; 43: 5238-5242.
- Habib G, Badano L, Tribouilloy C, et al: Raccomandazioni per la pratica dell’ecocardiografia nell’endocardite infettiva. Eur J Echocardiogr 2010; 11: 202-219.
- Li JS, Sexton DJ, Mick N, Nettles R, Fowler VG Jr, Ryan T, et al. Modifiche proposte ai criteri di Duke per la diagnosi di endocardite infettiva. Clin Infect Dis 2000; 30: 633-638.
- Hess A, Klein I, Iung B, et al: Risultati della risonanza magnetica cerebrale in pazienti neurologicamente asintomatici con endocardite infettiva. Am J Neuroradiol 2013; 34: 1579-1584.
- Pizzi MN, Roque A, Fernández-Hidalgo N, et al: Migliorare la diagnosi di endocardite infettiva nelle valvole protesiche e nei dispositivi intracardiaci con la tomografia ad emissione di positroni/angiografia tomografica computerizzata con 18F-Fluorodeossiglucosio: risultati iniziali in un centro di riferimento per l’endocardite infettiva. Circolazione 2015; 132: 1113-1326.
- Rouzet F, Chequer R, Benali K, et al: Prestazioni rispettive della PET 18F-FDG e della scintigrafia con leucociti radiomarcati per la diagnosi di endocardite valvolare protesica. J Nucl Med 2014; 55: 1980-1985.
- Tornos P, Iung B, Permanyer-Miralda G, et al: Endocardite infettiva in Europa: lezioni dall’indagine Euro heart. Cuore 2005; 91: 571-575.
- Vilacosta I, Graupner C, San Roman JA, et al: Rischio di embolizzazione dopo l’istituzione della terapia antibiotica per l’endocardite infettiva. J Am Coll Cardiol 2002;39: 1489-1495.
- Dickerman SA, Abrutyn E, Barsic B, et al: Il rapporto tra l’inizio della terapia antimicrobica e l’incidenza di ictus nell’endocardite infettiva: un’analisi dello studio ICE Prospective Cohort Study (ICE- PCS). Am Heart J 2007; 154: 1086-1094.
- Garcia-Cabrera E, Fernandez-Hidalgo N, Almirante B, et al: Complicazioni neurologiche dell’endocardite infettiva: fattori di rischio, esito e impatto della chirurgia cardiaca: uno studio osservazionale multicentrico. Circolazione 2013; 127: 2272-2284.
- Kang DH, Kim YJ, Kim SH, et al: Chirurgia precoce rispetto al trattamento convenzionale per l’endocardite infettiva. N Engl J Med 2012; 366: 2466-2473.
- Yoshioka D, Sakaguchi T, Yamauchi T, et al: Impatto del trattamento chirurgico precoce sull’esito neurologico postoperatorio dell’endocardite infettiva attiva complicata da infarto cerebrale. Ann Thorac Surg 2012; 94: 489-495.
- Nof E, Epstein LM: Complicazioni degli impianti cardiaci: gestione delle infezioni del dispositivo. Eur Heart J 2013; 34: 229-236.
- Sohail MR, Uslan DZ, Khan AH, et al: Endocardite infettiva che complica l’infezione del pacemaker permanente e del cardioverter-defibrillatore impiantabile. Mayo Clin Proc 2008; 83: 46-53.
- Klug D, Balde M, Pavin D, et al: Fattori di rischio legati alle infezioni di pacemaker e cardioverter-defibrillatori impiantati: risultati di un ampio studio prospettico. Circolazione 2007; 116: 1349-1355.
CARDIOVASC 2019; 18(4): 4-7