Il cancro all’esofago si manifesta in media all’età di 60 anni. È la sesta causa più comune di morte per cancro. La chirurgia robotica consente interventi più radicali in condizioni di visibilità ottimale – per una prognosi migliore.
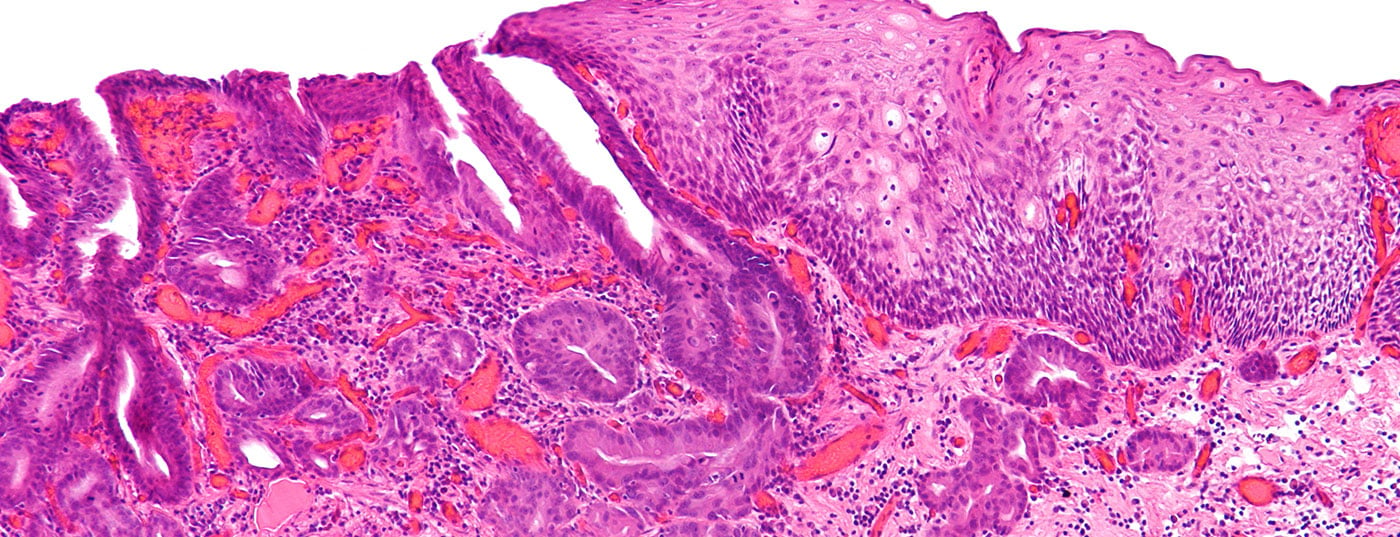
Il cancro all’esofago si manifesta in media all’età di 60 anni. Tre quarti delle persone colpite sono uomini, un quarto donne. È la sesta causa più comune di morte legata al cancro [1]. Il carcinoma a cellule squamose si trova nel terzo superiore e medio dell’esofago. Il consumo di alcol e nicotina sono in primo piano come fattori di rischio, l’incidenza è stabile. L’adenocarcinoma insorge nel terzo inferiore dell’esofago e nel passaggio allo stomaco. Importanti fattori di rischio sono il reflusso gastro-esofageo e l’obesità. L’incidenza dell’adenocarcinoma è in forte aumento ed è più comune del carcinoma a cellule squamose nei Paesi occidentali. Altre forme istologiche hanno un ruolo subordinato.
Stabilizzazione
Il carcinoma esofageo metastatizza precocemente a livello linfatico e vascolare. Il tasso di sopravvivenza a 5 anni è solo del 15-25%, nonostante la terapia multimodale [1]. La diagnosi più precoce possibile è quindi essenziale. In qualità di fornitore di cure primarie, il medico di base è responsabile di un rapido chiarimento mediante esofagogastroduodenoscopia (OGD) in caso di sintomi di allarme (panoramica 1) . Dal punto di vista diagnostico, l’OGD ha la massima sensibilità e specificità per le neoplasie del tratto gastrointestinale superiore.

I centri tumori con competenze adeguate sono responsabili della stadiazione dei pazienti con carcinoma esofageo. La stadiazione comprende l’endosonografia per le categorie T e N e la TAC con PET per individuare le metastasi a distanza (categoria M) e come esame indice nel concetto neoadiuvante. La broncoscopia viene eseguita per i tumori con sospetta invasione a livello della carina o prossimalmente. Nel caso del carcinoma a cellule squamose, è indispensabile escludere un tumore ORL sincrono. La laparoscopia viene utilizzata per escludere la carcinomatosi peritoneale o le metastasi epatiche (cT3-4) [2,3].
Classificazione del carcinoma esofageo
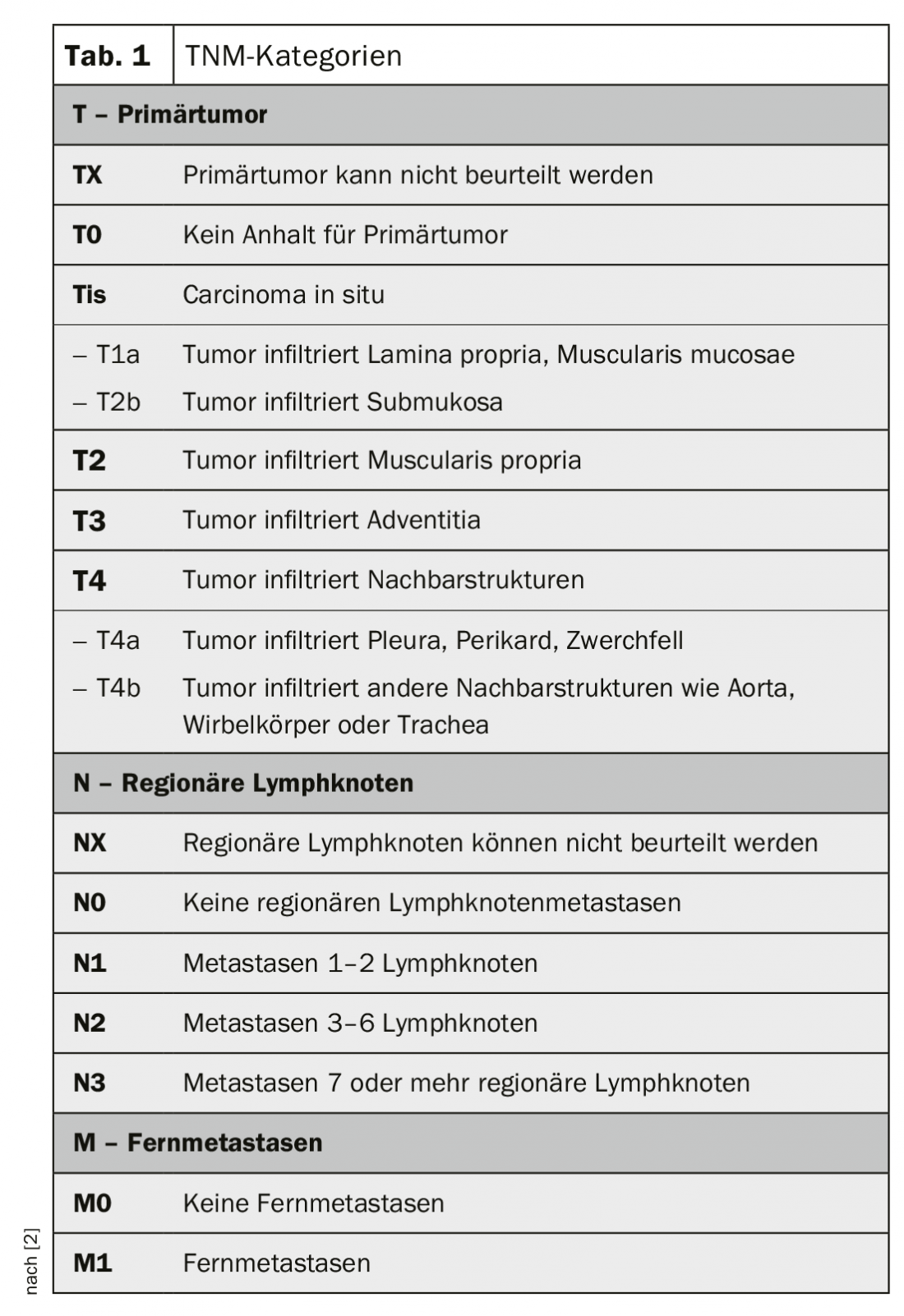
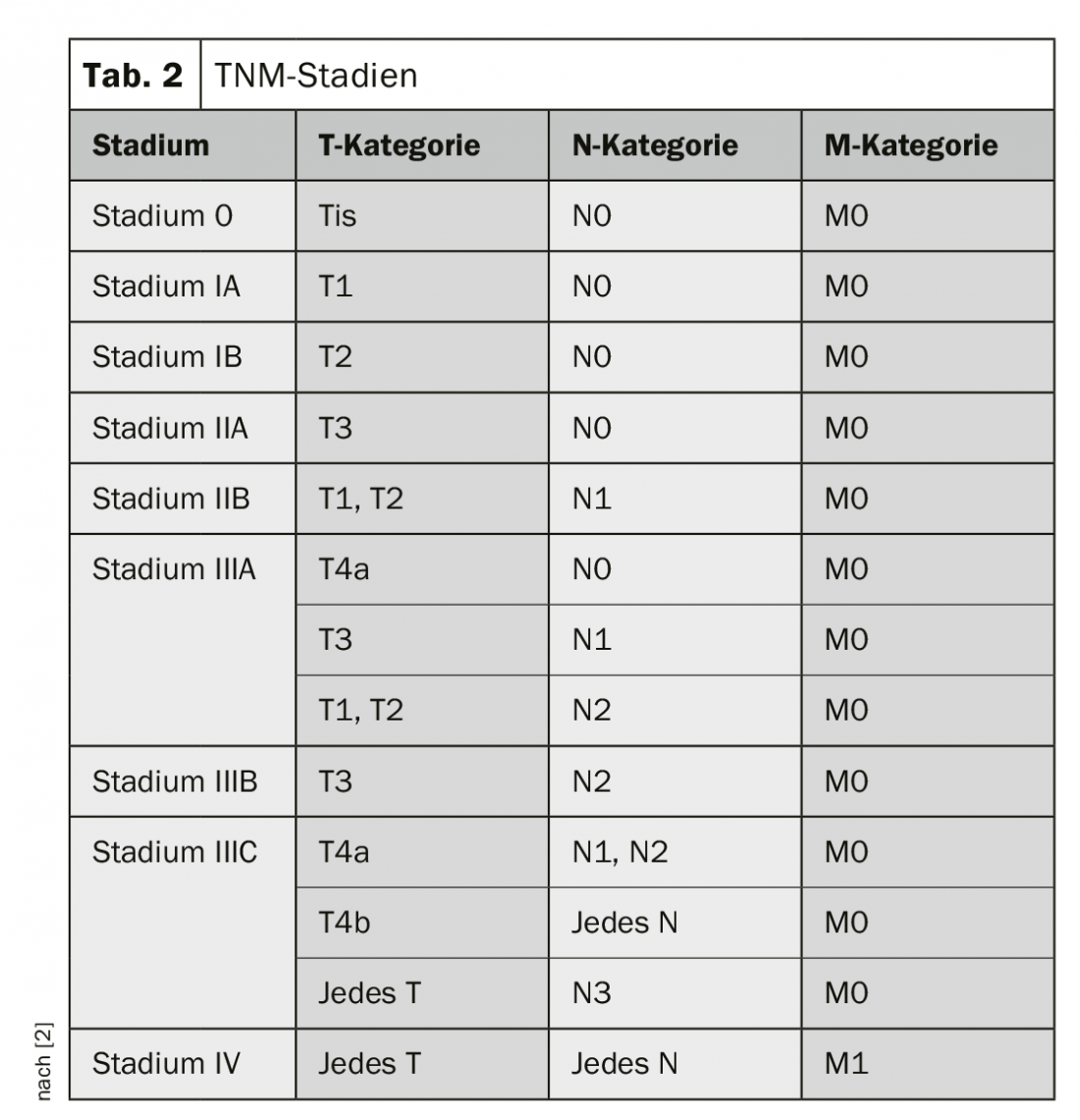
La classificazione e la stadiazione del carcinoma esofageo avviene secondo la classificazione TNM (Tab. 1 e 2) [4]. I carcinomi della giunzione esofago-gastrica vengono conteggiati come carcinomi esofagei, purché il loro epicentro non sia più di 2 cm distale alla linea Z (classificazione Nishi [5]). La classificazione di Siewert [6] può ancora essere decisiva per la terapia chirurgica. Allo stesso modo, i tipi Siewert I e II vengono trattati come carcinomi esofagei e il tipo III come carcinomi gastrici.
Terapia
Dal punto di vista terapeutico, l’uso del robot svolge un ruolo pionieristico. Il concetto di trattamento viene determinato dalla commissione tumori dopo la stadiazione. L’approccio multimodale è delineato nella Figura 1. Viene fatta una distinzione di base tra un approccio curativo e uno palliativo [2,3].
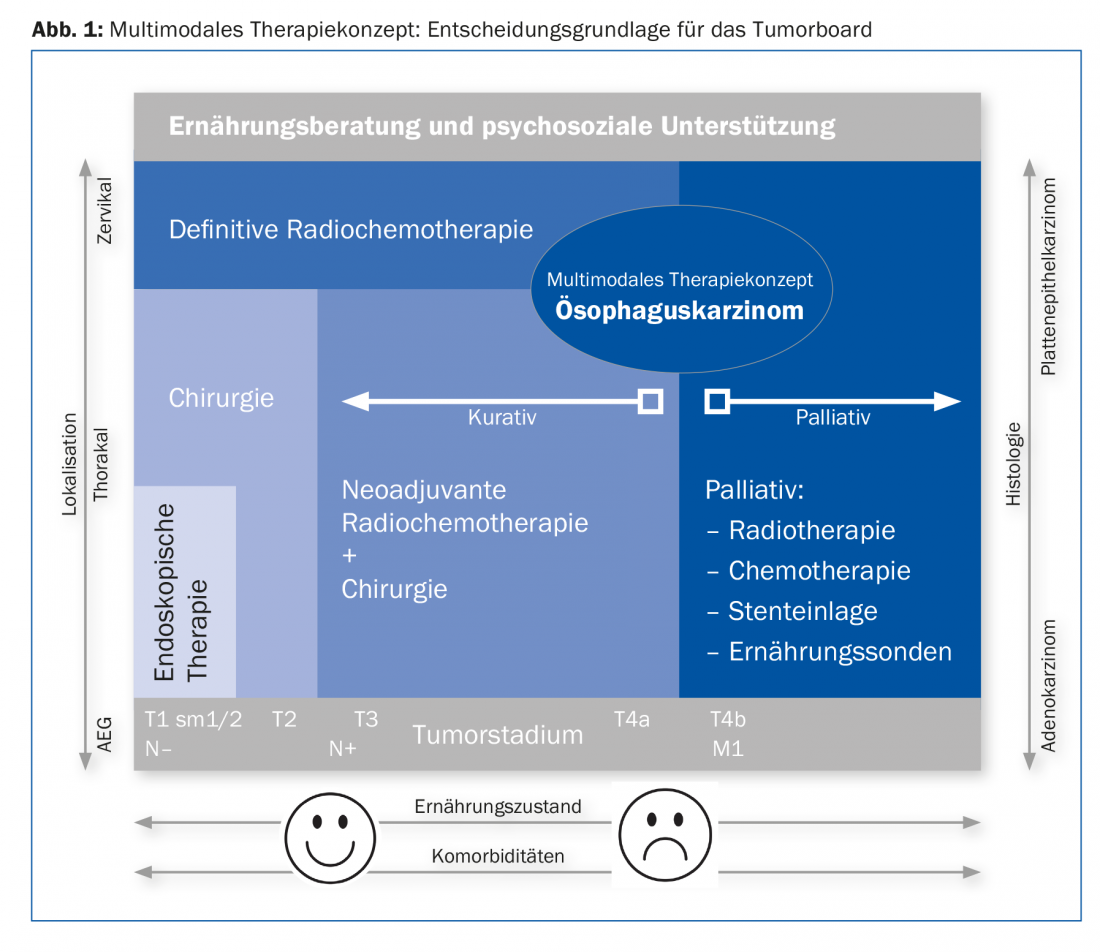
Curation
Se non c’è più di uno stadio tumorale T4a localmente senza metastasi a distanza, trattiamo secondo il concetto curativo. I carcinomi precoci (T1, sm1/sm2) senza fattori di rischio (L0, V0, massimo G2) possono essere trattati endoscopicamente. Per i carcinomi più avanzati, la chirurgia è il trattamento di scelta dopo la valutazione del rischio cardiaco, polmonare, epatico e metabolico. Operiamo i carcinomi da T2 a T3 o con uno stadio linfonodale positivo dopo il trattamento neoadiuvante. Diversi studi più ampi hanno dimostrato un vantaggio di sopravvivenza con la radiochemioterapia prima del trattamento [7,8]. Dopo il trattamento neoadiuvante, viene eseguita una ristadiazione per escludere le metastasi a distanza. Se si verificano metastasi a distanza durante o dopo la terapia, questa viene interrotta e si adotta un concetto palliativo. La finestra temporale ottimale per l’intervento chirurgico è di sei-otto settimane dopo il completamento della radiochemioterapia.
La radiochemioterapia è il trattamento di scelta per il carcinoma esofageo non resecabile e cervicale. L’intervento chirurgico ha un alto tasso di complicanze, in questo caso con una prognosi costante.
Lo stato nutrizionale ha una grande influenza sul decorso post-operatorio. Prima dell’intervento, la consulenza nutrizionale con cibo potabile (“immunonutrizione”) [9] e, se necessario, con un tubo di alimentazione ottimizza i prerequisiti.
Chirurgia robotica
Con la tecnica ibrida robot-assistita, si esegue un’esofagectomia subtotale transtoracica con resezione dello stomaco prossimale e ricostruzione con rialzo gastrico e anastomosi intratoracica alta (operazione di Lewis) per i carcinomi del terzo medio e distale [10]. Questa procedura a due cavità mostra meno reflusso post-operatorio grazie all’anastomosi intratoracica alta e consente un margine di sicurezza maggiore rispetto alle procedure transhiatali. Inoltre, è possibile eseguire una linfadenectomia pulita a due campi (toracico e addominale). La sopravvivenza aumenta con questo approccio [11].
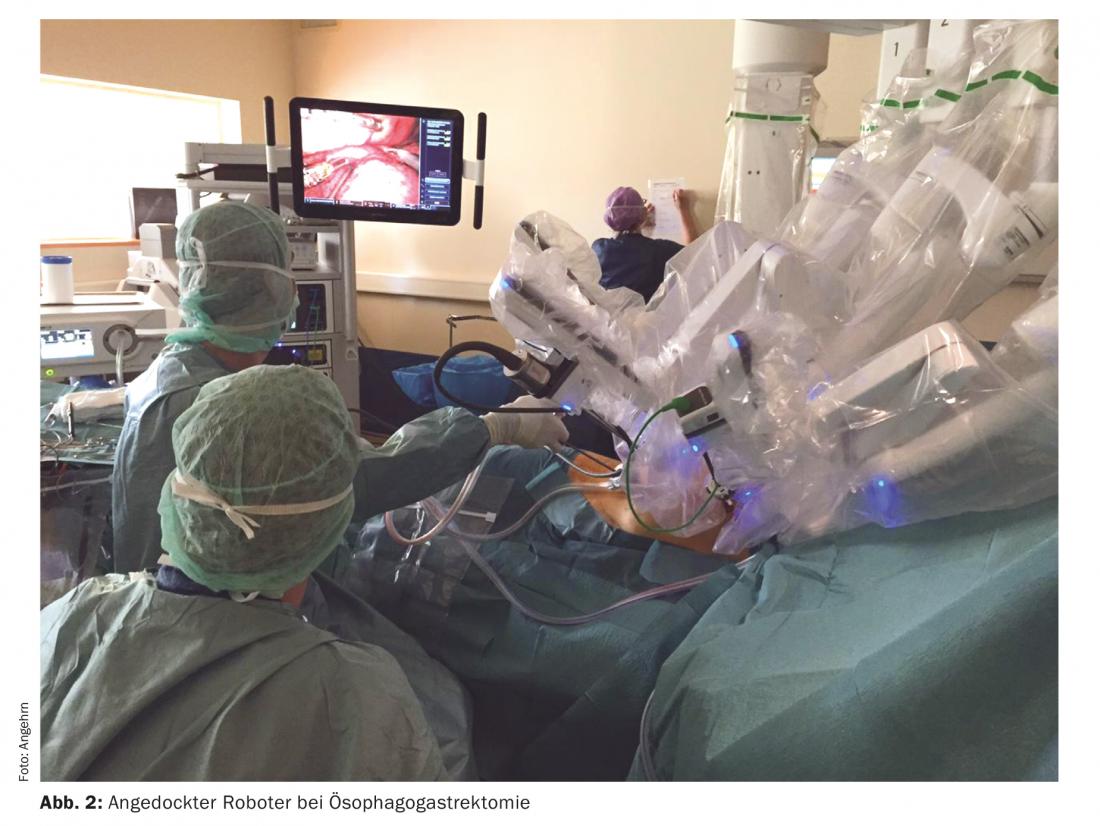
Per l’esofagectomia con il robot chirurgico Da Vinci Xi®, la parte addominale viene operata tramite laparotomia per la resezione gastrica prossimale con linfoadenectomia, e il tubo gastrico viene formato dallo stomaco residuo. La parte toracica viene eseguita interamente con il robot chirurgico. Vengono creati quattro trocars da 8 mm per il robot e una minitoracotomia sotto i 5 cm per rimuovere il resecato (Fig. 2). In questo modo si evita una toracotomia dolorosa associata a una maggiore morbilità postoperatoria. Il robot offre una visione tridimensionale ottimale con un ingrandimento fino a dieci volte e un’eccellente libertà di movimento. Ciò consente una linfadenectomia pulita e la sutura manuale robot-assistita dell’anastomosi intratoracica [12]. Uno studio prospettico randomizzato ha dimostrato un minor numero di complicazioni polmonari, un tempo di ospedalizzazione più breve e una migliore qualità di vita a favore della chirurgia esofagea mininvasiva rispetto alla chirurgia aperta [13]. Abbiamo eseguito la prima esofagectomia robot-assistita in Europa con il Da Vinci Xi® e ora abbiamo 30 esofagectomie robot-assistite all’attivo e siamo convinti di questa tecnica. Non abbiamo mai dovuto convertire, tutte le resezioni sono state eseguite in tessuto sano (R0) e la morbilità è stata inferiore rispetto alla chirurgia aperta. Nessun paziente è stato rioperato o è morto nei primi 30 giorni.
Palliazione
La chemioterapia viene discussa con i pazienti in una situazione palliativa. Questo persegue due obiettivi: Mantenere la qualità di vita e prolungare il tempo di sopravvivenza. La chemioterapia deve essere iniziata il prima possibile. Nella scelta del regime terapeutico, l’oncologia è guidata dalle condizioni generali del paziente, dai suoi desideri, dall’età e dalle comorbidità, nonché dalla tossicità. La terapia anticorpale aggiuntiva viene somministrata se HER2 è positivo nell’adenocarcinoma. L’inserimento di uno stent può migliorare le difficoltà di deglutizione.
Cura successiva
C’è una regolare richiesta di uno schema di follow-up per il carcinoma esofageo trattato, analogo alle raccomandazioni di consenso per il follow-up dopo il carcinoma colorettale operato in modo curativo [14]. Tali raccomandazioni non esistono. Le limitate opzioni di trattamento per le recidive e una situazione spesso palliativa rendono impossibile un approccio schematico standardizzato. Nella ricerca clinica, sono in corso tentativi isolati di sviluppare un follow-up strutturato [15]. Ciò rende ancora più importante la discussione coerente di ogni paziente nel consiglio interdisciplinare sui tumori. In questo modo il medico di famiglia riceve una raccomandazione personalizzata per l’assistenza successiva. L’assistenza di follow-up è orientata ai sintomi e si concentra sullo stato nutrizionale e sul supporto psicosociale. La disfunzione può indicare una recidiva. La consulenza nutrizionale già avviata in fase perioperatoria viene proseguita per garantire un apporto calorico e una quantità di bevande sufficienti. Se necessario, si raccomanda un follow-up individuale endoscopico o tomografico computerizzato dopo sei-dodici mesi presso la commissione tumori. I pazienti sottoposti a resezione endoscopica primaria vengono seguiti endoscopicamente.
Messaggi da portare a casa
- L’adenocarcinoma dell’esofago è in aumento.
- Il medico di famiglia può migliorare in modo decisivo la prognosi negativa attraverso la diagnosi precoce (sintomi di allarme).
- Si presuppone l’interdisciplinarità e le competenze di centro.
- La chirurgia robotica consente interventi più radicali in condizioni di visibilità ottimale.
Letteratura:
- Pennathur A, et al: Carcinoma esofageo. Lancet 2013; 381: 400-412.
- Porschen R, et al: S3-Leitlinie Diagnostik und Therapie der Plattenepithelkarzinome und Adenokarzinome des Ösophagus. Z Gastroenterol 2015; 53: 1288-1347.
- Lordick F, et al: Cancro dell’esofago: Linee guida di pratica clinica ESMO per la diagnosi, il trattamento e il follow-up. Ann Oncol 2016; 27(S5): v50-v57.
- Brierley JD, et al: Classificazione TNM dei tumori maligni. 8a ed. UICC – Controllo globale del cancro. Oxford, Regno Unito, Hoboken, NJ: John Wiley & Sons, Inc. 2016.
- Japan Esophageal Society: Classificazione giapponese del cancro esofageo. 11a edizione, parte II e III. Esofago 2017; 14: 37-65.
- Siewert JR, et al: Cancro cardiaco: tentativo di una classificazione terapeuticamente rilevante. Chirurgo 1987; 58: 25-32.
- Al-Batran SE, et al: Regressione istopatologica dopo il trattamento neoadiuvante con docetaxel, oxaliplatino, fluorouracile e leucovorin rispetto a epirubicina, cisplatino e fluorouracile o capecitabina in pazienti con adenocarcinoma gastrico o della giunzione gastroesofagea resecabile (FLOT4-AIO): risultati della parte di fase 2 di uno studio multicentrico, in aperto, randomizzato di fase 2/3. Lancet Oncol 2016; 17: 1697-1708.
- Shapiro J, et al: Chemioradioterapia neoadiuvante più chirurgia rispetto alla sola chirurgia per il cancro esofageo o giunzionale (CROSS): risultati a lungo termine di uno studio randomizzato controllato. Lancet Oncol 2015; 16: 1090-1098.
- Mudge L, et al: Immunonutrizione nei pazienti sottoposti a resezione del cancro esofageo. Dis Esophagus 2011 Apr; 24(3): 160-165.
- Lewis I: Il trattamento chirurgico del carcinoma dell’esofago; con particolare riferimento ad un nuovo intervento per le escrescenze del terzo medio. Br J Surg 1946 Jul; 34: 18-31.
- Peyre CG, et al: Il numero di linfonodi rimossi predice la sopravvivenza nel cancro esofageo: uno studio internazionale sull’impatto dell’estensione della resezione chirurgica. Ann Surg 2008; 248: 549-556.
- Cerfolio RJ, et al: Aspetti tecnici e risultati precoci dell’esofagectomia robotica con anastomosi toracica. J Thorac Cardiovasc Surg 2013 Jan; 145(1): 90-96.
- Biere SS, et al: Esofagectomia minimamente invasiva rispetto a quella aperta per i pazienti con cancro esofageo: uno studio multicentrico, open-label, randomizzato e controllato. Lancet 2012; 379: 1887-1892.
- Dorta G, Mottet C: Follow-up dopo polipectomia colonscopica e cancro colorettale rimosso. SMF 2016; 16(7): 164-167.
- Baiocchi GL, et al: Follow-up dopo la gastrectomia per cancro. La Conferenza di Consenso Charter Scaligero. Cancro gastrico 2016; 19: 15-20.
PRATICA GP 2018; 13(9): 29-33
InFo ONcOLOGIA & EMATOLOGIA 2019; 7(6): 11-14.