L’insufficienza cardiaca acuta è una situazione di pericolo di vita che richiede un’azione rapida e pianificata. Come avviene il chiarimento? Quali sono le misure terapeutiche disponibili? Uno sguardo alla stabilizzazione iniziale in ospedale.
L’insufficienza cardiaca acuta (AHI) è definita come una rapida insorgenza o un peggioramento dei sintomi (spesso dispnea e ortopnea) e/o della situazione clinica.
Segni di insufficienza cardiaca (soprattutto congestione). Si tratta di una situazione medica pericolosa per la vita, che richiede una valutazione e un trattamento urgenti e spesso il ricovero in ospedale [1].
Circa l’80% dei pazienti con AHI ha un’insufficienza cardiaca cronica preesistente. Più del 50% ha un’insufficienza cardiaca con frazione di eiezione ventricolare sinistra conservata (HFpEF) [2]. In più della metà dei pazienti è possibile identificare un fattore scatenante. La malattia coronarica e la fibrillazione atriale sono le condizioni cardiache di base più comuni, e il diabete è una comorbidità molto comune. La maggior parte dei pazienti è iper- o normotesa al momento del ricovero. Solo circa il 5-7% di tutti gli AHI sono ipotensivi (pressione arteriosa sistolica <90 mmHg), il che è associato a una prognosi sfavorevole. Ciò è particolarmente vero se contemporaneamente è presente un’ipoperfusione (periferia fredda) [3].
Diagnostica e valutazione prognostica iniziale
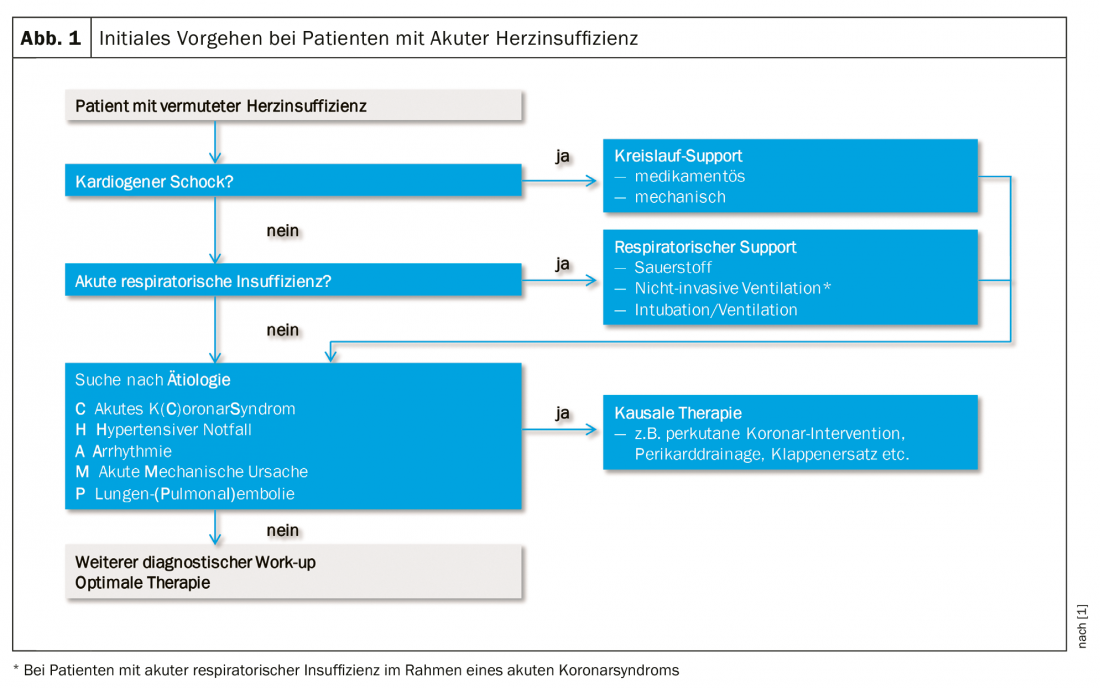
Il work-up diagnostico deve essere avviato il prima possibile (idealmente nella fase pre-ospedaliera, soprattutto l’ECG), in modo da poter iniziare precocemente la terapia causale. Il beneficio della diagnosi e della terapia precoce è ben noto per l’IMA nel contesto della sindrome coronarica acuta. Nella gestione dell’AHI, la diagnostica e la terapia vanno di pari passo, ricercando sistematicamente le condizioni e i meccanismi potenzialmente letali e trattandoli il più rapidamente possibile. (Fig. 1). Parte del work-up immediato è anche la ricerca di cause alternative alla dispnea acuta, principalmente polmonite, anemia grave e insufficienza renale acuta. Oltre alla valutazione clinica del profilo emodinamico, la diagnosi iniziale del sospetto di AHI comprende i seguenti componenti diagnostici:
BNP o NT-proBNP: un AHI può essere escluso con valori <100 ng/l o <300 ng/l. I valori elevati sono proporzionali all’entità dello stress miocardico. Più alti sono i peptidi natriuretici, meno favorevole è la prognosi.
ECG a 12 derivazioni: i valori normali dell’ECG rendono improbabile un AHI. L’ECG può anche fornire indizi sul meccanismo dell’insufficienza cardiaca (infarto acuto, bradicardia, tachicardia).
Radiografia del torace: mostrerà se c’è congestione venosa polmonare, versamenti pleurici, edema interstiziale o alveolare o cardiomegalia. Si usa anche per cercare cause non cardiache di dispnea acuta, come polmonite o pneumotorace.
Vari parametri di laboratorio: I marcatori come l’emoglobina, il TSH, la CRP, la creatinina e le transaminasi possono essere utilizzati per indagare i meccanismi e i cofattori, nonché gli effetti dell’AHI. Anche la troponina cardiaca è un parametro, ma deve essere considerata come un marcatore quantitativo aspecifico del danno miocardico e non sempre indicativo di infarto acuto.
Ecocardiografia: deve essere eseguita entro 24-48 ore in tutti i pazienti con AHI, se la patologia cardiaca è sconosciuta o non adeguatamente nota. I pazienti in shock cardiogeno, invece, richiedono un’ecocardiografia immediata, tra l’altro per quanto riguarda i problemi meccanici che richiedono un trattamento acuto, come la complicanza meccanica dell’infarto e l’insufficienza valvolare acuta grave.
Il profilo emodinamico come punto di partenza
Se la terapia causale è possibile (soprattutto nella sindrome coronarica acuta, nell’emergenza ipertensiva, nella tachicardia o nella bradicardia, nell’embolia polmonare acuta e nelle complicanze meccaniche dell’infarto), questa deve essere effettuata il prima possibile. Altrimenti, si inizia una terapia di supporto generale in base al profilo clinico ed emodinamico [1,4]. Queste misure di supporto sono stabilite in base all’esperienza clinica, ma non hanno un effetto dimostrato sulla prognosi [5]. Non esiste ancora un farmaco la cui somministrazione in fase acuta riduca la mortalità a breve o a lungo termine. L’obiettivo di queste misure è un rapido miglioramento dei sintomi e la stabilizzazione clinica, in modo da poter instaurare la terapia dell’insufficienza cardiaca cronica. Le forme di trattamento dell’AHI possono essere suddivise in misure acute, misure durante il ricovero e misure prima della dimissione. Questo articolo si concentra sulla diagnosi e sulle misure di stabilizzazione iniziale durante il ricovero. A seconda della gravità, il trattamento iniziale si svolge nel reparto di emergenza/reparto normale o nel reparto di emergenza/unità di terapia intensiva, se necessario con un monitoraggio invasivo.
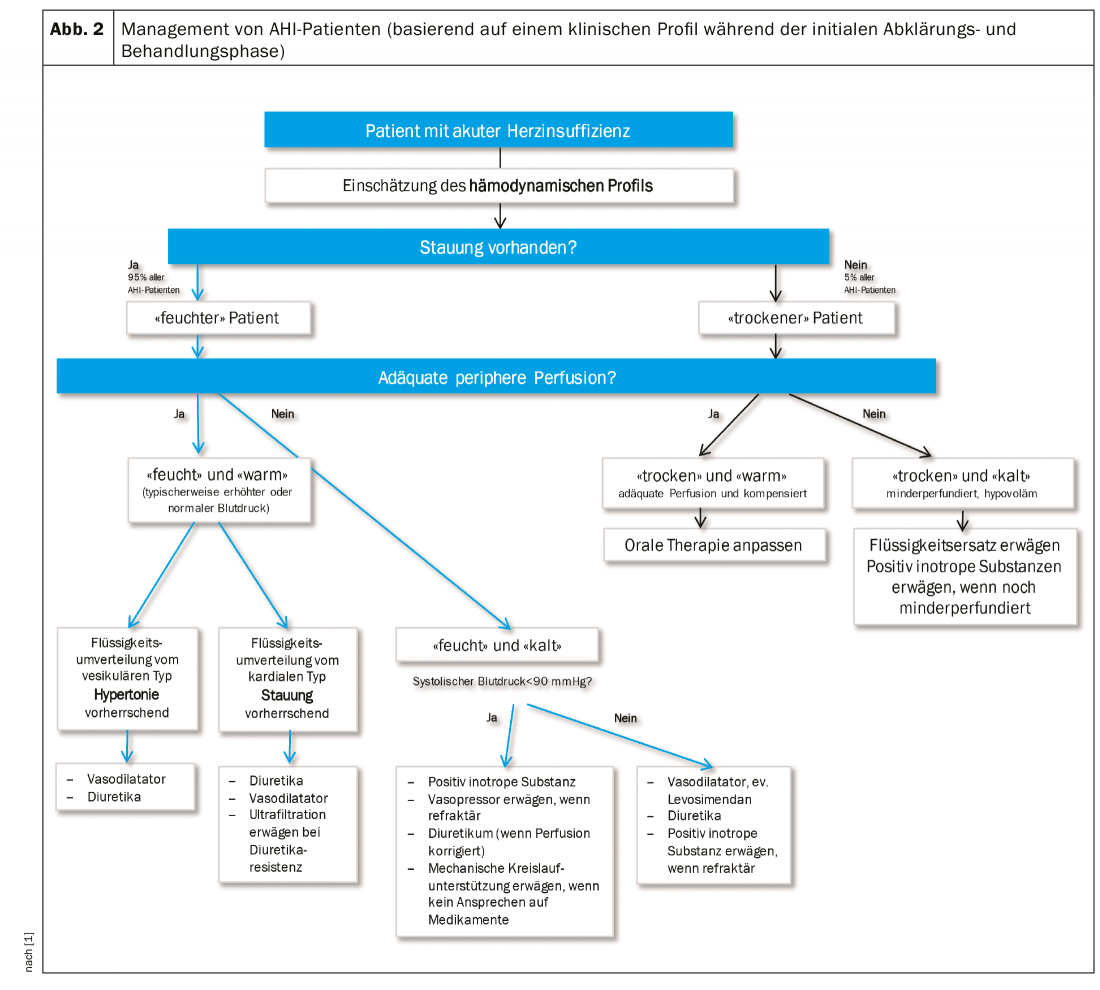
In base allo stato di idratazione (“umido” o “secco”) e alla perfusione tissutale (“caldo” o “freddo”, spesso sinonimo di normotonico vs. ipotonico), si possono distinguere quattro profili emodinamici, che determinano la direzione approssimativa della terapia (Fig.2).
Misure generali
La somministrazione di ossigeno deve essere limitata ai pazienti con ipossiemia (SpO2 <90%). La ventilazione non invasiva (CPAP/BiPAP) deve essere presa in considerazione nei casi di dispnea pronunciata o di ipossiemia (frequenza respiratoria >25/min, SpO2 <90%) e iniziata il prima possibile per evitare l’intubazione. Se è necessaria l’intubazione o l’elettrocardioversione, la sedazione con propofol deve essere usata con cautela (rischio di ipotensione, cardiodepressione). La sedazione con midazolam è meno problematica, in quanto si prevedono meno effetti collaterali cardiaci.
Terapia farmacologica
In caso di peggioramento acuto di un’insufficienza cardiaca cronica preesistente, il trattamento farmacologico preesistente con ACE-inibitori, bloccanti del recettore dell’angiotensina o sacubitril-valsartan, betabloccanti e bloccanti del recettore dei mineralocorticoidi deve essere generalmente continuato. In caso di ipotensione (pressione arteriosa sistolica<85 mmHg), è necessario ridurre la dose o sospendere temporaneamente la terapia orale per l’insufficienza cardiaca. La seguente panoramica della terapia farmacologica dell’insufficienza cardiaca è intesa come uno schema che deve essere adattato alla situazione individuale del paziente con insufficienza cardiaca.
Nitrati/vasodilatatori: Tutti i vasodilatatori hanno un duplice effetto di riduzione del tono venoso (precarico del cuore) e arterioso (riduzione del postcarico). I vasodilatatori sono controindicati in presenza di una pressione arteriosa sistolica <90 mmHg. L’uso molto cauto è indicato anche nei casi di stenosi significativa della valvola mitrale e aortica. La somministrazione continua di nitrati può portare allo sviluppo di una tolleranza.
La somministrazione perorale di nitroglicerina avviene inizialmente in due dosi di nitroglicerina à 0,4 mg o una capsula à 0,8 mg. Sono consentite ripetizioni dopo 5-10 minuti, controllando la pressione sanguigna. Nel corso, è possibile passare all’applicazione transdermica (5-10 mg).
I vasodilatatori per via endovenosa (nitroglicerina, isosorbide dinitrato, nitroprussiato o nesiritide) sono molto efficaci nel ridurre la dispnea sotto monitoraggio nelle unità di cure intermedie o di terapia intensiva, anche se ad oggi non esistono prove scientifiche [6].
Diuretici: Nelle attuali linee guida, il diuretico è il farmaco principale per il trattamento dell’AHI [7]. Tuttavia, questo vale solo per i pazienti con sovraccarico di volume, principalmente il paziente “umido-caldo” e il paziente “umido-freddo”, se la pressione arteriosa sistolica è >90 mmHg. Se si tratta principalmente di un deragliamento ipertensivo che ha portato allo scompenso cardiaco sinistro, il diuretico deve essere interrotto a favore del nitrato, se possibile.
L’approccio iniziale al trattamento del sovraccarico di volume è una combinazione di diuretici e vasodilatatori, se la pressione sanguigna lo consente (>90 mmHg). È necessario un attento monitoraggio dello stato di idratazione mediante controlli clinici (ad esempio, riempimento della vena giugulare, congestione polmonare, edema periferico, peso corporeo) e di laboratorio (potassio e creatinina sierici) [6]. Il riquadro riassume le linee di direzione del dosaggio.

Inotropi/vasopressori: i farmaci con una marcata vasocostrizione periferica, come la noradrenalina o la dopamina, in dosi più elevate (>5 µg) possono essere presi in considerazione per l’uso a breve termine nella situazione acuta, se la perfusione tissutale è insufficiente, nonostante un adeguato stato di riempimento, per rifornire gli organi vitali. Tuttavia, ciò avviene al prezzo di un aumento del postcarico e di un maggior rischio di aritmia. In alternativa, levosimendan può essere utilizzato per i valori di pressione arteriosa sistolica >85 mmHg. I dettagli relativi al dosaggio si trovano nella linea guida europea sull’AHI [1].
Beta-bloccante/Digossina: in caso di peggioramento acuto di un’insufficienza cardiaca cronica preesistente con terapia beta-bloccante consolidata, il beta-bloccante non deve essere interrotto completamente, se possibile, ma la dose deve essere temporaneamente ridotta. Per il trattamento dell’insufficienza cardiaca acuta, il nuovo uso di un beta-bloccante è indicato solo in casi eccezionali, ad esempio in caso di ostruzione dinamica intraventricolare. La somministrazione di un beta-bloccante per controllare la frequenza cardiaca (soprattutto per via endovenosa) senza conoscere la funzione LV può causare uno shock cardiogeno. Tuttavia, nella fibrillazione atriale tachicardica e nella funzione sistolica LV conservata, determinata dall’ecocardiografia, il beta-bloccante può essere somministrato per il controllo della frequenza. La digossina è anche un’opzione per il controllo della frequenza nella fibrillazione atriale, anche con una LVEF ridotta.
Profilassi del tromboembolismo, anticoagulazione, inibizione dell’aggregazione piastrinica: la profilassi del tromboembolismo, principalmente con eparina a basso peso molecolare, è chiaramente raccomandata per ridurre il rischio di trombosi/embolia polmonare. Per la fibrillazione/flutter atriale e la sindrome coronarica acuta, si applicano le linee guida esistenti per l’anticoagulazione e la terapia antitrombotica.
Antiaritmici/cardioversione: oltre alla cardioversione elettrica, i farmaci antiaritmici come l’amiodarone, la digossina e (se la funzione LV è notoriamente conservata) i beta-bloccanti possono essere utilizzati nei casi di AHI prevalentemente legato alla tachicardia. Se la FA tachicardica è mal tollerata dal punto di vista emodinamico, potrebbe essere necessaria una conversione immediata (elettroconversione). In alternativa, per ottenere un’elettroconversione di successo con un effetto duraturo da uno a tre giorni, si può eseguire la saturazione con amiodaroni. Gli antiaritmici di classe IB/C sono controindicati nella disfunzione LV [8,11].
Oppiacei, ansiolitici e sedativi: gli oppiacei possono essere considerati per un uso cauto in pazienti ansiosi con grave agitazione e dispnea. Tuttavia, una possibile ipopnea deve essere rilevata precocemente attraverso un monitoraggio adeguato. L’uso prudente di benzodiazepine (diazepam, lorazepam) è un’alternativa agli oppiacei nei pazienti agitati.
Ulteriori opzioni terapeutiche
Procedure di sostituzione renale: Il coinvolgimento precoce dei nefrologi è importante nei pazienti con peggioramento della funzione renale nell’AHI. L’uso interdisciplinare di una procedura di sostituzione renale è limitato ai pazienti con AHI “umido e caldo” che non rispondono o rispondono in modo inadeguato alla terapia diuretica. Le attuali linee guida europee menzionano i seguenti criteri: Oliguria senza risposta adeguata alle dosi più alte di diuretici, potassio sierico >6,5 mmol/l, urea sierica >25 mmol/l, creatinina sierica >300 µmol/l e pH <7,2 [1].
Opzioni di terapia meccanica: L’approccio dipende dalla situazione clinica e dalla causa ipotizzata dell’AHI. In caso di ischemia grave con shock cardiogeno, il vaso responsabile dell’ischemia acuta viene trattato principalmente con un intervento coronarico percutaneo. I risultati recenti mostrano che il trattamento immediato di tutti i vasi coronarici non migliora l’esito [9]. L’uso di dispositivi di supporto circolatorio (pompa a palloncino intra-aortica, dispositivi di assistenza ventricolare) deve essere discusso e determinato nel team cardiaco con il coinvolgimento dei medici di emergenza e di terapia intensiva.
L’indicazione convenzionale per la pompa a palloncino intra-aortica (IABP) è prima della correzione chirurgica di specifici problemi meccanici acuti (nel rigurgito mitralico acuto grave, eventualmente nella rottura del setto ventricolare) e nel NSTEMI con malattia grave a 3 vasi in vista di un intervento cardiaco urgente. Per altre cause di shock cardiogeno, non ci sono buone prove scientifiche del beneficio della IABP. I dispositivi di assistenza ventricolare e altre forme di supporto meccanico vengono utilizzati come ponte verso la decisione o, in pazienti selezionati, a lungo termine [1]. Per determinare la tempistica appropriata dell’intervento cardiochirurgico per l’endocardite, è necessario richiedere precocemente il parere interdisciplinare dell’intero team cardiaco o endocardico. L’inserimento acuto di VA-ECMO nei pazienti con shock cardiogeno, in particolare. dopo la rianimazione con un “tempo di non flusso” relativamente breve, dovrebbero essere discussi precocemente e in modo interdisciplinare con il coinvolgimento dei medici di emergenza e di terapia intensiva.
Puntura pleurica e ascitica: la puntura pleurica può portare a una rapida diminuzione della dispnea. La puntura dell’ascite può, attraverso una diminuzione della pressione intra-addominale, contribuire a un miglioramento della pressione transrenale e indirettamente a un miglioramento della funzione renale [10].
Messaggi da portare a casa
- L’insufficienza cardiaca acuta è la prima manifestazione della malattia cardiaca in circa il 20% dei casi. Di solito è espressione di un peggioramento acuto dell’insufficienza cardiaca cronica.
- Si tratta di una situazione di pericolo di vita che richiede un’azione rapida e strutturata.
- Le misure terapeutiche si basano sul profilo emodinamico, valutando la perfusione (“caldo” vs. “freddo”) da un lato e la congestione (“umido” vs. “secco”) dall’altro.
- Nei pazienti con dispnea acuta e sospetto di insufficienza cardiaca acuta, la misurazione dei peptidi natriuretici aiuta nella diagnosi differenziale. Fornisce anche informazioni prognostiche (raccomandazione di classe IA).
Letteratura:
- Ponikowski P, Voors AA, Anker S, et al: Linee guida ESC 2016 per la diagnosi e il trattamento dell’insufficienza cardiaca acuta e cronica. Eur Heart J 2016; 37: 2129-2200.
- Maeder MT, Buser M, Rickli H, et al: Insufficienza cardiaca con funzione ventricolare sinistra conservata (HFpEF). Therapeutische Umschau 2018; 75: 161-169.
- Ambrosy AP, Fornarow GC, Butler J, et al: L’onere sanitario ed economico globale dei ricoveri per insufficienza cardiaca: lezioni apprese dai registri di insufficienza cardiaca ospedalizzati. J Am Coll Cardiol 2014; 63: 1123-1133.
- Nohria A, Tsang SW, Fang JC, et al: La valutazione clinica identifica i profili emodinamici che predicono gli esiti nei pazienti ricoverati con insufficienza cardiaca. J Am Coll Cardiol 2003; 41: 1797-1804.
- Cheema B, Ambrosy AP, Kaplan RM, et al: Lezioni apprese nell’insufficienza cardiaca acuta. Eur J Heart Failure 2018; 20: 630-641.
- Wakai A, McCabe A, Kidney R, et al: Nitrati per le sindromi da insufficienza cardiaca acuta. Cochrane Database Syst Rev 2013; 8: CD005151.
- Felker GM, Lee KL, Bull DA, et al: Strategie diuretiche nei pazienti con insufficienza cardiaca acuta scompensata. N Engl J Med 2011; 364: 797-805.
- Linee guida ERC per la rianimazione 2015. Rianimazione 2015; 95: 1-80.
- Thiele H, Akin I, Sandri M, et al: Esiti a un anno dopo strategie PCI nello shock cardiogeno. N Engl J Med 2018; doi: 10.1056/NEJMoa1808788 (in corso di stampa).
- Mullens W, Abrahams Z, Francis GS, et al: La riduzione tempestiva della pressione intra-addominale in seguito alla rimozione meccanica di grandi volumi di fluidi migliora l’insufficienza renale nell’insufficienza cardiaca scompensata refrattaria. J Card Fail 2008; 14: 508-514.
PRATICA GP 2019; 14(8): 9-13