La pleura è uno strato sieroso che ricopre gli organi toracici e la parte scheletrica interna della cavità toracica. La piccola quantità normale di liquido pleurico responsabile dello scivolamento pleurico non irritante viene prodotta e riassorbita attraverso le vie linfatiche, principalmente nella pleura parietale.
La pleura è uno strato sieroso che ricopre gli organi toracici e la parte scheletrica interna della cavità toracica. La pressione negativa fisiologica nello spazio pleurico per mantenere una pressione transpolmonare positiva è -3-5 cm H2O. La piccola quantità normale di liquido pleurico responsabile dello scivolamento pleurico non irritante viene prodotta e riassorbita attraverso le vie linfatiche, principalmente nella pleura parietale. Questa capacità può aumentare di un fattore fino a 20, a seconda della richiesta, quindi un versamento pleurico rilevante si verifica solo con un aumento significativo della quantità di fluido prodotto o con una ridotta capacità di riassorbimento. Il diaframma ha la funzione di una pompa per questo, che contribuisce anche all’omeostasi pleurica.
L’esame ecografico del torace e della pleura deve essere eseguito idealmente in posizione seduta. Dal punto di vista sonografico, è possibile vedere circa il 70% della pleura, mentre le parti della pleura coperte dalle costole possono spesso essere viste inclinando il trasduttore. Per ottenere una visione d’insieme, l’esame deve essere iniziato con un trasduttore convesso (3-5 MHz); per una valutazione più dettagliata delle strutture vicine al trasduttore sulla parete toracica, può essere utile l’uso aggiuntivo di un trasduttore lineare a frequenza più elevata. Le onde sonore vengono riflesse da interfacce con un’elevata differenza di impedenza, quindi la superficie delle costole e la pleura viscerale rappresentano una barriera naturale all’imaging a ultrasuoni.
Pleurasono come metodo di rilevamento più sensibile
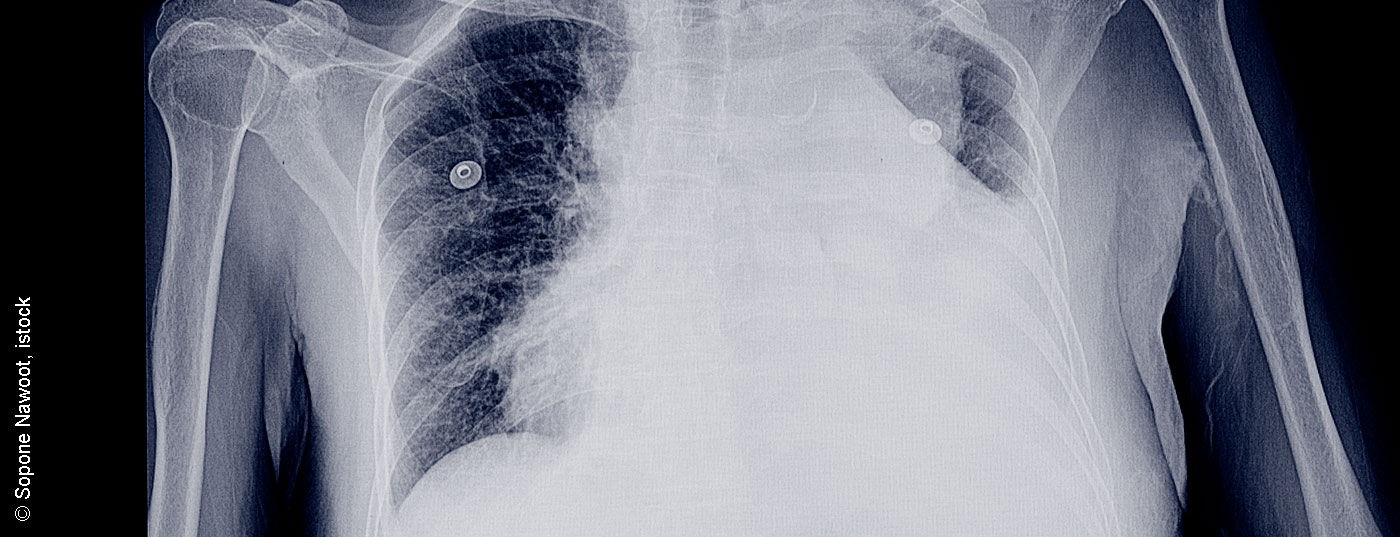
Il rilevamento del fluido nella cavità pleurica è stato uno dei primi e tuttora uno dei quesiti più importanti nella diagnostica clinica a ultrasuoni. Anche le più piccole quantità di fluido possono essere rilevate ecograficamente – molto prima rispetto alla tomografia computerizzata o persino alle radiografie. Esistono diverse formule semplici per quantificare la quantità di effluente, che può essere particolarmente importante per i controlli di avanzamento. A tal fine è importante la riproducibilità dell’esame e della posizione del trasduttore. Nella pratica clinica quotidiana, ad esempio, una semplice misurazione dell’altezza del versamento sottopolmonare, cioè la distanza tra il bordo inferiore del polmone e il diaframma, è molto pratica: così è possibile distinguere tra versamento basso (<2 cm), moderato (2-5 cm) e grande (>5 cm). Con l’aumentare dell’esperienza degli esami, questa è una procedura sufficiente per la routine clinica, in quanto la quantità assoluta di versamento non è di solito importante. Tutte le formule di stima del volume possono essere utilizzate solo per i drenaggi liberi e non per i versamenti pleurici incapsulati o settati.
I versamenti pleurici possono avere diverse cause. L’immagine ecografica del versamento da sola spesso non fornisce informazioni sufficienti per determinare la causa del versamento. Tuttavia, l’ecografia offre notevoli vantaggi, soprattutto rispetto alla tomografia computerizzata:
- Senza radiazioni,
- una rappresentazione significativamente migliore delle delicate strutture solide presenti nell’effusione,
- come procedura in tempo reale, fornisce inoltre una valutazione dinamica dello scorrimento polmonare, nonché della ventilazione e del flusso sanguigno.
La causa dell’atelettasia può spesso essere differenziata ecograficamente.
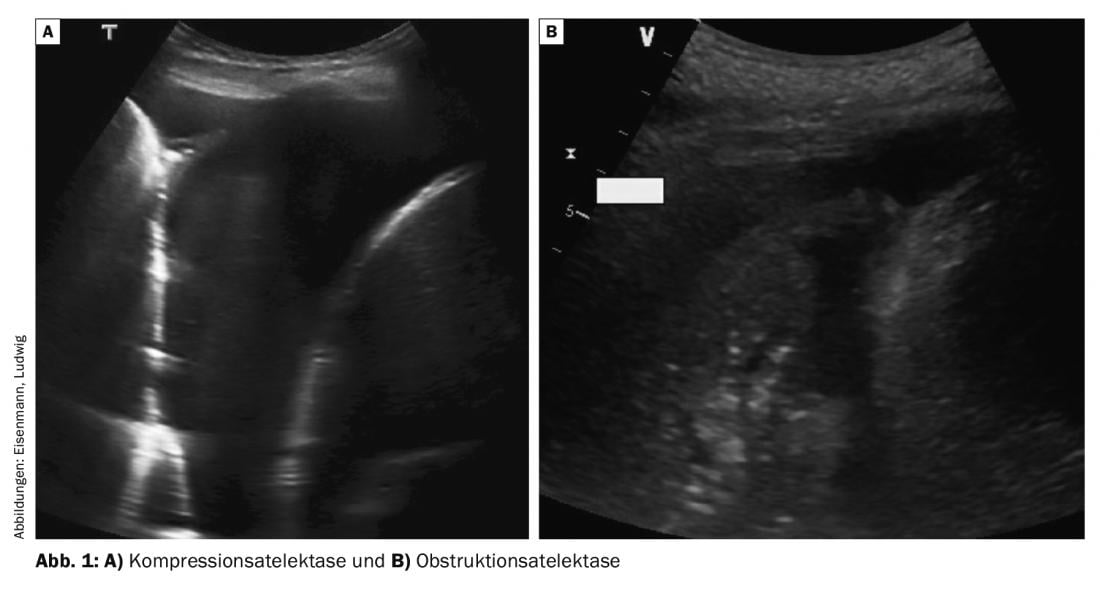
I versamenti più grandi causano uno spostamento caudale del diaframma e il polmone adiacente – inizialmente il lobo inferiore – viene compresso. Questa atelettasia compressiva omogenea si muove in modo sincrono con il respiro e le pulsazioni nell’effusione (il cosiddetto “dito ondeggiante”) e spesso può essere parzialmente riventilata durante l’ispirazione profonda (fig. 1A) . Nella dispnea, la toracentesi terapeutica può ottenere una rapida espansione e quindi un sollievo dai sintomi in questa situazione. Al contrario, in caso di ostruzione delle vie aeree centrali (ad esempio, a causa di un tumore, di una secrezione o di un corpo estraneo), si verifica un’atelettasia ostruttiva, che si presenta come meno compressa e poco mobile (Fig. 1B). Spesso si possono visualizzare anche i bronchi pieni di liquido a causa della ritenzione di secrezioni (fluidobroncogramma). La quantità di versamento pleurico è solitamente minore nell’atelettasia ostruttiva; la puntura terapeutica del versamento per alleviare la dispnea non è efficace se non si corregge anche la causa bronchiale.
Ulteriori indicazioni ecografiche sulla genesi dell’effusione possono essere ottenute dai risultati concomitanti nelle strutture adiacenti (Tabella 1).
Puntura pleurica sotto visione ecografica
Ogni versamento pleurico deve essere perforato una volta a scopo diagnostico. Nel caso di effusioni bilaterali, questo deve essere fatto separatamente e, se necessario, su due lati, poiché le cause possono essere diverse. Le punture di effusione e i sistemi di drenaggio vengono eseguiti sul margine superiore delle costole. Qualsiasi decorso vascolare aberrante deve essere escluso mediante ecografia prima della puntura. Questo di solito evita in modo affidabile la lesione dei vasi intercostali e dei cordoni nervosi.
Il monitoraggio della puntura può essere effettuato – analogamente alla puntura vascolare, ad esempio – attraverso la visualizzazione continua dello strumento di puntura inserito; in caso di possibile contatto dello strumento di puntura con il trasduttore, è necessario prestare attenzione per garantire l’assoluta sterilità. Per grandi quantità di liquido, invece, è sufficiente anche la marcatura ecografica del sito di puntura.
Per la valutazione dell’effusione, si distingue tra un trasudato e un essudato sulla base del profilo paraclinico dell’effusione, utilizzando i criteri Light. I parametri essenziali in questo caso sono i rapporti siero/output di proteine, glucosio e LDH. Un versamento pleurico non chiaro deve essere esaminato anche dal punto di vista microbiologico, ma questo spesso non consente una determinazione affidabile dell’agente patogeno. La sensibilità è spesso migliorata da un’ulteriore biopsia della pleura parietale per l’osservazione del materiale microbiologico.
Per evitare un edema da riespansione clinicamente significativo, è comune limitare la quantità che può essere perforata in una sessione a 1-1,5 litri, anche se i dati non forniscono prove convincenti. Per i versamenti più grandi, il drenaggio frazionato attraverso un catetere a lume sottile è quindi un’opzione, in modo da evitare il trauma da puntura ripetuta. Questo può essere posizionato con la tecnica Seldinger, ad esempio.
Dopo la puntura, è sempre necessario un controllo di imaging per escludere uno pneumotorace. A questo scopo, si dovrebbe imparare a utilizzare l’ecografia ed evitare la radiografia. In particolare, l’esclusione di uno pneumotorace è, con un po’ di pratica, più affidabile con l’ecografia che con la radiografia.
L’ecografia dettagliata è utile per domande particolari
Un’ecografia dettagliata può fornire ulteriori informazioni per le seguenti domande:
Versamento parapneumonico, empiema: i versamenti pleurici parapneumonici si sviluppano in circa la metà dei pazienti con polmonite. Clinicamente, questo può essere sospettato non appena un dolore pleuritico iniziale viene sospeso nella polmonite. Il più delle volte, si tratta di un’effusione passiva, ristretta e non complicata. Nel 10% dei casi, tuttavia, segue un versamento pleurico più grande e complicato o un empiema pleurico. Pertanto, la pleuropolmonite grave, in particolare, dovrebbe essere monitorata con la diagnostica per immagini nel corso del trattamento; idealmente, un’immagine ecografica può essere utilizzata come dato di riferimento per il confronto.
Dal punto di vista sonografico, i diversi stadi dell’effusione parapneumonica e dell’empiema pleurico possono essere ben distinti l’uno dall’altro e anche meglio della tomografia computerizzata (tab. 2).

Tumori pleurici: viene fatta una distinzione tra alterazioni pleuriche benigne e maligne. Le alterazioni maligne, clinicamente molto più frequenti, si dividono in alterazioni primarie e secondarie.
Dal punto di vista sonografico, è riconoscibile un allargamento della pleura parietale, che può essere chiaramente >di 1 cm nei reperti maligni, ha una superficie irregolare, occasionalmente provoca anche cambiamenti nodulari e può crescere nella parete toracica. La sonografia duplex o l’uso di mezzi di contrasto ecografici possono rilevare la neovascolarizzazione patologica. L’esame deve essere eseguito con uno scanner lineare e una frequenza sonora elevata, in quanto ciò fornisce una risoluzione ottimale della distanza ravvicinata.
Mesotelioma pleurico: nella neoplasia pleurica primaria, il mesotelioma pleurico è una malattia rara. Occasionalmente si verifica in modo sporadico e molto più frequentemente in relazione a una storia di esposizione all’amianto. I sintomi clinici si sviluppano lentamente e sono inizialmente poco caratteristici. Le indicazioni sonografiche del mesotelioma sono una massa tumorale di grandi dimensioni e l’infiltrazione della parete toracica (e il dolore associato).
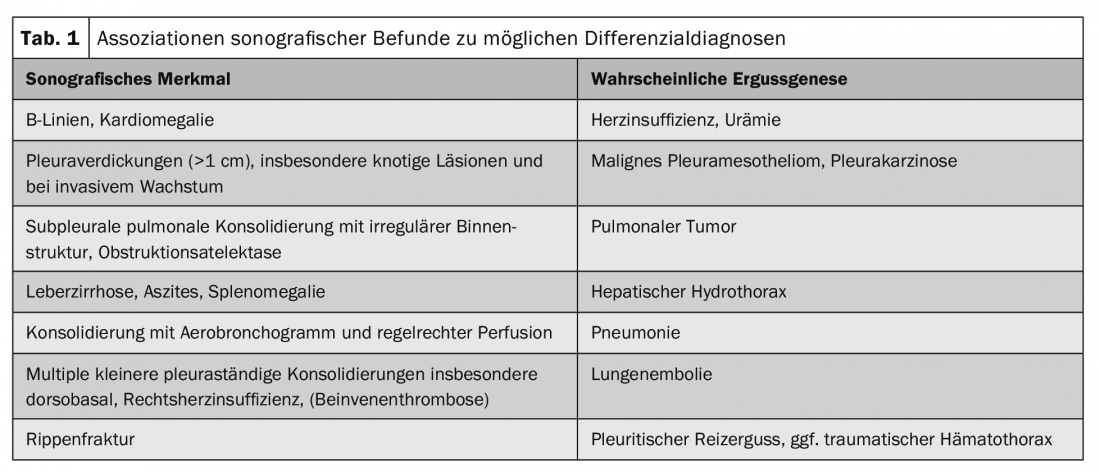
I versamenti pleurici maligni si verificano fino al 15% di tutti i pazienti con tumore, sono associati ad un aumento della morbilità e della mortalità e spesso segnano il passaggio ad uno stadio tumorale palliativo. Le cause extratoraciche più comuni sono il carcinoma mammario, il carcinoma gastrico e il linfoma. Spesso la malignità non può essere rilevata dalla puntura: La sensibilità e la specificità della citologia dell’effusione sono rispettivamente solo del 58% e del 97% per tutte le entità tumorali. Un reperto ecografico tipico della pleura parietale può aiutare a mettere in dubbio i risultati citologici falsi negativi e indicare la toracoscopia. La pleura mostra più frequentemente un ispessimento nodulare e disomogeneo, preferibilmente dorso-basale e anche nella parte diaframmatica (Fig. 2). Un allargamento superiore a 10 mm, in particolare, è sospetto di malignità fino a prova contraria. In particolare, i versamenti inspiegabili di grande volume e unilaterali dovrebbero suggerire una malignità.
Il primo passo dovrebbe quindi essere una puntura diagnostica dell’effusione. Soprattutto nel caso dell’anamnesi da amianto, tuttavia, si dovrebbero cercare tempestivamente o già in primo luogo procedure alternative per il prelievo di tessuto istologico, al fine di aumentare la resa e la sicurezza degli ispessimenti pleurici sospetti di malignità. In caso di dubbio, tuttavia, è indicata la toracoscopia, durante la quale si può eseguire la pleurodesi, oltre a confermare la diagnosi. Prima di una toracoscopia, il posizionamento dei trocars deve essere assicurato anche ecograficamente.
Capacità di espansione prima della toracentesi
Spesso c’è dispnea con versamenti pleurici di grande volume e rapidamente ricorrenti. Prima che una toracentesi terapeutica abbia senso in questo caso, bisogna prima chiarire, soprattutto in caso di genesi di un versamento maligno, se il versamento e il polmone possono ancora essere sufficientemente mobilizzati. Altrimenti, se il polmone è legato, c’è il rischio di un sieropneumotorace, che si riempirebbe di nuovo di liquido. Questa costellazione si chiama “polmone intrappolato “. Le indicazioni per questo possono già essere la mancanza di inflazione inspiratoria o la ridotta motilità impulsiva-sincrona, che può essere documentata utilizzando l’M-mode. Un’altra opzione, sebbene molto più complessa, è quella di misurare la pressione intrapleurica. Altrimenti, se la puntura non è critica, si formerà uno pneumotorace ex vacuo, che si riempirà rapidamente di nuovo di liquido a causa della mancanza di espansione. Anche in questo caso, la pleurodesi chimica primaria non ha alcuna possibilità di successo, per cui è necessario inserire un catetere pleurico a tunnel o, a seconda delle condizioni generali, tentare la decorticazione chirurgica toracica delle masse tumorali viscerali.
Pneumotorace: la sonografia toracica è un metodo almeno equivalente alla radiografia del torace, soprattutto per l’esclusione del pneumotorace, e fa parte della Linea guida tedesca sul pneumotorace aggiornata nel 2018. La situazione dello studio è chiara, mostra una sensibilità più elevata e una specificità comparabile. Soprattutto in posizione supina, ad esempio con i pazienti in terapia intensiva o dopo interventi come il prelievo di tessuto broncoscopico o il cateterismo venoso centrale (port, CVC), l’ecografia al letto del paziente deve essere utilizzata come metodo di prima scelta per escludere lo pneumotorace. La scelta del trasduttore è di solito secondaria, poiché le caratteristiche elencate di seguito sono riconoscibili con tutte le varianti di trasduttore. Si prevede che i dispositivi tascabili, che possono essere collegati a tablet o telefoni cellulari, renderanno le cose ancora più facili.
Caratteristiche semplici del pneumotorace
Utilizzando una procedura d’esame schematica, devono essere elaborati i seguenti criteri:
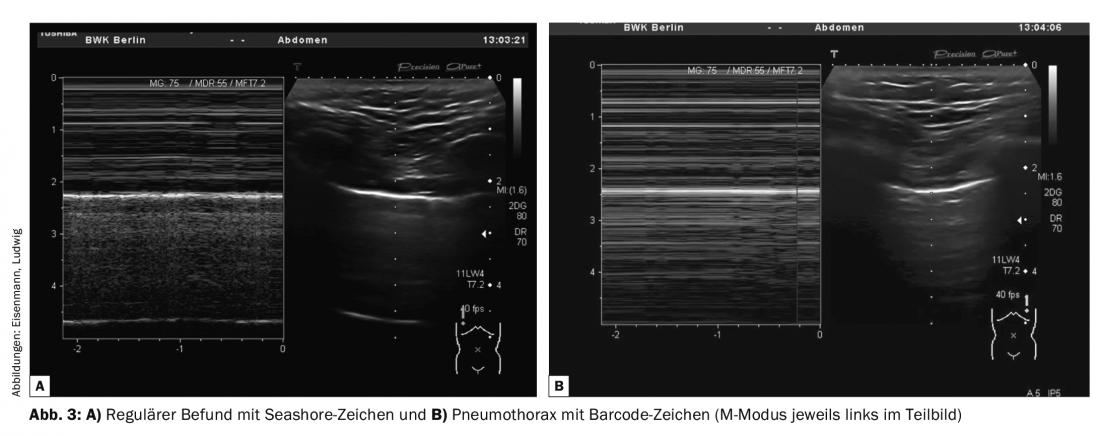
- Scorrimento pleurico – Scorrimento sincrono del respiro dei foglietti pleurici, eventualmente con evidenza di linee B o strutture pleuriche. L’uso additivo della M-mode è possibile con il rilevamento del segno di Seashore in caso di reperti normali o del segno del codice a barre in caso di pneumotorace (Fig. 3).
- Pulsazione polmonare – Pulsazione sincrona della pleura viscerale, rilevabile direttamente o con l’ausilio del Doppler a colori.
- Punto polmonare – punto di transizione sincrono respiratorio tra pneumotorace e pleura viscerale adiacente, visibile solo nel pneumotorace parziale.
La sonda ecografica viene posizionata nel punto più alto del torace (dipende dalla posizione! In posizione supina: ventrale in posizione Monaldi). Se qui è possibile rilevare uno scorrimento pleurico e/o un impulso polmonare attraverso gli spazi intercostali adiacenti, uno pneumotorace è praticamente escluso. Tuttavia, l’assenza di questi criteri non è una prova certa di uno pneumotorace. In particolare, lo scorrimento pleurico può essere gravemente limitato o abolito nei casi di iperinflazione polmonare, bolle di grandi dimensioni, ventilazione invasiva (soprattutto ventilazione a getto) e aderenze pleuriche (dopo un empiema o un precedente intervento chirurgico). In assenza di prove di scivolamento pleurico e di pulsazione polmonare, si cerca un punto polmonare con uno spostamento laterale nel rispettivo spazio intercostale. Se questo è rilevabile, dimostra la presenza di uno pneumotorace.
A causa delle fonti di errore descritte, è utile la presentazione pre-intervento dei risultati iniziali, e si dovrebbe sempre fare un confronto side-by-side. Se i risultati non sono chiari, è necessario eseguire una diagnostica per immagini alternativa.
Tuttavia, non è possibile stimare in modo affidabile le dimensioni del pneumotorace per via ecografica. La decisione sulla terapia deve essere presa nel contesto della condizione clinica e della genesi del pneumotorace. Uno pneumotorace post-intervento, ad esempio, può essere trattato in modo conservativo se viene rilevato un punto polmonare e il paziente è asintomatico, se il controllo clinico ed ecografico può essere reso possibile a breve termine. La posizione del punto polmonare viene segnata sulla pelle a questo scopo e ricontrollata brevemente. In questo modo, è possibile riconoscere la dinamica dello pneumotorace. Il successo del trattamento mediante drenaggio o aspirazione una tantum può essere tracciato anche ecograficamente e non richiede necessariamente una radiografia.
Messaggi da portare a casa
- La sonografia è il metodo di imaging principale per rilevare e quantificare i versamenti pleurici.
- Le caratteristiche sonografiche del versamento, della pleura parietale o del polmone sono utili per la differenziazione eziologica.
- La localizzazione del sito di puntura del versamento pleurico deve essere eseguita ecograficamente per evitare lesioni accidentali alle strutture vascolari e al tessuto polmonare.
- Lo pneumotorace post-intervento deve essere escluso con un’ecografia al letto del paziente. Questo spesso rende superflua una radiografia.
- Per ogni polmonite deve essere eseguita una singola ecografia. I versamenti parapneumonici più grandi devono essere perforati per alleviare la pressione; i versamenti piccoli devono essere controllati ecograficamente.
- Il dolore toracico dopo la puntura pleurica che si pensa di alleviare indica una mancanza di capacità di espansione in assenza di pneumotorace.
- Uno pneumotorace può essere escluso con certezza ecograficamente, ma a volte non è dimostrato. L’estensione dello pneumotorace non può essere valutata con certezza dall’ecografia.
Letteratura:
- Beckh S, Blank W, Kubale R e altri. Standard di esame per la sonografia transtoracica Ultrasuoni in Medicina – European Journal of Ultrasound 2006; 27(03): 287-288.
- Volpicelli G, Elbarbary M, Blaivas M e altri. Raccomandazioni internazionali basate sull’evidenza per l’ecografia polmonare point-of-care. Intensive Care Med 2012; 38: 577-591.
- Società tedesca di pneumologia e medicina respiratoria (DGP), Società tedesca di infettivologia (DGI), (PEG) P-E-GfCeV. Linea guida S3 “Trattamento dei pazienti adulti con polmonite acquisita in comunità e prevenzione – Aggiornamento 2016”. In: (AWMF) AdWMF ed. www.awmf.org/leitlinien/detail/ll/020-020.html; 2016
- Schnell J, Beer M, Eggeling S, et al: Gestione dello pneumotorace spontaneo e dello pneumotorace post-interventistico: linea guida tedesca S3. Zentralblatt fur Chirurgie 2018; 143: S12-s43.
- Joyner Jr. CR, Herman JR, Reid JM: Ultrasuoni riflessi nel rilevamento e nella localizzazione dell’effusione pleurica. JAMA 1967; 200: 399-402.
- Light RW, Macgregor MI, Luchsinger PC, et al.: Versamenti pleurici: la separazione diagnostica tra trasudati ed essudati. Annali di medicina interna 1972; 77: 507-513.
- Tasci S, Ewig S, Lüderitz B: Diagnosi e terapia dei versamenti pleurici parapneumonici e dell’empiema. Dtsch Arztebl 2004; 101: A 638-648.
- Bibby AC, Dorn P, Psallidas I, et al: Dichiarazione ERS/EACTS sulla gestione delle effusioni pleuriche maligne. European Respiratory Journal 2018; 52.
- Feller-Kopman DJ, Reddy CB, DeCamp MM, et al: Gestione delle effusioni pleuriche maligne. Una linea guida ufficiale di pratica clinica ATS/STS/STR. American journal of respirator y and critical care medicine 2018; 198: 839-849.
- Mathis G: Atlante di immagini della sonografia polmonare. 6ª edizione. ed: Springer-Verlag Berlin Heidelberg; 2016.
InFo PNEUMOLOGIA & ALLERGOLOGIA 2019; 1(3): 18-22.