“Più basso è, meglio è”: l’approccio di abbassare il più possibile i livelli di colesterolo nei pazienti a rischio cardiovascolare è più importante che mai, secondo l’aggiornamento delle linee guida svizzere AGLA e le nuove linee guida ESC/ESA. Infatti, una riduzione dell’LDL-C di 1 mmol/l riduce il rischio di eventi cardiovascolari di un quinto. Tuttavia, tali riduzioni di LDL sono difficili in alcuni pazienti. Inoltre, sorgono le domande: quando rivolgersi allo specialista e quando fare un work-up genetico?
“Più basso è, meglio è”: l’approccio di abbassare il più possibile i livelli di colesterolo nei pazienti a rischio cardiovascolare è più importante che mai, secondo l’aggiornamento delle linee guida svizzere AGLA e le nuove linee guida ESC/ESA. Infatti, una riduzione dell’LDL-C di 1 mmol/l riduce il rischio di eventi cardiovascolari di un quinto. Tuttavia, tali riduzioni di LDL sono difficili in alcuni pazienti. Inoltre, sorgono le domande: quando rivolgersi allo specialista e quando fare un work-up genetico?
La dislipidemia è una delle cause principali delle malattie cardiovascolari. L’attenzione è rivolta in particolare al colesterolo LDL (“colesterolo lipoproteico a bassa densità”). Diversi studi condotti negli ultimi decenni dimostrano chiaramente che la riduzione delle concentrazioni di LDL-C è associata a un minor rischio di eventi cardiovascolari [1,2]. Le cause della dislipidemia sono molteplici. Secondo la Fondazione Svizzera per il Cuore, l’ipercolesterolemia familiare (FH) colpisce circa una persona su 200 in questo Paese [3]. Ad esempio, circa il 30% dei pazienti più giovani con malattia coronarica (CHD) o infarto del miocardio presenta la FH [4]. Inoltre, lo stile di vita e le malattie come l’ipotiroidismo, le malattie epatiche, l’obesità, l’insufficienza renale cronica, il diabete mellito non sufficientemente controllato o gli effetti collaterali di alcuni farmaci (ad esempio, gli antivirali) sono noti per avere un’influenza talvolta considerevole sui cambiamenti del metabolismo dei grassi. Questi fattori di rischio fanno sì che oggi circa una persona su tre in Svizzera abbia un profilo lipidico sfavorevole [5].

Sebbene siano passati solo pochi anni dalla pubblicazione delle ultime linee guida della Società Europea di Cardiologia (ESC) e della Società Europea di Aterosclerosi (EAS) sul trattamento della dislipidemia nel 2016, un gran numero di nuove scoperte scientifiche e lo sviluppo di nuove opzioni terapeutiche hanno reso necessario un aggiornamento delle linee guida [6]. Queste nuove “Linee guida ESC/EAS per la gestione delle dislipidemie” presentate nel 2019 sono state riviste e adattate l’anno successivo dal Gruppo di lavoro sui lipidi e l’aterosclerosi (AGLA) in vista della loro applicazione in Svizzera [7,8]. Lo scopo di questa sintesi è di informare i medici di base sulle linee guida aggiornate e di aiutarli a decidere quando indirizzare quali pazienti a uno specialista.
Valutazione del rischio
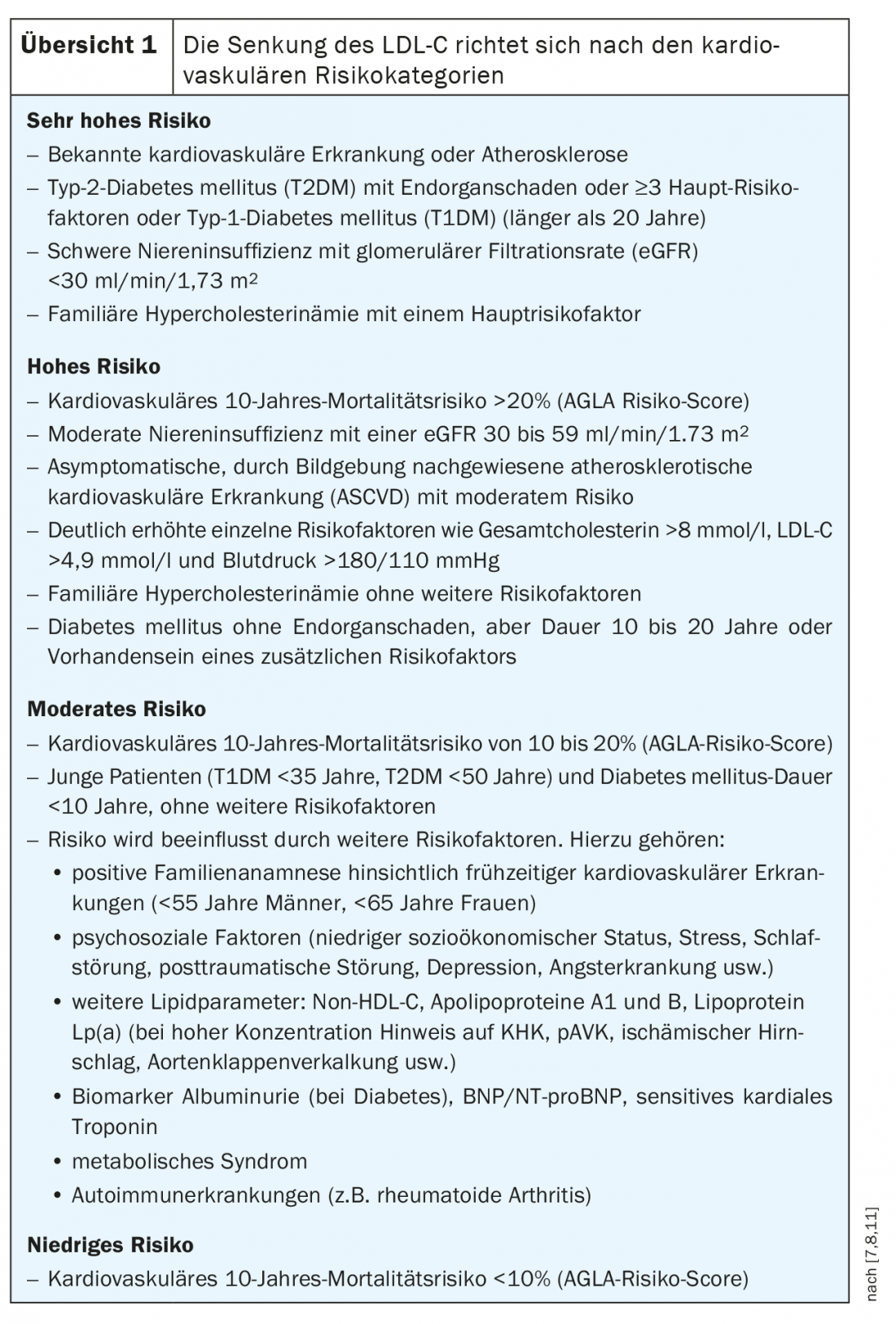
Non c’è dubbio che livelli elevati di colesterolo siano associati a un aumento del rischio cardiovascolare. La valutazione dei fattori di rischio è una componente centrale del calcolo del rischio. Ad esempio, non solo il livello di lipidi è decisivo, ma anche la durata dell’esposizione [6]. Secondo le linee guida ESC/EAS, vengono classificate quattro diverse categorie di rischio, ossia rischio molto alto, alto, moderato e basso (panoramica 1).
In Svizzera, si è affermato il calcolatore di rischio AGLA per calcolare il rischio individuale. Può essere utilizzato online per calcolare facilmente il rischio assoluto nell’arco di dieci anni di un evento coronarico fatale o di un infarto miocardico non fatale (www.agla.ch/de/rechner-und-tools/agla-risikorechner) [8]. Il calcolatore AGLA prende in considerazione parametri come l’età, l’anamnesi familiare, il fumo, la pressione sanguigna, i livelli di colesterolo LDL, colesterolo HDL o trigliceridi. Tuttavia, l’attività fisica, la radioterapia, ecc. non vengono presi in considerazione.
L’ESC/EAS-SCORE può essere utilizzato anche per stimare il rischio decennale di mortalità cardiovascolare (www.scores.bnk.de/esc.html). La Svizzera è considerata una regione a basso rischio cardiovascolare, pertanto viene utilizzata la “variante ESC-SCORE a basso rischio”.
Per la prevenzione primaria, l’AGLA raccomanda una valutazione iniziale del rischio negli uomini asintomatici di età superiore ai 40 anni e nelle donne di età superiore ai 50 anni. Se il rischio è basso, deve essere rivalutato ogni cinque anni, mentre se il rischio è moderato, deve essere rivalutato ogni due-cinque anni. Per le persone che hanno già un rischio elevato o molto elevato al momento della valutazione iniziale, non è necessaria una stima con un calcolatore di rischio, poiché questi pazienti sono automaticamente classificati come ad alto rischio. Questo vale per:
- Malattie cardiovascolari documentate (ad esempio, infarto miocardico o sindrome coronarica acuta, 2 malattie con almeno una sindrome coronarica). stenosi del 50% alla TAC cardiaca, ictus ischemico, malattia arteriosa periferica (PAVD) o storia di rivascolarizzazione coronarica/arteriosa).
- Diabete mellito con danno agli organi terminali, lunga durata della malattia o almeno 3 fattori di rischio
- insufficienza renale da moderata a grave (grado KDIGO ≥3)
- Fattori di rischio individuali pronunciati (LDL-C >4,9 mmol/l, colesterolo totale >8 mmol/l, pressione sanguigna >180/110 mmHg).
- ipercolesterolemia familiare
- Forte aumento delle lipoproteine Lp(a)
Modificatori di rischio
Per i pazienti a rischio basso e soprattutto moderato, sono stati introdotti di recente ulteriori criteri di valutazione del rischio come potenziale strumento complementare. Tali “modificatori del rischio” possono aiutare a regolare la stima del rischio cardiovascolare. I pazienti che si trovano effettivamente in una categoria di rischio inferiore possono essere inseriti in un livello di rischio superiore. Tali modificatori includono:
- Deprivazione sociale, stress psicosociale, esaurimento vitale, grave malattia psichiatrica
- Imaging cardiovascolare non invasivo: misurazione del punteggio del calcio dell’arteria coronaria (CAC) nella TAC cardiaca (punteggio CAC, punteggio Agatston), sonografia dell’arteria femorale e dell’arteria carotidea per il rilevamento della placca (IIbB).
- Anamnesi familiare positiva di malattia cardiovascolare precoce (maschi <55 anni, femmine <60 anni).
- Inattività fisica, obesità (misurata dall’indice di massa corporea o dalla circonferenza addominale).
- Malattia infiammatoria cronica immuno-mediata
- Trattamento per l’infezione da HIV
- Fibrillazione atriale
- Ipertrofia ventricolare sinistra
- Insufficienza renale cronica
- Sindrome da apnea ostruttiva del sonno
- Fegato grasso non alcolico
- Lipoproteina Lp(a)
Valori target di LDL-C
Esiste un’associazione significativa tra la riduzione del colesterolo LDL e la riduzione del rischio cardiovascolare [10]. Per questo motivo, le nuove linee guida ESC (e di conseguenza le attuali linee guida AGLA) sono andate oltre le raccomandazioni delle linee guida passate nel formulare i nuovi obiettivi di abbassamento della LDL-C. In linea di principio, l’LDL-C dovrebbe essere abbassato il più possibile (“più basso è, meglio è”), soprattutto in caso di rischio elevato e molto elevato. Più alto è il rischio cardiovascolare, più bassi sono i valori target (Tab. 1) .
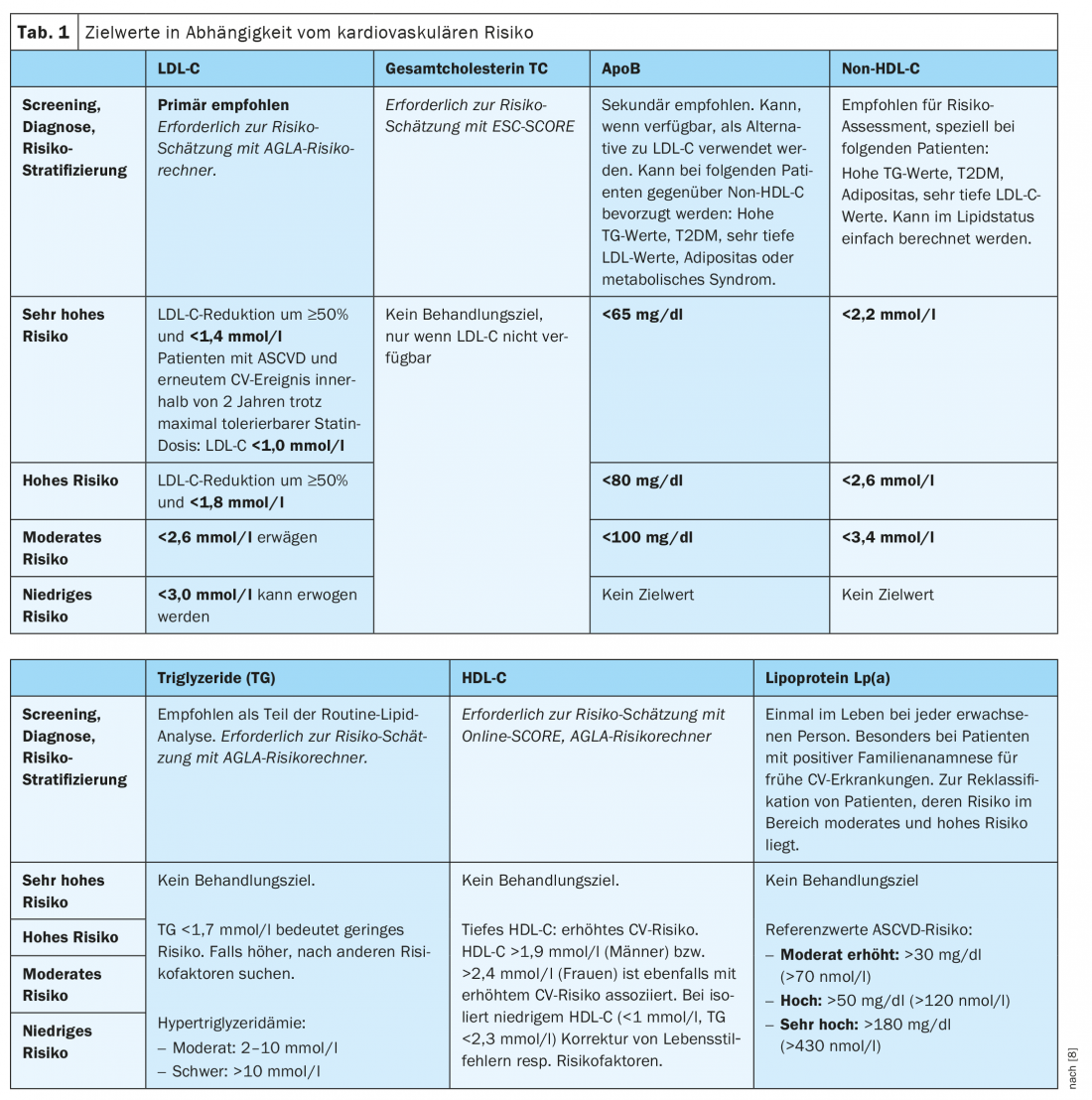
I pazienti a rischio molto elevato devono puntare a una riduzione del 50% dell’LDL-C e a un valore target di LDL-C <1,4 mmol/l. Oltre a una riduzione del 50%, si raccomanda un valore target di <1,8 mmol/l per il rischio elevato e <2,6 mmol/l per il rischio moderato. Infine, si può puntare a un livello a basso rischio di <3,0 mmol/l. I pazienti con FH con ASCVD o un altro fattore di rischio sono considerati a rischio molto elevato (vedere sotto). Secondo l’AGLA, lo stato lipidico del plasma non a digiuno è sufficiente per la valutazione nella maggior parte dei casi. Tuttavia, il prelievo di sangue a digiuno è consigliato nelle seguenti situazioni:
- Sindrome metabolica
- Trigliceridi non a digiuno >5 mmol/l
- Ipertrigliceridemia nota
- Dopo la pancreatite indotta dall’ipertrigliceridemia
- Prima di iniziare la terapia farmacologica con ipertrigliceridemia grave come possibile effetto collaterale
- Se sono necessarie analisi aggiuntive che devono essere determinate a digiuno, per esempio il glucosio a digiuno, il monitoraggio terapeutico dei farmaci
Ipercolesterolemia familiare
Se il profilo lipidico mostra disturbi significativi, potrebbe essere presente anche la FH. Le persone affette da colesterolo LDL geneticamente elevato presentano un rischio cardiovascolare molto più elevato rispetto ai pazienti con LDL acquisito allo stesso livello [8]. Per esempio, nella FH, il rischio a 10 anni di infarto miocardico senza trattamento è superiore al 50%. Le indicazioni della FH per gli adulti sono la CHD negli uomini di età inferiore ai 55 anni o nelle donne di età inferiore ai 60 anni. Inoltre, si raccomanda un chiarimento in caso di livelli elevati di colesterolo, ossia un colesterolo totale ≥8mmol/l o LDL ≥5,0 mmol/l o trigliceridi ≥5,0 mmol/l (bambini/adolescenti corrispondentemente più bassi). L’aterosclerosi precoce o, in chi ha meno di 45 anni, gli xantomi tendinei o l’arco corneale, così come l’iperlipidemia genetica in altri membri della famiglia, potrebbero anche indicare la FH. Se si sospetta la FH, è necessario chiarirla in base ai “Criteri della Rete Clinica Olandese dei Lipidi” (www.agla.ch/de/rechner-und-tools/agla-fh-rechner). Se il sospetto è confermato, deve essere trattato come “ad alto rischio” e con un fattore di rischio aggiuntivo come “ad altissimo rischio”. La FH deve essere diagnosticata clinicamente, se possibile, e confermata geneticamente; è indicato uno screening familiare dei pazienti con FH. Se viene rilevata la mutazione, spesso l’aderenza alla terapia migliora.
Terapia
Il trattamento della dislipidemia dipende dal rischio cardiovascolare complessivo e dai valori target di LDL per i pazienti in base a questo. La base di tale terapia è un cambiamento dello stile di vita, in particolare con l’adeguamento della dieta, la riduzione del consumo di alcol, l’aumento dell’esercizio fisico, la perdita di peso e la cessazione del fumo. Se è necessaria una riduzione dei lipidi oltre al raggiungimento dell’obiettivo terapeutico in base alla categoria di rischio, le statine sono i farmaci di prima scelta. Ciò significa: nella prima fase, le statine altamente efficaci vengono utilizzate nella dose massima tollerabile. Se i valori target sono ancora mancati, si raccomanda la combinazione con l’inibitore dell’assorbimento del colesterolo ezetimibe. In caso di intolleranza alle statine, si deve prendere in considerazione anche ezetimibe. Un inibitore di PCSK9 può essere utilizzato in aggiunta a ezetimibe.
Se i pazienti a rischio molto elevato non raggiungono l’obiettivo terapeutico nonostante la statina a dose massima più ezetimibe, possono essere trattati ulteriormente con un inibitore PCSK9 in prevenzione primaria. Una combinazione con tale anticorpo PCSK9 può essere presa in considerazione anche per i pazienti con un rischio molto elevato nella prevenzione secondaria, ossia quando l’obiettivo terapeutico non viene raggiunto nonostante la statina massima tollerabile più ezetimibe. Per i pazienti con FH a rischio molto elevato e che hanno fallito il trattamento con la statina a più alto dosaggio più ezetimibe, è suggerita anche la combinazione con un inibitore di PCSK9. In futuro, saranno disponibili altre sostanze, come l’acido bempedoico (inibitore dell’ATP citrato liasi, efficace solo nel fegato), Inclisiran (una molecola siRNA che inibisce la PCSK9) o gli anticorpi ANGPTL3 nei pazienti con trigliceridi elevati.
I farmaci più importanti per la riduzione dei lipidi
Con una terapia intensiva con statine, è possibile ridurre le concentrazioni di LDL di oltre il 50%, e con una terapia moderata di oltre il 30-50%. L’intensità di questa riduzione dipende da un lato dalle statine utilizzate (atorvastatina, rosuvastatina e pitavastatina sono considerate statine potenti), dall’altro dal dosaggio e dalla predisposizione genetica del paziente. Ad esempio, un’ampia meta-analisi ha dimostrato che abbassare l’LDL-C di 1 mmol/l riduce il rischio relativo di eventi cardiovascolari del 22% in cinque anni [2]. Le statine riducono anche i trigliceridi del 10-20%, ma aumentano l’HDL solo leggermente (dall’1 al 10%). La concentrazione di Lp(a), invece, non è influenzata o lo è solo in modo molto lieve. Gli effetti collaterali del trattamento con statine possono includere miopatia, miosite e rabdomiolisi. Questi sintomi muscolari di solito iniziano poche settimane dopo l’inizio della terapia. Inoltre, soprattutto nei pazienti anziani, il rischio di sviluppare il diabete mellito di tipo 2 è leggermente aumentato con le statine ad alto dosaggio [11]. Non è ancora stato dimostrato con certezza se il rischio di ictus emorragico aumenti leggermente. Si consiglia cautela nelle interazioni. Alcune statine reagiscono con determinati farmaci, come gli immunosoppressori, gli inibitori della proteasi dell’HIV, i macrolidi, gli antifungini azolici, le benzodiazepine o i calcio antagonisti.
Anche gli inibitori dell’assorbimento del colesterolo sono strumenti importanti per la riduzione del grasso nel sangue. Ezetimibe blocca l’assorbimento del colesterolo nell’intestino, abbassando i livelli di LDL di circa il 18,5%. L’ezetimibe agisce tramite la proteina Niemann-Pick C1-like 1 (NPC1L1), ma non riduce l’assorbimento degli alimenti liposolubili.
Anche i trigliceridi si riducono, in particolare dell’8%, mentre c’è un aumento minimo dell’HDL [12]. È stato dimostrato che la combinazione di ezetimibe con le statine riduce ulteriormente gli eventi cardiovascolari. Gli effetti collaterali più comuni di tale terapia combinata sono mal di testa, dolori muscolari e un aumento delle transaminasi GOT e GPT.
La riduzione della concentrazione di PCSK9 (proproteina convertasi subtilisina/kexina di tipo 9) favorisce l’espressione dei recettori LDL e quindi l’assorbimento delle LDL nelle cellule epatiche. Questo porta a una riduzione significativa dei livelli di LDL-C di circa il 60%, in combinazione con le statine a dosaggio massimo, fino al 73% [6]. Anche la concentrazione di trigliceridi e Lp(a) si riduce di circa un quarto, mentre il livello di HDL aumenta leggermente. Gli inibitori di PCSK9 (evolocumab, alirocumab) mostrano una riduzione significativa del rischio cardiovascolare grazie a questi effetti. Sono indicati in Svizzera per i pazienti a rischio cardiovascolare molto elevato, i cui cambiamenti dietetici e il trattamento con statine LDL alla dose massima tollerata (con o senza ezetimibe) non hanno portato al raggiungimento dei valori target. Inoltre, la pressione arteriosa deve essere controllata e, in caso di diabete mellito, il valore di HbA1c deve essere <8% e si deve ricercare l’astinenza da nicotina. È obbligatorio ottenere una consulenza sui costi da parte dell’assicurazione sanitaria.
Per la prevenzione secondaria, sono eleggibili al trattamento con gli inibitori di PCSK9: i pazienti ad alto rischio con eventi cardiovascolari ischemici aterosclerotici e un LDL-C di >2,6 mmol/l, gli adulti con FH eterozigote e – per evolocumab – gli adulti e gli adolescenti di età pari o superiore a 12 anni con FH omozigote. Nella prevenzione primaria, gli inibitori della PCSK9 sono indicati nei pazienti adulti e adolescenti ad alto rischio di età pari o superiore a 12 anni con FH eterozigote o omozigote grave e un LDL-C di >5,0 mmol/l. Esiste anche un’indicazione per i pazienti con FH eterozigote grave, un LDL-C di >4,5 mmol/l e almeno uno dei seguenti fattori di rischio: diabete mellito, Lp(a) >120 nmol/l o ipertensione grave.
La diagnosi e la prescrizione iniziale, così come i controlli regolari, devono essere effettuati da uno specialista FMH in angiologia, diabetologia/endocrinologia, cardiologia, nefrologia, neurologia o da esperti in ipercolesterolemia designati. Il trattamento con gli inibitori della PCSK9 deve essere continuato solo se ha successo. Ciò significa che, a un controllo entro sei mesi dall’inizio del trattamento, l’LDL-C deve essere stato ridotto di almeno il 40% rispetto al valore basale con la terapia lipidica massimamente intensificata o deve essere stato raggiunto un valore LDL <1,8 mmol/l. Questo non si applica alle persone con FH omozigote.
Messaggi da portare a casa
- L’LDL-C è una delle cause principali dello sviluppo delle malattie cardiovascolari.
- Nei pazienti a rischio cardiovascolare molto elevato, la terapia intensiva deve mirare a una riduzione del 50% dell’LDL-C e a un valore target di LDL-C <1,4 mmol/l; nei pazienti ad alto rischio, si deve puntare a una riduzione del 50% e a un valore target di <1,8 mmol/l. Va notato che anche la durata dell’esposizione all’ipercolesterolemia è fondamentale.
- Se i livelli target non vengono raggiunti con le statine e l’ezetimibe alla dose massima tollerabile per almeno tre mesi, gli inibitori di PCSK9 devono essere utilizzati nei pazienti a rischio cardiovascolare molto elevato.
- I pazienti con ipercolesterolemia familiare e almeno un fattore di rischio cardiovascolare sono considerati ad alto rischio. Devono anche essere trattati in modo intensivo (statine, ezetimibe e inibitori PCSK9) con un LDL-C >5,0 mmol/l o >4,5 mmol/l più altri fattori di rischio.
- Il rinvio a uno specialista deve avvenire se la terapia intensiva con LDL fallisce, per i pazienti a rischio elevato o molto elevato, o per i pazienti con ipercolesterolemia familiare, o se sono presenti alcuni fattori di rischio cardiovascolare.
- In caso di ipercolesterolemia familiare, lo screening familiare è obbligatorio e si raccomanda un chiarimento genetico.

Letteratura:
- Carballo D, Mach F: Riduzione intensiva del colesterolo LDL e inibizione dell’infiammazione per ridurre ulteriormente il rischio cardiovascolare. Medicina cardiovascolare 2018; 21(12): 310-315.
- Baigent C, et al.: Cholesterol Treatment Trialists Collaboration: Efficacia e sicurezza dell’abbassamento più intensivo del colesterolo LDL: una metanalisi dei dati di 170.000 partecipanti a 26 studi randomizzati. Lancet 2010; 376: 1670-1681.
- www.swissheart.ch/de/herzkrankheiten-hirnschlag/erkrankungen/familiaere-hypercholesterinaemie.html.
- Rodondi N: I pazienti dovrebbero essere sottoposti a screening per l’ipercolesterolemia familiare nello studio medico? Switzerland Med Forum 2014; 14(19): 377.
- www.swissheart.ch.
- Riesen WF et al: Nuove linee guida ESC/EAS sulla dislipidemia. Swiss Medical Forum 2020; 20(9-10): 140-148.
- Mach F, et al: Linee guida ESC/EAS 2019 per la gestione delle dislipidemie: modifica dei lipidi per ridurre il rischio cardiovascolare. European Heart Journal 2019; doi: 10.1093/eurheartj/ehz455.
- AGLA: Prevenzione dell’Aterosclerosi Focus sulla Dislipidemia 2020; www.agla.ch.
- Weingärtner O, et al: Commento alle linee guida ESC/EAS (2019) sulla diagnosi e il trattamento delle dislipidemie. Cardiologo 2020; 14: 256-266.
- McCormack T, et al: Livelli di LDL-C molto bassi possono fornire in modo sicuro un ulteriore beneficio clinico cardiovascolare: le prove ad oggi. Int J Clin Pract 2016; 70(11): 886-897; doi: 10.1111/ijcp.12881.
- Sattar N, et al: Statine e rischio di diabete incidente: una meta-analisi collaborativa di studi randomizzati sulle statine. 2010 Feb 27; 375(9716): 735-742.
- Pandor A, et al: monoterapia con ezetimibe per la riduzione del colesterolo in 2.722 persone: revisione sistematica e meta-analisi di studi controllati randomizzati. J Intern Med 2009; 265(5): 568-580; doi: 10.1111/j.1365-2796.2008.02062.x.
PRATICA GP 2021; 16(10): 9-13