La terapia per il carcinoma polmonare non a piccole cellule è individualizzata e si basa sullo stadio del tumore, sull’istologia e sui marcatori molecolari predittivi, tenendo conto del profilo del paziente. Al fine di massimizzare il risultato terapeutico per ogni singolo paziente, è essenziale il coordinamento delle diverse modalità terapeutiche da parte di una commissione tumori. Questo vale per le situazioni curative ma anche per quelle palliative.
La diagnosi, la stadiazione e il trattamento del carcinoma polmonare non a piccole cellule (NSCLC) richiedono la collaborazione tra diverse discipline. Le diverse modalità terapeutiche devono essere combinate per un regime terapeutico individuale. Il tumor board è la piattaforma di coordinamento centrale per questo. Sarebbe auspicabile che tutti i pazienti venissero presentati e discussi in un comitato tumori prima di iniziare una terapia curativa o palliativa, al fine di determinare un concetto terapeutico individualizzato e quindi ottimale, coordinando le varie modalità terapeutiche. A tal fine, devono essere inclusi i fattori stadio, istologia, analisi molecolari, comorbidità, qualità di vita e desideri ed esigenze personali del paziente. Pneumologi, chirurghi toracici, oncologi medici, radioterapisti, patologi, radiologi e specialisti di medicina nucleare elaborano una decisione comune che definisce la terapia. Questa stretta collaborazione è importante anche nel corso della malattia, per poter offrire nuovamente la migliore terapia individuale in una nuova situazione di malattia, come una ricaduta.
La discussione della scheda tumorale nel caso di una nuova diagnosi di carcinoma bronchiale non a piccole cellule può essere descritta come segue: I tumori confinati al polmone vengono resecati principalmente. In caso di coinvolgimento dei linfonodi mediastinici e/o di infiltrazione nell’area circostante, deve essere sempre discussa una terapia neo- o adiuvante. Negli stadi avanzati locali, i pazienti vengono trattati con approcci multimodali, ossia chemioterapia combinata seguita da chirurgia o chemioterapia e radioterapia. Per il tumore polmonare metastatico, la terapia viene determinata in base all’istologia e alle caratteristiche molecolari.
Stadiazione mediante PET-CT
Valutazione dei linfonodi mediastinici: Nelle fasi iniziali del tumore, si dovrebbe richiedere una stadiazione linfonodale nel mediastino con elevata sensibilità e specificità, poiché il suo risultato ha un’alta rilevanza per l’ulteriore procedura. L’importanza clinica della PET-CT per la stadiazione linfonodale risiede nel suo elevato valore predittivo negativo. Se la PET-CT è negativa, si può rinunciare a ulteriori diagnosi linfonodali invasive.
Al contrario, il valore predittivo positivo è più basso. I linfonodi mediastinici positivi alla PET devono quindi essere valutati ulteriormente. Oggi si utilizzano soprattutto tecniche meno invasive, attraverso punture broncoscopiche (sonografia endobronchiale [EBUS], endosonografia [EUS]) o, se necessario, mediastinoscopia.
Manifestazioni extratoraciche: Un altro punto di forza della PET-CT è la possibilità di rilevare le metastasi extratoraciche. Per un’adeguata stadiazione del sistema nervoso centrale, è necessario eseguire una risonanza magnetica del cranio nei casi di sospetto clinico o di metastasi linfonodali mediastiniche accertate [1].
Terapia delle fasi iniziali
Il carcinoma polmonare non a piccole cellule senza metastasi extratoraciche può essere trattato mediante resezione chirurgica con intento curativo. La sopravvivenza mediana dopo l’intervento chirurgico è di 46 mesi – senza terapia solo 14 mesi – ma dipende in modo significativo dalle dimensioni iniziali del tumore e dal coinvolgimento dei linfonodi. Il criterio più importante per un buon risultato del trattamento è l’esperienza del team curante. È stato anche dimostrato che i centri con molti interventi (>150 all’anno) possono ottenere una migliore sopravvivenza globale rispetto a quelli con meno casi (<70 all’anno) [2].
Negli stadi I e II, si punta alla lobectomia, compresa la linfoadenectomia mediastinica. La mortalità a 30 giorni dopo la lobectomia è bassa (1%) e non aumenta nemmeno nei pazienti anziani con comorbilità, se selezionati con cura. L’operazione può essere eseguita in modo minimamente invasivo mediante toracoscopia.
Oggi le pneumonectomie sono necessarie solo in casi eccezionali, ma possono avere un ruolo in un concetto curativo globale [3]. Si possono prevenire resecando selettivamente i bronchi o le arterie interessate come un bracciale e rianastomizzando il tessuto polmonare rimanente (resezione del bracciale, “sleeve resection”). Tali resezioni sono sempre più frequenti. Esempio: nel caso di un carcinoma del lobo superiore centrale, i restanti lobi medio e inferiore vengono rianastomizzati al bronco principale dopo la resezione.
Altri interventi di salvataggio del tessuto polmonare, come la segmentectomia, sono raccomandati solo per tumori piccoli e periferici (<2 cm) senza metastasi linfonodali (N0) [4].
La lobectomia minimamente invasiva (toracoscopica) è considerata una tecnica chirurgica per il carcinoma bronchiale localizzato e viene utilizzata nei centri specializzati negli stadi più precoci. I pazienti dopo la lobectomia toracoscopica hanno una sopravvivenza a 5 anni paragonabile (o in alcuni studi addirittura migliore) a quella della lobectomia aperta [5]. Inoltre, la chemioterapia adiuvante è tollerata prima e meglio.
Nei pazienti con tumori piccoli e comorbidità significative, si dovrebbe prendere in considerazione la radioterapia intenzionale curativa, con una diagnosi di dignità fatta in anticipo, quando possibile. La raccolta dei tessuti è particolarmente importante per poter offrire in seguito una terapia ottimale sulla base delle caratteristiche molecolari del tumore. In questo caso, vengono utilizzate la radioterapia stereotassica (SBRT) e la tecnologia di alta precisione (ad esempio, Gamma Knife®, LINAC), che consente un buon controllo locale del tumore con una tossicità limitata delle radiazioni [6].
Terapia degli stadi localmente avanzati con intenzione curativa
Nei pazienti con tumori in stadio IIIA (N2), definiti dalla presenza di metastasi linfonodali mediastiniche omolaterali, si può sviluppare un concetto curativo multimodale se il paziente è in buone condizioni generali.
La chemioterapia neoadiuvante può essere raccomandata nel senso della chemioterapia di induzione, se la situazione è valutata come potenzialmente operabile. Poiché la chemioterapia è una parte importante del concetto terapeutico in questa situazione, la somministrazione neoadiuvante assicura che la terapia sistemica possa essere somministrata senza riduzione della dose e con una buona tollerabilità [7, 8].
La radio-chemioterapia definitiva può essere raccomandata per i pazienti con tumori primari non operabili, mentre la radio/chemioterapia concomitante è raccomandata per i pazienti in buone condizioni generali [9].
Attualmente, uno studio in Svizzera sta verificando se l’aggiunta della radioterapia preoperatoria in combinazione con cetuximab alla chemioterapia sia vantaggiosa in situazioni molto avanzate, non metastatiche (IIIB) (SAKK 16/08).
Terapia adiuvante dopo l’intervento chirurgico
Nei pazienti dopo la resezione completa del carcinoma polmonare non a piccole cellule in stadio II e III, quattro cicli di chemioterapia combinata adiuvante contenente cisplatino sono oggi considerati una terapia standard. Sulla base di analisi retrospettive (CALGB 9633), la terapia adiuvante può essere raccomandata anche nello stadio IB e con dimensioni del tumore superiori a 4 cm.
Nei pazienti dopo la resezione completa del tumore nello stadio IB-IIB, tre grandi studi randomizzati mostrano ora un significativo prolungamento della sopravvivenza con la chemioterapia combinata adiuvante a base di platino [10–12].
La radioterapia post-operatoria (PORT) rimane controversa. Anche in questo caso, sono in corso studi per descrivere meglio il significato. Per esempio, lo studio LungART sta testando il PORT per i pazienti con coinvolgimento N2 dopo una resezione completa (abstract 7658, ASCO 2007).
Tuttavia, solo alcune delle persone trattate traggono beneficio dal trattamento adiuvante. Ciò solleva la questione delle caratteristiche biologiche che potrebbero consentire l’identificazione di tali pazienti in anticipo. La misura in cui le firme di espressione genica possono essere utilizzate per identificare sottogruppi con prognosi diverse e se questo può essere usato per concentrare le terapie adiuvanti sui pazienti con una prognosi sfavorevole è attualmente oggetto di studio (CALGB-30506). In alternativa, si sta cercando di utilizzare gli studi farmacogenomici per prevedere se il tumore può essere influenzato da determinati agenti chemioterapici. Tuttavia, non sono ancora stati caratterizzati dei marcatori predittivi.
Terapia palliativa basata sull’istologia e la biologia molecolare
Le strategie terapeutiche nella terapia palliativa sono cambiate negli ultimi anni. Le nuove strategie si basano sulla rilevanza “riscoperta” della morfologia differenziata e sulle nuove scoperte molecolari. Il termine generico “carcinoma bronchiale non a piccole cellule” non è più sufficiente per la decisione sul trattamento. Il termine “non a piccole cellule” riassume entità estremamente eterogenee dal punto di vista istologico e molecolare. Non risponde più alle esigenze della moderna selezione dei farmaci, che è personalizzata in base alla morfologia e alla biologia molecolare.
La terapia mirata in base all’istologia esatta e, nel caso degli adenocarcinomi, allo stato di mutazione del “recettore del fattore di crescita epidermico” (EGFR) e allo stato di traslocazione ALK (chinasi del linfoma anaplastico) (EML4-ALK positivo) si è affermata nella pratica oncologica quotidiana. Gli inibitori della tirosin-chinasi (TKI) possono essere utilizzati in questo caso con beneficio terapeutico.
Cruciale: lo stato di mutazione delle cellule tumorali
Oggi, i carcinomi del bronco non a piccole cellule dovrebbero essere testati per verificare il loro stato di mutazione prima di iniziare la terapia palliativa. Tutti i carcinomi polmonari non a cellule squamose devono essere suddivisi in base alla presenza di mutazioni EGFR. Le mutazioni possono portare all’attivazione della tirosin-chinasi intracellulare dell’EGFR, dando alle cellule tumorali un segnale di crescita permanente. Questa è chiamata mutazione attivante. Queste mutazioni sono più frequenti nei non fumatori [13]. Le mutazioni EGFR più rilevanti sono una delezione nell’esone 19 e la mutazione puntiforme L858R (esone 21) e G719X (esone 18). Tuttavia, ci sono anche mutazioni come T790M (esone 20) che conferiscono resistenza alla terapia con TKI. I farmaci che possono essere utilizzati sono gefitinib ed erlotinib, che inibiscono la tirosin-chinasi dell’EGFR [14]. Afatinib è già approvato come trattamento di seconda linea negli Stati Uniti e nell’Unione Europea. Afatinib blocca il “Recettore del fattore di crescita epidermico umano 2” (HER2/ErbB2) ed ErbB4, oltre al “Recettore del fattore di crescita epidermico” (EGFR/ErbB1). Nei pazienti con mutazione EGFR attivante nota, l’inibitore della tirosin-chinasi deve essere utilizzato in prima linea.
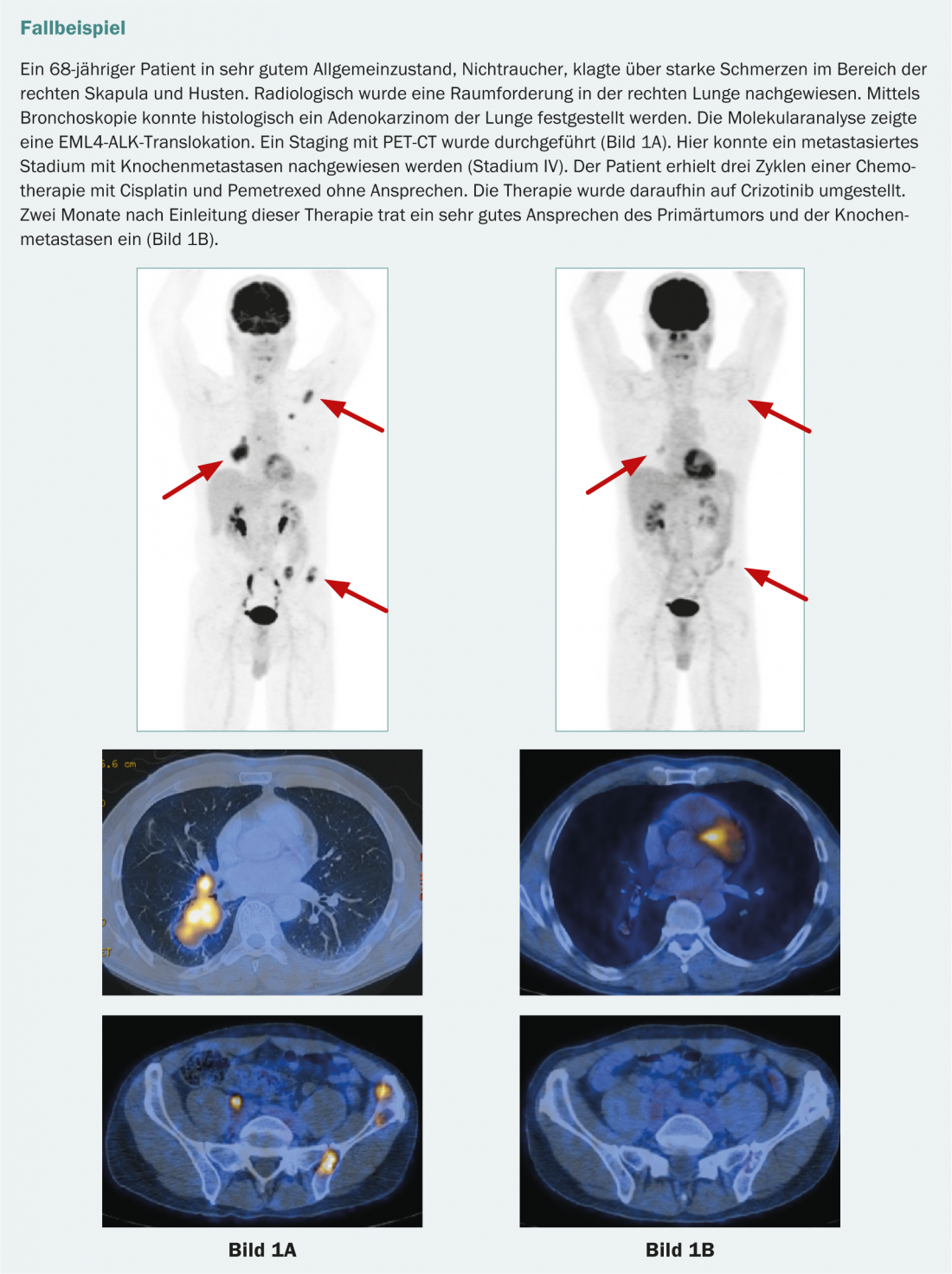
Nell’adenocarcinoma del polmone, può essere presente anche una proteina di fusione patologica costituita dalla “chinasi del linfoma anaplastico” (ALK) e dalla “proteina associata al microtubulo echinoderma simile a 4” (EML4). Questo porta anche a un segnale di crescita incontrollata nelle cellule tumorali. Questa mutazione si verifica molto meno frequentemente (circa il 4-7%). Colpisce soprattutto i non fumatori e quasi mai si presenta in combinazione con altre mutazioni [15]. I pazienti positivi all’EML4-ALK beneficiano del trattamento con crizotinib. Attualmente, crizotinib è approvato in Svizzera come terapia di seconda linea per i pazienti con traslocazione ALK.
Altre mutazioni rare per le quali esistono potenziali inibitori della tirosin-chinasi riguardano il recettore EGF-2 (HER2) e BRAF. Quasi esclusivamente negli adenocarcinomi dei fumatori, si osservano anche mutazioni dell’oncogene KRAS (trasversione da G a T). La presenza di una mutazione KRAS è correlata a una prognosi complessivamente peggiore. Al momento, tuttavia, non si può trarre alcuna conseguenza terapeutica da questa mutazione [16].
L’istologia indica la strada per la chemioterapia
La classificazione istologica dell’adenocarcinoma del polmone è stata rinnovata e quindi è stato sostituito anche il termine poco chiaro di “carcinoma bronchio-alveolare (BAC)”. Le piccole lesioni pre-invasive sono oggi definite “adenocarcinoma in situ”. Le lesioni invasive >5 cm sono chiamate “carcinoma lepidico”. I carcinomi tra i 3 e i 5 cm sono definiti “minimamente invasivi” [17].
Inoltre, la chemioterapia combinata contenente platino – con sostanze come vinorelbina, gemcitabina, pemetrexed e paclitaxel – è considerata la terapia standard o di prima linea per il carcinoma del bronco avanzato [18].
Nonostante i grandi sforzi, non è stato ancora possibile definire dei marcatori predittivi affidabili per gli agenti chemioterapici 19, 20].
Il pemetrexed è approvato per il trattamento del carcinoma a cellule non squamose. Il pemetrexed è un nuovo membro della famiglia degli antagonisti dell’acido folico. Nel 2008, uno studio randomizzato ha dimostrato che i pazienti con istologia epiteliale non a placche traevano maggiori benefici dalla terapia combinata con pemetrexed e cisplatino rispetto alla combinazione gemcitabina/cisplatino. Il profilo degli effetti collaterali della nuova combinazione si è dimostrato superiore anche in termini di tossicità ematologica e neutropenia febbrile [21].
Bevacizumab è un anticorpo monoclonale contro il fattore di crescita endoteliale vascolare (VEGF). Bevacizumab in combinazione con la chemioterapia è approvato in Svizzera per il trattamento del carcinoma polmonare non a piccole cellule con istologia non squamosa. Questo si è basato su due studi randomizzati: da un lato, l’aggiunta di bevacizumab alla combinazione carboplatino/paclitaxel ha migliorato la risposta tumorale e prolungato la sopravvivenza mediana di 12,3 mesi, cioè più della sola chemioterapia (10,3 mesi) [22]. D’altra parte, bevacizumab in combinazione con cisplatino/gemcitabina ha ottenuto una risposta tumorale significativamente più elevata [23]. Tuttavia, questo non ha portato a un prolungamento della sopravvivenza globale [24].
Terapia di mantenimento
Il trattamento del carcinoma bronchiale non a piccole cellule in fase avanzata è stato solitamente effettuato con quattro (fino a un massimo di sei) cicli di chemioterapia contenenti platino. I risultati di nuovi studi randomizzati hanno dimostrato per la prima volta che, in determinate situazioni, il proseguimento del trattamento con una terapia di mantenimento a valle può prolungare la sopravvivenza. Si distingue tra due forme di terapia di mantenimento (Tabella 1) . Per la “continuazione di mantenimento”, sono disponibili dati per gemcitabina [25] e pemetrexed più bevacizumab [26], che sono stati in grado di mostrare un vantaggio in termini di sopravvivenza libera da progressione. Il mantenimento dello switch è risultato positivo per pemetrexed [27], docetaxel [28], erlotinib [25] e gefitinib [29].

Chirurgia delle metastasi
Nel carcinoma polmonare non a piccole cellule metastatico, cioè nello stadio IV, l’intervento chirurgico ha solo un ruolo limitato ed è sempre una decisione da prendere caso per caso. Nel caso di una singola metastasi cerebrale di un carcinoma del bronco operabile, nei casi adatti si esegue una resezione neurochirurgica. Seguono la radioterapia del cervello intero e la resezione chirurgica del tumore primario, se non ci sono altre metastasi altrove. Con la resezione radicale, questa procedura raggiunge un tasso di sopravvivenza a 5 anni di circa il 40%.
In situazioni particolari con metastasi d’organo isolate, in particolare metastasi surrenali, è stata valutata anche la resezione chirurgica con intento curativo [30]. Questi interventi sono di solito combinati con una terapia sistemica adiuvante o neo-adiuvante.
CONCLUSIONE PER LA PRATICA
- La stadiazione accurata, la diagnosi istologica e l’analisi molecolare sono la chiave per una terapia personalizzata e quindi per ottimizzare i risultati terapeutici.
- Il termine “carcinoma polmonare non a piccole cellule” comprende morfologicamente e molecolarmente molte entità diverse, che dovrebbero essere accuratamente descritte in una diagnosi.
- Oggi è possibile una terapia di prima linea personalizzata e palliativa in base a un’esatta differenziazione istologica e allo stato di mutazione. Dopo il completamento di quattro cicli di terapia di prima linea contenente platino, la terapia di mantenimento migliora la sopravvivenza libera da progressione e può determinare un miglioramento della sopravvivenza globale. I pazienti con una malattia stabilizzata e una buona condizione generale sembrano trarre i maggiori benefici.
- Per il carcinoma bronchiale localizzato, oggi si preferiscono le lobectomie minimamente invasive (toracoscopiche). Per i tumori in posizione centrale, si sceglie sempre più spesso la resezione cuffia/manicotto con conservazione del tessuto polmonare.
- La chemioterapia combinata adiuvante contenente cisplatino è oggi una parte fissa della terapia dopo la resezione del tumore negli stadi IB (>4 cm), II e IIIA.
PD Ulf Petrausch, MD
Alessandra Curioni-Fontecedro, MD
Letteratura:
- Silvestri GA, et al: Metodi di stadiazione del carcinoma polmonare non a piccole cellule: Diagnosi e gestione del carcinoma polmonare, 3a ed.: Linee guida di pratica clinica basate sull’evidenza dell’American College of Chest Physicians. Chest 2013; 143(5 Suppl): e211S-50S.
- Luchtenborg M, et al: Un elevato volume di procedure è fortemente associato a una migliore sopravvivenza dopo la chirurgia del cancro al polmone. J Clin Oncol 2013; 31(25): 3141-3146.
- Riquet M, et al: Una revisione di 250 sopravvissuti a dieci anni dopo la pneumonectomia per il cancro al polmone non a piccole cellule. European journal of cardio-thoracic surgery: rivista ufficiale dell’Associazione Europea di Chirurgia Cardio-Toracica 2013.
- Yendamuri S, et al: Tendenze temporali negli esiti a seguito di resezioni sublobari e lobari per tumori polmonari non a piccole cellule (≤2 cm) – un’analisi del database Surveillance Epidemiology End Results. Il Journal of surgical research 2013; 183(1): 27-32.
- Lee PC, et al: Sopravvivenza a lungo termine dopo la lobectomia per il carcinoma polmonare non a piccole cellule mediante chirurgia toracica video-assistita rispetto alla toracotomia. Annali di chirurgia toracica 2013; 96(3): 951-960; discussione 960-961.
- Powell JW, et al: I progressi del trattamento per il carcinoma polmonare non a piccole cellule medicalmente inoperabile: enfasi sugli studi prospettici. The Lancet Oncology 2009; 10(9): 885-894.
- Scagliotti GV, et al: Studio randomizzato di fase III sulla chirurgia da sola o sulla chirurgia più cisplatino preoperatorio e gemcitabina negli stadi IB-IIIA del carcinoma polmonare non a piccole cellule. J Clin Oncol 2012; 30(2): 172-178.
- Strauss GM: Chemioterapia di induzione e chirurgia per il carcinoma polmonare non a piccole cellule in fase iniziale: cosa abbiamo imparato dagli studi randomizzati? J Clin Oncol 2012; 30(2): 128-131.
- Auperin A, et al.: Meta-analisi della radiochemioterapia concomitante rispetto a quella sequenziale nel carcinoma polmonare non a piccole cellule localmente avanzato. J Clin Oncol 2010; 28(13): 2181-2190.
- 10 Winton TL, et al: Uno studio prospettico randomizzato di vinorelbina (VIN) e cisplatino (CIS) adiuvanti nel carcinoma polmonare non a piccole cellule (NSCLC) di stadio 1B e II completamente resecato Intergroup JBR.10. J Clin Oncol 2004; 22(14): 621s-621s.
- 11 Le Chevalier T, et al: Chemioterapia adiuvante a base di cisplatino nei pazienti con carcinoma polmonare non a piccole cellule completamente resecato. NEJM 2004; 350(4): 351-360.
- Pignon JP, et al: Valutazione del cisplatino adiuvante per il polmone: un’analisi congiunta del Gruppo Collaborativo LACE. J Clin Oncol 2008; 26(21): 3552-3559.
- Rosell R, et al: Screening delle mutazioni del recettore del fattore di crescita epidermico nel cancro al polmone. The New England journal of medicine 2009; 361(10): 958-967.
- Rosell R, Bivona TG, Karachaliou N: Genetica e biomarcatori nella personalizzazione del trattamento del cancro al polmone. Lancet 2013; 382(9893): 720-731.
- Shaw AT, et al: Caratteristiche cliniche ed esito dei pazienti con carcinoma polmonare non a piccole cellule che ospitano EML4-ALK. J Clin Oncol 2009; 27(26): 4247-4253.
- Roberts PJ, Stinchcombe TE: Mutazione KRAS: dovremmo fare il test e ha importanza? J Clin Oncol 2013; 31(8): 1112-1121.
- Travis WD, Brambilla E, Riely GJ: Nuova classificazione patologica del cancro al polmone: rilevanza per la pratica clinica e gli studi clinici. J Clin Oncol 2013; 31(8): 992-1001.
- Schiller JH, et al: Confronto tra quattro regimi di chemioterapia per il carcinoma polmonare non a piccole cellule in fase avanzata. NEJM 2002; 346(2): 92-98.
- Cobo M, et al: Personalizzazione del cisplatino in base all’espressione dell’mRNA della riparazione per escissione quantitativa cross-complementare 1: uno studio di fase III nel carcinoma polmonare non a piccole cellule. J Clin Oncol 2007; 25(19): 2747-2754.
- Bepler G, et al: Studio internazionale randomizzato di fase III sulla chemioterapia basata sull’espressione di ERCC1 e RRM1 rispetto a gemcitabina/carboplatino nel carcinoma polmonare non a piccole cellule avanzato. J Clin Oncol 2013; 31(19): 2404-2412.
- Scagliotti GV, et al.: Studio di fase III di confronto tra cisplatino più gemcitabina e cisplatino più pemetrexed in pazienti naïve alla chemioterapia con carcinoma polmonare non a piccole cellule in stadio avanzato. J Clin Oncol 2008; 26(21): 3543-3551.
- Sandler A, et al: Paclitaxel-carboplatino da solo o con bevacizumab per il carcinoma polmonare non a piccole cellule. NEJM 2006; 355(24): 2542-2550.
- Reck M, et al.: Studio di fase III di cisplatino più gemcitabina con placebo o bevacizumab come terapia di prima linea per il carcinoma polmonare non squamoso non a piccole cellule: AVAil. J Clin Oncol 2009; 27(8): 1227-1234.
- Reck M, et al.: Sopravvivenza globale con cisplatino-gemcitabina e bevacizumab o placebo come terapia di prima linea per il carcinoma polmonare non squamoso non a piccole cellule: risultati di uno studio randomizzato di fase III (AVAiL). Annali di oncologia: rivista ufficiale della Società Europea di Oncologia Medica/ESMO 2010; 21(9): 1804-1809.
- Perol M, et al: Studio randomizzato di fase III sulla terapia di mantenimento con gemcitabina o erlotinib rispetto all’osservazione, con trattamento di seconda linea predefinito, dopo la chemioterapia di induzione con cisplatino-gemcitabina nel carcinoma polmonare non a piccole cellule avanzato. J Clin Oncol 2012; 30(28): 3516-3524.
- Barlesi F, et al.: Studio randomizzato di fase III sul mantenimento di bevacizumab con o senza pemetrexed dopo l’induzione di prima linea con bevacizumab, cisplatino e pemetrexed nel carcinoma polmonare non a piccole cellule avanzato non squamoso: AVAPERL (MO22089). J Clin Oncol 2013; 31(24): 3004-3011.
- Belani CP, et al: Qualità della vita nei pazienti con carcinoma polmonare non a piccole cellule in fase avanzata sottoposti a trattamento di mantenimento con pemetrexed rispetto al placebo (H3E-MC-JMEN): risultati di uno studio randomizzato, in doppio cieco, di fase 3. Lancet Oncology 2012; 13(3): 292-299.
- Fidias PM, et al: Studio di fase III di Docetaxel immediato rispetto a quello ritardato dopo la terapia di prima linea con Gemcitabina più Carboplatino nel carcinoma polmonare non a piccole cellule avanzato. J Clin Oncol 2009; 27(4): 591-598.
- Zhang L, et al: Gefitinib versus placebo come terapia di mantenimento nei pazienti con carcinoma polmonare non a piccole cellule localmente avanzato o metastatico (INFORM; C-TONG 0804): uno studio di fase 3 randomizzato, multicentrico, in doppio cieco. Lancet Oncology 2012; 13(5): 466-475.
- Salah S, Tanvetyanon T, Abbasi S: Metastatectomia per metastasi solitarie extracraniche extra-adrenali da carcinoma polmonare non a piccole cellule: revisione sistematica e analisi dei casi riportati. Cancro del polmone-J Iaslc 2012; 75(1): 9-14.
InFo Oncologia & Ematologia 2013; 1(1): 16-21