Le terapie immunomodulanti e immunosoppressive nei pazienti oncologici possono favorire la progressione o la recidiva della malattia maligna. Tuttavia, le varie sostanze differiscono per quanto riguarda questo rischio. Oltre all’accurata selezione del principio attivo, uno screening tumorale coerente è di grande importanza anche per la prevenzione di recidive e nuove malattie maligne.
L’aumento dell’età della popolazione e i lusinghieri progressi nella terapia oncologica fanno sì che i reumatologi si trovino sempre più spesso di fronte a pazienti che hanno una precedente malattia maligna, ma che necessitano comunque di una terapia di base basata su linee guida. Le terapie di base sono spesso immunosoppressive e uno dei compiti principali del sistema immunitario è quello di riconoscere ed eliminare le cellule maligne. Di conseguenza, medici e pazienti sono preoccupati che la terapia di base aumenti il rischio di recidiva del tumore. Soprattutto nel caso degli inibitori del fattore di necrosi tumorale, questa preoccupazione è alimentata da una denominazione infelice.
Aumento dell’abbondanza di dati, interpretazione difficile
Per essere in grado di prendere tali decisioni terapeutiche, di solito non è di grande aiuto affrontare l’impressionante ed entusiasmante ricchezza di dati sugli esperimenti in vitro o sui modelli animali sull’interazione tra le cellule tumorali e il sistema immunitario. Come già detto, la sorveglianza dei tumori è una funzione importante del sistema immunitario; i processi infiammatori portano alla distruzione delle cellule degenerate. D’altra parte, l’infiammazione può anche contribuire alla proliferazione tumorale e inibire la sorveglianza del tumore. È noto che l’infiammazione cronica aumenta il rischio di linfoma [1]. Osservazioni simili esistono per alcuni tumori solidi, a seconda dello stadio tumorale [2–4]. A seconda del microambiente, gli stessi gruppi di cellule o citochine possono avere effetti molto diversi, cioè sia inibire il tumore che promuoverlo. Ad esempio, il TNF-alfa, che è noto soprattutto come citochina inibitrice del tumore, può stimolare le cellule T regolatorie nel tumore ovarico, che sono associate a un rischio maggiore di progressione perché probabilmente sopprimono la sorveglianza del tumore [5].
Gli studi che altrimenti forniscono le migliori prove in medicina, ossia gli studi controllati randomizzati, sono adatti solo in misura molto limitata, anche dopo la meta-analisi, per chiarire la questione se la rispettiva preparazione aumenta il rischio di recidiva del tumore. Ci sono diverse ragioni per questo:
- Il calcolo del numero di casi e la progettazione degli studi di registrazione sono orientati principalmente alla prova di efficacia. Di conseguenza, i numeri dei casi sono troppo piccoli e il follow-up troppo breve per cogliere alcuni aspetti della sicurezza.
- Le malattie maligne sono eventi rari che di solito si manifestano solo dopo un lungo periodo di latenza. Con la ciclofosfamide, queste latenze sono comprese tra 10 e 15 anni.
- Le malattie maligne pregresse (ad eccezione dei tumori cutanei non melanocitici) e spesso l’età avanzata sono criteri di esclusione. Inoltre, non è raro che i pazienti anziani abbiano delle comorbidità o delle limitazioni logistiche, per cui i pazienti ad alto rischio di cancro sono solitamente sottorappresentati negli studi.
Ci sono relativamente pochi studi che si concentrano principalmente sul rischio di recidiva del tumore durante la terapia immunosoppressiva. Si tratta di valutazioni di registri nazionali o di database assicurativi. Tuttavia, poiché sono gli stessi medici partecipanti a determinare in questi studi la terapia che riceve un paziente con una precedente malattia maligna, possono verificarsi delle falsificazioni, in quanto i preparati che il medico ritiene abbiano un alto potenziale di promozione del tumore vengono utilizzati con maggiore cautela nei pazienti con un alto rischio di recidiva del tumore. Nell’analisi statistica di questi studi, si cerca di contrastare questo pregiudizio aggiustando i fattori di rischio abituali per la recidiva del tumore (ad esempio, lo stadio iniziale del tumore). Il vantaggio dei database assicurativi è l’elevato numero di casi, lo svantaggio è la mancanza di informazioni dettagliate sul singolo paziente, che rende l’adeguamento notevolmente più difficile.
In assenza di prove dirette sul rischio di recidiva del tumore, per la maggior parte delle preparazioni si cerca di orientarsi sul rischio di insorgenza di nuovi tumori incidenti negli studi randomizzati, nei registri e nei database assicurativi e si estrapola questo rischio al rischio di recidiva.
Alla luce di queste limitazioni nella situazione dei dati, si presentano anche altre possibilità per acquisire conoscenze:
- Uno esamina gli studi sulla terapia immunosoppressiva nelle popolazioni a rischio che hanno una maggiore probabilità di malignità: per esempio, i pazienti con condizioni precancerose come la neoplasia intraepiteliale cervicale o le gammopatie monoclonali.
- Per gli studi in cui si utilizzano dosi diverse, si può studiare un effetto dose.
- I tumori cutanei non melanocitici (NMSC) sono tumori maligni che si verificano più frequentemente e per i quali sono state riscontrate differenze anche in studi con un follow-up più breve [6]. Queste entità potrebbero servire come surrogato limitato del rischio di cancro complessivo, soprattutto perché di solito non sono criteri di esclusione per gli studi controllati randomizzati. Tuttavia, le NMSC spesso non vengono catturate completamente nemmeno negli studi, motivo per cui sono spesso escluse dalle considerazioni sul rischio di malignità.
Quando si esaminano gli studi sull’incidenza della malattia maligna, si presta particolare attenzione al rispettivo gruppo di controllo. I confronti con la popolazione normale sono meno utili, in quanto le malattie infiammatorie reumatoidi spesso presentano un aumento dell’incidenza di alcuni tumori maligni indipendenti dalle influenze della terapia, come il carcinoma bronchiale nell’artrite reumatoide [7], i linfomi nella sindrome di Sjögren [8] e il carcinoma cervicale nel lupus eritematoso sistemico [9].
Dichiarazioni nelle linee guida e nelle raccomandazioni
Esistono molte linee guida nazionali e internazionali per la terapia dell’artrite reumatoide, che trattano il tema dell’anamnesi maligna in modo più o meno dettagliato [10]. Le raccomandazioni più chiare a questo proposito sono state formulate dall’American College of Rheumatology nel 2012 e nel 2015 [11,12]. Nelle raccomandazioni più vecchie, risalenti al 2012, si distingueva ancora – come nella maggior parte delle altre linee guida – se l’intervallo tra la fine della terapia curativa del tumore e l’inizio della terapia di base fosse superiore o al massimo pari a 5 anni. A quel tempo, si poteva solo fare riferimento al momento abituale di massima probabilità di recidiva del tumore e ai dati del settore dei trapianti di organi [13]. Oltre i 5 anni, qualsiasi terapia biologica (principalmente gli inibitori del TNF in quel momento) è stata considerata sicura. Nell’arco dei 5 anni, è stata data la preferenza al rituximab, senza che gli studi fossero in grado di giustificarlo all’epoca – con l’eccezione delle neoplasie a cellule B CD20+. L’unico studio pubblicato finora nel campo dell’ematooncologia, pur con tutti i problemi metodologici, tendeva a indicare che i pazienti che avevano ricevuto rituximab in aggiunta al trapianto autologo di cellule staminali avevano un rischio maggiore di tumori maligni secondari rispetto ai pazienti senza terapia con rituximab [14]. Solo successivamente sono state pubblicate le analisi dei registri che dimostrano che il rituximab è relativamente poco problematico, come spiegato di seguito.
Nella versione più recente delle raccomandazioni ACR del 2015, tuttavia, è stata abbandonata la distinzione tra terapia tumorale e reumatoide a seconda dell’intervallo. Nei pazienti con una neoplasia solida, la terapia di base può quindi essere trattata senza restrizioni, come nei pazienti RA senza una storia di neoplasia. Per il resto, sono state fatte delle prioritizzazioni per i DMARD per il cancro della pelle e le malattie linfoproliferative che sono così prive di prove o così contrarie alle prove non citate già disponibili all’epoca, che non saranno riprodotte qui. Tuttavia, il fatto che questi due gruppi di malattie maligne richiedano un’attenzione particolare sarà presentato di seguito.
Prove dirette sul rischio di recidiva del tumore con la terapia reumatologica
Nei registri nazionali di pazienti con RA, i pazienti con una storia di malignità sono stati confrontati in termini di studi caso-controllo con pazienti che avevano terapie simili al basale e nessuna storia di malignità. Nella maggior parte dei casi, si è cercato di aggiustare i fattori di rischio per la recidiva del tumore, come l’attività della malattia o l’obesità. I primi dati significativi provengono dal registro tedesco RABBIT [15] e dal Registro dei Biologici del Regno Unito [16]. Inoltre, vanno menzionate le analisi del registro statunitense CORRONA [17], del registro danese DANBIO [18] e – pubblicato solo di recente – del registro svedese ARTIS [19]. Recentemente, Xie e colleghi hanno pubblicato una meta-analisi di 11 studi, che include i registri sopra citati [20]. I dati sono utilizzabili solo per gli inibitori del TNF e il rituximab. Fortunatamente, non è stato riscontrato un aumento del rischio di ricaduta per gli inibitori del TNF o il rituximab rispetto ai pazienti che hanno ricevuto terapie di base sintetiche convenzionali (csDMARDs). Va notato che nella maggior parte degli studi l’intervallo tra la terapia oncologica e reumatologica è stato in media significativamente superiore a 5 anni – con due eccezioni: Il rituximab è stato utilizzato prima nel registro tedesco, seguendo la raccomandazione ACR più vecchia, e il registro danese ha permesso un confronto tra i pazienti con un intervallo alla terapia con inibitori del TNF superiore o inferiore a 5 anni. Qui, numericamente, c’era anche un rischio leggermente inferiore di recidiva del tumore con un intervallo più breve, anche dopo l’aggiustamento per gli stadi tumorali iniziali. Tuttavia, in questo caso è stato dimostrato che i medici che hanno partecipato al registro hanno effettivamente utilizzato maggiormente i biologici per gli stadi tumorali inizialmente più bassi. Anche una meta-analisi di 16 studi su diverse malattie autoimmuni (RA, malattia infiammatoria intestinale e psoriasi) non ha dimostrato una differenza statisticamente significativa nella recidiva del tumore a intervalli superiori o inferiori a 6 anni. L’analisi è stata principalmente correlata agli inibitori del TNF, alle tiopurine e al metotrexato [21]. Tuttavia, poiché la maggior parte dei dati dei registri mostra in media lunghi intervalli tra la terapia oncologica e quella reumatologica e gli studi dei registri possono essere soggetti a notevoli pregiudizi, la durata dell’intervallo dovrebbe comunque essere inclusa nella decisione sulla terapia reumatologica.
Probabilmente lo studio più informativo sul rischio di recidiva del tumore con un intervallo breve è l’analisi dei dati assicurativi statunitensi con un numero molto elevato di casi, condotta da Mamtani e colleghi [22]. Si trattava di pazienti con artrite reumatoide (>90%) o malattia infiammatoria intestinale che avevano ricevuto metotrexato, tiopurine, inibitori del TNF, combinazioni di questi o nessuna terapia di base dopo un intervento chirurgico curativo per carcinoma mammario. In oltre il 90% delle pazienti, gli inibitori del TNF sono stati ripresi entro un anno dall’intervento e anche con la somministrazione continua di inibitori del TNF, non è stato osservato un aumento del rischio di recidiva del tumore al seno. Tuttavia, il follow-up è stato di soli 3,4 anni. Poiché le recidive del carcinoma mammario possono verificarsi molto più tardi di 5 anni dopo l’intervento chirurgico, finora è stata consigliata una particolare cautela e un comportamento attendista nell’iniziare la terapia di base. Questo studio può essere utilizzato in una certa misura come contro-argomentazione di questa valutazione. Anche il registro del Regno Unito non ha mostrato un aumento dell’incidenza di nuovi carcinomi mammari con i TNFI rispetto ai csDMARD in un numero relativamente elevato di casi [23].
Dati sulle singole sostanze
Una descrizione dettagliata dei dati relativi a tutte le sostanze comunemente utilizzate in reumatologia sarebbe eccessiva nell’ambito di questo articolo di revisione. Pertanto, di seguito, la situazione dei dati sarà valutata in forma sintetica secondo la Tabella 1 e il rischio tumorale delle singole sostanze o gruppi di sostanze. Viene citata solo la letteratura attuale. Per una lettura più approfondita, rimandiamo qui alle recensioni significative [24–27].

Va detto subito che solo per la ciclofosfamide esiste un chiaro segnale di aumento del rischio di tumore o di recidiva tumorale – e solo a dosi cumulative più elevate. Le terapie immunomodulanti o immunosoppressive, altrimenti comuni in reumatologia, probabilmente avranno al massimo un’influenza minore – e in alcune situazioni persino favorevole – su questi rischi. Con l’aumentare delle prove, il quadro positivo tende ad essere confermato.
Nella tabella 2, sullo sfondo della letteratura pertinente, si è cercato di valutare in che misura le singole sostanze della terapia reumatologica possano avere un effetto sul rischio di insorgenza di nuovi tumori o di recidive di tumori. Sebbene si tratti di una notevole semplificazione della complessa materia, dovrebbe servire come un rapido orientamento e un punto di partenza per ulteriori discussioni e ricerche. Il giudizio complessivo su una sostanza deve sempre fare riferimento sia alla qualità dei dati che alle indicazioni di rischio maligno che ne emergono. Pertanto, in caso di dubbio, si preferisce scegliere quello con i dati migliori per le sostanze alternative con un rischio probabilmente basso.
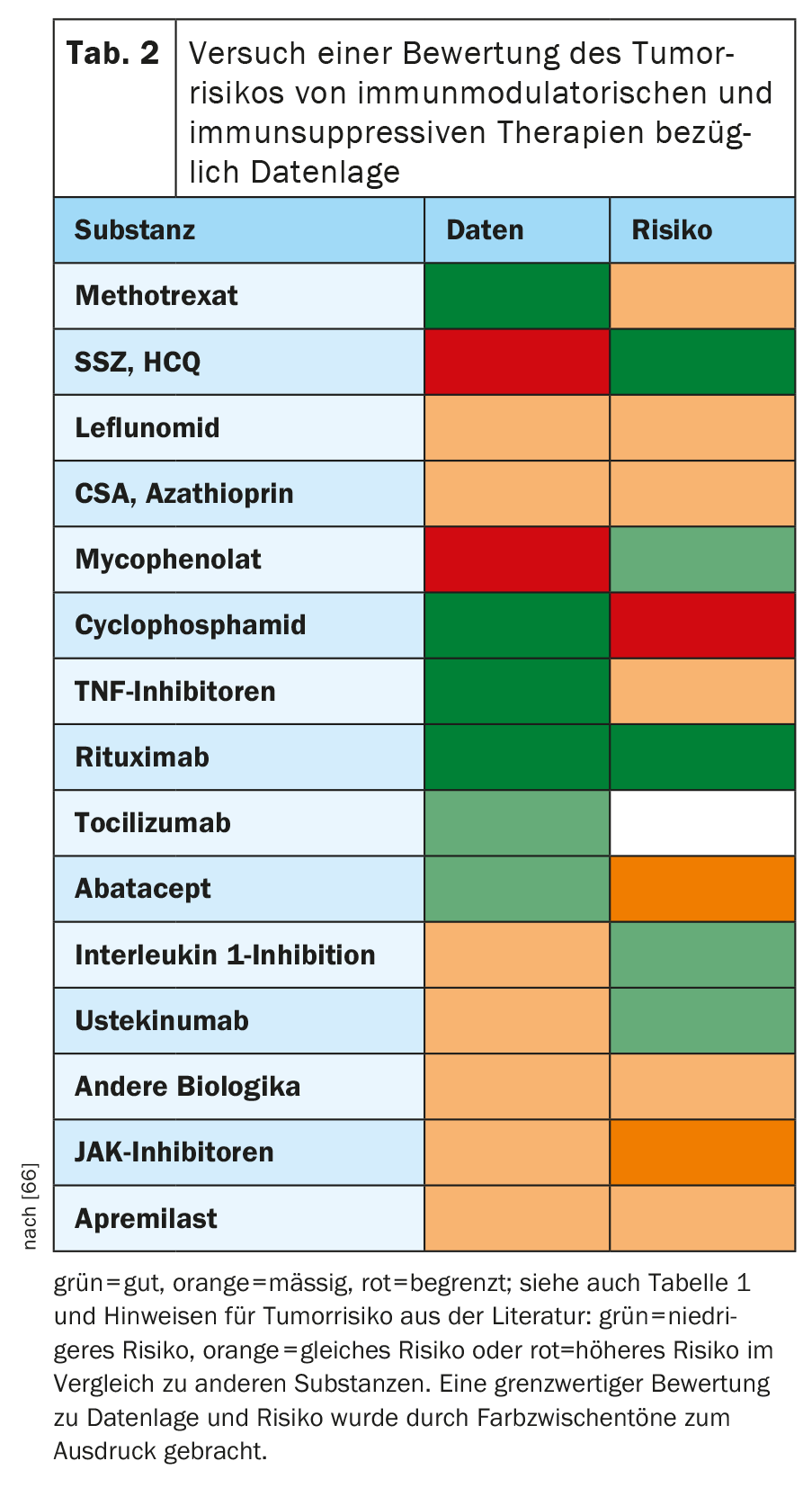
Metotrexato: Situazione dei dati: buona.
Il metotrexato viene utilizzato come terapia di mantenimento per la leucemia linfatica acuta. Si deve ipotizzare un rischio cumulativo leggermente maggiore, dipendente dalla dose, di tumore cutaneo non melanocitico, che è stato dimostrato anche nel grande studio randomizzato sull’uso del metotrexato nei pazienti a rischio cardiovascolare [28,29]. L’accumulo di malattie linfoproliferative descritto principalmente dagli autori giapponesi, che a volte si rimettono spontaneamente dopo l’interruzione del metotrexato [30], non è confermato nella sinossi di altri dati di registro dettagliati [31].
Leflunomide, idrossiclorochina, sulfasalazina: Situazione dei dati: moderata per leflunomide, scarsa per idrossiclorochina e sulfasalazina.
La leflunomide ha effetti di inibizione del tumore, almeno in vitro. Il clustering numerico del cancro al pancreas nel registro RABBIT con leflunomide non è stato riscontrato in altri registri [32].
Per l’idrossiclorochina, uno studio nel LES e con un basso numero di eventi maligni suggerisce un effetto protettivo contro i tumori maligni [33]. Un recente studio sulle collagenosi suggerisce solo un effetto benefico sull’incidenza della malattia tumorale metastatica [34]. Le terapie oncologiche in combinazione con l’idrossiclorochina sono discusse a causa dell’effetto sull’autofagocitosi.
La sulfasalazina, come la mesalazina, può ridurre il rischio di cancro al colon nella colite ulcerosa [35].
Apremilast: Situazione dei dati: moderata.
Le segnalazioni di eventi avversi dell’FDA suggeriscono che apremilast ha un rischio tumorale ancora più basso di ustekinumab [36]. Analogamente all’idrossiclorochina e alla sulfasalazina, un effetto sfavorevole sullo sviluppo del tumore sembra improbabile, se non altro per il meccanismo d’azione.
Azatioprina, ciclosporina A, micofenolato: Situazione dei dati: moderata.
Ci sono indicazioni che la terapia combinata di azatioprina con infliximab potrebbe portare ad un aumento dell’incidenza dei rarissimi linfomi epatosplenici a cellule T negli uomini con malattia infiammatoria intestinale [37]. Il raggruppamento delle neoplasie mieloidi da azatioprina in diverse malattie autoimmuni, postulato in uno studio pubblicato di recente, non è stato riscontrato in altri studi ed è probabilmente dovuto al fatto che sono state confrontate popolazioni molto eterogenee [38]. Sia per l’azatioprina che per la ciclosporina A, il rischio di NMSC sembra essere aumentato [39], per il CSA soprattutto in associazione con la terapia della luce per la psoriasi [40]. I dati sull’azatioprina provenienti da diversi registri sull’incidenza del cancro complessivo, del carcinoma uroteliale e del linfoma sono contrastanti, sebbene non emerga un segnale forte. Per l’MMF, esistono studi soprattutto nel campo dei trapianti di organi. In questo caso, il rischio di cancro sembra essere complessivamente un po’ più basso per i tumori della pelle e per i disturbi linfoproliferativi post-trapianto rispetto ad altri regimi immunosoppressivi post-trapianto [41].
Ciclofosfamide: Situazione dei dati: buona.
A seconda della dose cumulativa di ciclofosfamide, aumenta il rischio di nuove neoplasie o recidive tumorali. La maggior parte degli studi indica valori compresi tra 20 e 30 g come limite oltre il quale questo rischio viene calcolato come significativamente aumentato [42]. Uno studio su pazienti affetti da LES nella Corea del Sud ha persino rilevato un aumento del rischio di incidenza di tumori maligni con una dose cumulativa di >6 g [43]. Anche questo valore, tuttavia, non viene raggiunto dai moderni protocolli di ciclofosfamide, come il protocollo Euro-Lupus.
Biologici
Inibitori del TNF: Situazione dei dati: molto buona.
Si deve sospettare un leggero aumento del rischio di NMSC [44]. Se ci sia un aumento del rischio di melanoma maligno con il TNFI è stato discusso a lungo senza che emergessero segnali chiari. Un’analisi di 11 registri RA europei [45] e la più recente analisi del registro australiano ARAD [46] per i pazienti con RA non hanno trovato alcuna evidenza di un aumento del rischio. Diversi studi non hanno rilevato un aumento significativo del rischio di progressione dalla dispalsia intraepiteliale cervicale nota al carcinoma cervicale con il TNFI [47]. Una recente analisi dei dati assicurativi statunitensi suggerisce un aumento del rischio di linfoma [48], che non è stato riscontrato negli studi di diversi registri nazionali [49]. I dati importanti e rassicuranti degli studi sul rischio di recidiva tumorale con il TNFI sono stati presentati in precedenza. In questo contesto, sono interessanti i dati provenienti dal campo delle terapie immuno-oncologiche con i cosiddetti inibitori del checkpoint (ICPI): I modelli murini [50,51] e una prima serie di casi [52] suggeriscono che la combinazione dell’ICPI con il TNFI potrebbe non solo portare a un tasso inferiore di effetti collaterali immuno-mediati, ma anche a un migliore controllo del tumore.
Rituximab: Situazione dei dati: molto buona.
Sebbene il rituximab sia stato a lungo utilizzato in Germania, in conformità con le vecchie raccomandazioni ACR, relativamente presto dopo la terapia curativa del tumore, non vi è alcuna evidenza nella letteratura sulle malattie reumatologiche (in particolare la RA) di un aumento del rischio di recidiva del tumore o di nuovi tumori maligni. I dati favorevoli del registro sul rischio di recidiva del tumore sono stati presentati in precedenza.
Tocilizumab, Sarilumab: Situazione dei dati: buona per tocilizumab, limitata per sarilumab.
Tocilizumab viene utilizzato terapeuticamente in diverse situazioni terapeutiche in oncologia: Trattamento della malattia di Castleman (approvazione in Giappone), trattamento della tempesta di citochine dopo la terapia con cellule CAR T (approvazione), trattamento degli effetti collaterali immuno-mediati degli inibitori del checkpoint (serie di casi, parere di esperti) [53]. Le considerazioni sul meccanismo d’azione che pongono tocilizumab in una luce favorevole nel contesto delle malattie maligne non devono essere sovrainterpretate. Un’ampia analisi dei database assicurativi statunitensi non ha riscontrato almeno un rischio maggiore di eventi maligni nella RA con tocilizumab rispetto a TNFI o abatacept, con NMSC escluso dall’analisi [54].
Abatacept: Situazione dei dati: buona.
Anche in questo caso, le considerazioni sul meccanismo d’azione, che è esattamente opposto a quello dell’inibitore del checkpoint ipilimumab, non devono essere sovrainterpretate. Tuttavia, un ampio studio di registro [55] e un’analisi dei dati assicurativi statunitensi [56] suggeriscono un aumento del rischio di NMSC anche rispetto ad altri biologici. Per quanto riguarda l’incidenza complessiva del cancro e l’incidenza del melanoma, i dati sono contraddittori [57].
Secukinumab, ixekizumab: Situazione dei dati: moderata per secukinumab, limitata per ixekizumab.
Le vie di segnalazione dell’IL17 possono teoricamente essere sia promotrici che inibitrici del tumore. L’argomentazione della linea guida tedesca S3 per il trattamento della psoriasi, che dà la preferenza al secukinumab e all’ustekinumab rispetto al TNFI in caso di malattia maligna pregressa, non sembra conclusiva per quanto riguarda il secukinumab [58]. I dati sul presunto aumento del rischio di tumore con il TNFI vengono qui sovrainterpretati e contrapposti ai dati sul secukinumab, che non mostrano alcuna evidenza di aumento dell’incidenza di tumori, ma non sono nemmeno adatti a indagare questa domanda a causa del basso numero di casi e del breve follow-up.
Ustekinumab: Situazione dei dati: buona.
In una valutazione del registro PSOLAR per la terapia della psoriasi, ustekinumab e metotrexato hanno mostrato un rischio complessivo di cancro inferiore rispetto al TNFi [59]. Questo supporterebbe la suddetta raccomandazione della linea guida tedesca sulla psoriasi, ma idealmente dovrebbe essere confermata in altri studi e situazioni terapeutiche, soprattutto perché i dati già citati, difficili da interpretare, dei rapporti sugli effetti collaterali della FDA, parlano di un rischio maggiore rispetto ad apremilast.
Anakinra, canakinumab: Situazione dei dati: da moderata a buona.
Anakinra è utilizzato per la terapia della sindrome di Schnitzler. In questa malattia, c’è un’associazione di vasculite orticaria con gammopatia monoclonale di significato non chiaro, che è una condizione precancerosa. Nello studio CANTOS, i pazienti con CRP elevata dopo un infarto miocardico hanno ricevuto canakinumab o placebo [60]. Sebbene l’endpoint primario sia stato raggiunto, questo studio non ha portato all’approvazione per questa indicazione, ma è stata osservata una minore incidenza di carcinoma bronchiale nel braccio di studio. Infatti, l’interleuchina-1 può avere effetti di promozione del tumore. Questa osservazione sarà seguita in un programma di studio oncologico.
Belimumab: Situazione dei dati: moderata.
Non sono disponibili risultati separati sul rischio di malattie maligne.
Inibitori della JAK: Situazione dei dati: buona per tofacitinib, moderata per baricitinib, limitata per upadacitinib.
La considerazione del rischio tumorale degli inibitori JAK dovrebbe essere particolarmente fondata ora e in futuro, poiché si tratta di farmaci immunosoppressivi molto potenti e si possono già notare alcuni segnali, che però non forniscono ancora un quadro chiaro. I pazienti con neoplasie mieloproliferative (MPN) presentano popolazioni di cellule B monoclonali raggruppate nel midollo osseo e quindi un rischio più elevato di neoplasie a cellule B. Un gruppo di ricerca ematooncologica di Vienna ha valutato una coorte di pazienti con MPN, alcuni dei quali sono stati trattati con diversi inibitori della JAK approvati e sperimentali [61]. Questa coorte ha mostrato un rischio significativamente aumentato di neoplasia aggressiva delle cellule B con gli inibitori JAK. Questa osservazione è stata supportata da un modello murino del gruppo di ricerca, ma non è stata confermata da uno studio analogo su una coorte di MPN più ampia dell’MD Anderson [62]. Nel programma di studi randomizzati sulla RA di upadacitinib, è stato riscontrato un rischio significativamente più elevato di NMSC alla dose non approvata di 30 mg rispetto a quella di 15 mg [63]. Anche con baricitinib, si sono verificati relativamente più NMSC numericamente alla dose più alta di 4 mg nella RA rispetto a quella di 2 mg [64]. Esistono già dati di registro significativi solo per tofacitinib. Nel registro statunitense CORRONA, i tassi di NMSC e di tumore senza NMSC con tofacitinib erano comparabili con i biologici e non differivano significativamente [65]. Tuttavia, occorre sottolineare ancora una volta la possibilità di un pregiudizio nei registri. Inoltre, questo studio non è ancora stato pubblicato completamente.
Strategie terapeutiche a seconda della situazione
Sullo sfondo di queste considerazioni, di seguito si cercherà di formulare proposte per la terapia reumatologica dei pazienti con una storia di malignità. Questi suggerimenti sono una sintesi delle raccomandazioni esistenti nelle linee guida e delle prove descritte e riviste. Non sono state sottoposte a un processo di consenso e riflettono semplicemente l’opinione individuale dell’autore:
- Le decisioni terapeutiche in questo contesto sono molto cariche di emozioni e devono essere discusse in dettaglio con il paziente e il collega oncologo.
- In una situazione di terapia palliativa, bisogna distinguere se la prognosi e le opzioni di terapia oncologica sono molto limitate o se esiste la possibilità di controllare la malattia a lungo termine attraverso i concetti di terapia oncologica (moderna). In particolare, la valutazione delle terapie DMARD dopo le terapie immuno-oncologiche è difficile, ma può essere supportata dall’esperienza oncologica sulla terapia immunosoppressiva degli effetti collaterali immuno-mediati di questi trattamenti. Se l’obiettivo terapeutico primario è il sollievo dai sintomi, di solito la terapia reumatologica può essere perseguita senza limitazioni. L’obiettivo del controllo del tumore a lungo termine dovrebbe essere simile ai concetti di terapia curativa.
- Se l’obiettivo della terapia è curativo, la terapia reumatologica può probabilmente essere effettuata senza restrizioni 5 anni dopo il completamento della terapia oncologica. Diversi anni di terapie oncologiche di mantenimento non dovrebbero ritardare ulteriormente questo intervallo. Anche oltre un intervallo di 5 anni, si dovrebbe piuttosto evitare abatacept, gli inibitori della JAK e forse anche gli inibitori del TNF nel melanoma maligno, a causa della situazione poco chiara dei dati, soprattutto se esistono opzioni terapeutiche alternative.
- Nei linfomi trattati in modo curativo, bisogna essere piuttosto cauti con gli inibitori della JAK e forse anche con gli inibitori del TNF. Al contrario, il rituximab e forse anche il tocilizumab hanno un effetto favorevole nei casi di precedente neoplasia delle cellule B o di discrasie plasmacellulari.
- In caso di obiettivo terapeutico curativo, si raccomanda un intervallo di 5 anni:
- Sospendere la terapia di base e fare un ponte con glucocorticosteroidi (o farmaci antinfiammatori non steroidei) durante la chemioterapia.
- Considerazione delle interazioni nelle terapie di mantenimento oncologico a lungo termine
- Altrimenti, una terapia di base coerente, nel senso di un concetto graduale orientato al rischio individuale di recidiva del tumore e ai dati disponibili sui DMARD in questione. La situazione dei dati deve essere valutata sia in base al numero di studi disponibili e alla loro qualità, sia in base al fatto che siano state dimostrate indicazioni per un rischio tumorale inferiore o superiore rispetto ad altre sostanze.
- Tuttavia, l’infiammazione incontrollata a lungo termine o la terapia a lungo termine con glucocorticoidi ad alte dosi, dovuta a un’eccessiva restrizione prima della terapia di base, devono essere evitate a tutti i costi.
- A causa dell’elevata complessità delle interazioni del sistema immunitario e del tumore in relazione alle terapie immuno-oncologiche (inibitori del checkpoint), si raccomanda di far prendere le decisioni sulla terapia reumatologica da un centro specializzato.
Messaggi da portare a casa
- La decisione sulle terapie immunomodulanti o immunosoppressive nei pazienti con una storia di malignità deve essere presa su base interdisciplinare e sempre in stretta consultazione con il paziente.
- Una crescente ricchezza di dati aiuta nella valutazione dei DMARD singoli. La situazione dei dati è complessa da valutare a causa delle diverse limitazioni dei formati di studio, ma con pochissime eccezioni, il quadro è piuttosto positivo.
- Esistono studi su alcune sostanze (inibitori del TNF, rituximab) che hanno analizzato principalmente il rischio di recidiva del tumore dopo l’insorgere della malattia maligna. Per altre sostanze, le informazioni possono essere ottenute dai dati sul rischio di tumori incidenti e, in misura limitata, esaminando i modelli preclinici.
- Solo la ciclofosfamide in dosi cumulative elevate presenta un forte segnale di aumento del rischio di tumore. Con le alternative disponibili, probabilmente si dovrebbe evitare l’abatacept, gli inibitori della JAK e forse gli inibitori del TNF in alcune situazioni. Per gli inibitori del TNF, la situazione dei dati è particolarmente conclusiva in alcune situazioni (ad esempio, la condizione dopo il carcinoma mammario) e appare piuttosto favorevole.
- Diverse sostanze aumentano il rischio di tumori cutanei non melanocitici. Questo rischio può essere ben contrastato avviando uno screening costante dei tumori cutanei.
Letteratura:
- Baecklund E, Iliadou A, Askling J, et al: Associazione dell’infiammazione cronica, non del suo trattamento, con un aumento del rischio di linfoma nell’artrite reumatoide. Arthritis Rheum 2006; 54(3): 692-701.
- Zhang Y, Sun Y, Zhang Q: Valore prognostico dell’indice di immuno-infiammazione sistemica nelle pazienti con cancro al seno: una meta-analisi. Cancer Cell Int 2020; 20: 224.
- Hirano T, Hirayama D, Wagatsuma K, et al: Meccanismi immunologici nella carcinogenesi del colon associata all’infiammazione. Int J Mol Sci 2020; 21(9): 3062.
- Moik F, Zöchbauer-Müller S, Posch F, et al.: L’infiammazione sistemica e l’attivazione dell’emostasi predicono la cattiva prognosi e la risposta alla chemioterapia nei pazienti con tumore al polmone avanzato. Cancers (Basilea) 2020; 12(6): E1619.
- Kampan NC, Madondo MT, McNally OM, et al: L’interleuchina 6 presente nelle ascite infiammatorie di pazienti con carcinoma ovarico epiteliale avanzato promuove le cellule T regolatorie che esprimono il recettore 2 del fattore di necrosi tumorale. Front Immunol 2017; 8: 1482.
- Krathen MS, Gottlieb AB, Mease PJ: Immunomodulazione farmacologica e malignità cutanea nell’artrite reumatoide, nella psoriasi e nell’artrite psoriasica. J Rheumatol 2010; 37(11): 2205-2215.
- Mercer LK, Davies R, Galloway JB, et al: Rischio di cancro nei pazienti che ricevono una terapia non biologica modificante la malattia per l’artrite reumatoide rispetto alla popolazione generale del Regno Unito. Reumatologia 2013; 52: 9198.
- Nocturne G, Mariette X: Linfomi associati alla sindrome di Sjögren: un aggiornamento sulla patogenesi e sulla gestione. Br J Haematol 2015; 168(3): 317-327.
- Feldman CH, Liu J, Feldman S, et al: Rischio di displasia cervicale di alto grado e di cancro al collo dell’utero nelle donne con lupus eritematoso sistemico che ricevono farmaci immunosoppressori. Lupus 2017 Jun; 26(7): 682-689.
- Lopez-Olivo MA, Colmegna I, Karpes Matusevich AR, et al: Revisione sistematica delle raccomandazioni sull’uso dei farmaci antireumatici modificanti la malattia nei pazienti con artrite reumatoide e cancro. Arthritis Care Res (Hoboken) 2020; 72(3): 309-318.
- Singh JA, Furst DE, Bharat A, et al: Aggiornamento 2012 delle raccomandazioni dell’American College of Rheumatology del 2008 per l’uso di farmaci antireumatici modificanti la malattia e agenti biologici nel trattamento dell’artrite reumatoide. Arthritis Care Res (Hoboken) 2012; 64(5): 625-639.
- Singh JA, Saag KG, Bridges SL Jr, et al: Linea guida 2015 dell’American College of Rheumatology per il trattamento dell’artrite reumatoide. Arthritis Care Res (Hoboken) 2016 Jan; 68(1): 1-25.
- Penn I: Valutazione dei candidati al trapianto con tumori maligni preesistenti. Ann Transplant 1997; 2(4): 14-17.
- Tarella C, Passera R, Magni M, et al: Fattori di rischio per lo sviluppo di una neoplasia secondaria dopo chemioterapia ad alte dosi e autotrapianto, con o senza rituximab: uno studio retrospettivo di 20 anni di follow-up in pazienti con linfoma. J Clin Oncol 2011 Mar 1; 29(7): 814-824.
- Strangfeld A, Hierse F, Rau R, et al: Rischio di neoplasie incidenti o ricorrenti tra i pazienti con artrite reumatoide esposti alla terapia biologica nel registro tedesco dei biologici RABBIT. Arthritis Res Ther 2010; 12: R5.
- Dixon WG, Watson KD, Lunt M, et al: Influenza della terapia con fattore di necrosi antitumorale sull’incidenza del cancro nei pazienti con artrite reumatoide che hanno avuto una precedente neoplasia: risultati del Registro Biologico della Società Britannica di Reumatologia. Arthritis Care Res 2010; 62: 755-763.
- Pappas DA, Rebello S, Liu M, et al: Terapia con agenti biologici dopo la diagnosi di tumori solidi: risultati del Registro Corrona. J Rheumatol 2019; 46(11): 1438-1444.
- Dreyer L, Cordtz RL, Hansen IMJ, et al: Rischio di seconda neoplasia maligna e mortalità nei pazienti con artrite reumatoide trattati con DMARD biologici: uno studio di coorte danese basato sulla popolazione. Ann Rheum Dis 2018; 77(4): 510-514.
- Raaschou P, Söderling J, Turesson C, et al: Inibitori del fattore di necrosi tumorale e recidiva di cancro nei pazienti svedesi con artrite reumatoide: uno studio di coorte basato sulla popolazione nazionale. Ann Intern Med 2018; 169: 291-299.
- Xie W, Xiao S, Huang Y, et al: Una meta-analisi delle terapie biologiche sul rischio di cancro nuovo o ricorrente nei pazienti con artrite reumatoide e una precedente neoplasia. Rheumatology (Oxford) 2019 Oct 17; [Epub ahead of print].
- Shelton E, Laharie D, Scott FI, et al: Recidiva del cancro in seguito a terapie immunosoppressive in pazienti con malattie immunomediate: revisione sistematica e meta-analisi. Gastroenterologia 2016; 151(1): 97-109.e4.
- Mamtani R, Clark AS, Scott FI, et al: Associazione tra recidiva di cancro al seno e immunosoppressione nell’artrite reumatoide e nella malattia infiammatoria intestinale: uno studio di coorte. Arthritis Rheumatol 2016; 68: 2403-2411.
- Mercer LK, Lunt M, Low AL, et al: Rischio di cancro solido nei pazienti esposti alla terapia con fattore di necrosi tumorale: risultati del Registro Biologico della Società Britannica di Reumatologia per l’Artrite Reumatoide. Ann Rheum Dis 2015; 74(6): 1087-1093.
- Schmalzing M, Strangfeld A, Tony HP: Terapia farmacologica dell’artrite reumatoide con una storia di malignità. Dati epidemiologici [Trattamento farmacologico dell’artrite reumatoide con una storia di malignità. Dati epidemiologici]. Z Rheumatol 2016; 75(1): 22-31.
- Regierer AC, Strangfeld A: Trattamento dell’artrite reumatoide nei pazienti con una storia di cancro. Curr Opin Rheumatol 2018; 30(3): 288-294.
- Shelton E, Laharie D, Scott FI, et al: Recidiva del cancro in seguito a terapie immunosoppressive in pazienti con malattie immunomediate: revisione sistematica e meta-analisi. Gastroenterologia 2016; 151(1): 97-109.e4.
- De Cock D, Hyrich K: Malignità e artrite reumatoide: epidemiologia, fattori di rischio e gestione. Best Pract Res Clin Rheumatol 2018; 32(6): 869-886.
- Lange E, Blizzard L, Venn A, et al: Farmaci antireumatici modificanti la malattia e cancro della pelle non melanoma nei pazienti affetti da artrite infiammatoria: uno studio di coorte retrospettivo. Rheumatology (Oxford) 2016; 55(9): 1594-1600.
- Solomon DH, Glynn RJ, Karlson EW, et al: Effetti avversi del metotrexato a basso dosaggio: uno studio randomizzato. Ann Intern Med 2020 Feb 18; [Epub ahead of print].
- Rizzi R, Curci P, Delia M, et al.: Remissione spontanea dei “disturbi linfoproliferativi associati al metotrexato” dopo la sospensione del trattamento immunosoppressivo per la malattia autoimmune. Revisione della letteratura. Med Oncol 2009; 26(1): 1-9.
- Hellgren K, Baecklund E, Backlin C, et al: Artrite reumatoide e rischio di linfoma maligno: il rischio è ancora aumentato? Arthritis Rheumatol 2017; 69(4): 700-708.
- Behrens F, Koehm M, Burkhardt H: Aggiornamento 2011: leflunomide nell’artrite reumatoide – punti di forza e di debolezza. Curr Opin Rheumatol 2011; 23(3): 282-287.
- Ruiz-Irastorza G, Ugarte A, Egurbide MV,et al: Gli antimalarici possono influenzare il rischio di malignità nel lupus eritematoso sistemico. Ann Rheum Dis 2007; 66(6): 815-817.
- Fardet L, Nazareth I, Petersen I: Effetti dell’esposizione cronica a idrossiclorochina/clorochina sul rischio di cancro, metastasi e morte: uno studio di coorte basato sulla popolazione di pazienti con malattie del tessuto connettivo. Epidemiologia clinica 2017; 9: 545-554.
- Lopez A, Pouillon L, Beaugerie L, et al: Prevenzione del cancro colorettale nei pazienti con colite ulcerosa. Best Pract Res Clin Gastroenterol 2018; 32-33: 103-109.
- Moore TJ: Prospettive di sicurezza: rischi di cancro dei prodotti biologici per la psoriasi, www.ismp.org/quarterwatch/safety-perspectives (accesso: 29 marzo 2018).
- Thai A, Prindiville T: Linfoma epatosplenico a cellule T e malattia infiammatoria intestinale. J Crohns Colitis 2010; 4: 511-522.
- Ertz-Archambault N, Kosiorek H, Taylor GE, et al: Associazione della terapia per la malattia autoimmune con le sindromi mielodisplastiche e la leucemia mieloide acuta. JAMA Oncol 2017; 3(7): 936-943.
- Scott FI, Mamtani R, Brensinger CM, et al: Rischio di tumore cutaneo non melanoma associato all’uso di agenti immunosoppressori e biologici in pazienti con una storia di malattia autoimmune e tumore cutaneo non melanoma. JAMA Dermatol 2016; 152(2): 164-172.
- Muellenhoff MW, Koo JY: Ciclosporina e cancro della pelle: una prospettiva dermatologica internazionale in 25 anni di esperienza. Una revisione completa e una ricerca per definire l’uso sicuro della ciclosporina in dermatologia. J Dermatolog Treat 2012; 23(4): 290-304.
- Vos M, Plasmeijer EI, van Bemmel BC, et al: transizione da azatioprina a micofenolato mofetile e rischio di carcinoma a cellule squamose dopo il trapianto di polmone. J Heart Lung Transplant 2018; 37(7): 853-859.
- Hellbacher E, Hjorton K, Backlin C, et al: Linfoma maligno nella granulomatosi con poliangioite: sottotipi, caratteristiche cliniche e prognosi. Acta Oncol 2019; 58(11): 1655-1659.
- Kang KY, Kim HO, Yoon HS, et al: Incidenza del cancro tra le pazienti donne con lupus eritematoso sistemico in Corea. Clin Rheumatol 2010; 29(4): 381-388.
- Raaschou P, Simard JF, Asker Hagelberg C, et al: Artrite reumatoide, trattamento con fattore di necrosi tumorale e rischio di cancro della pelle a cellule squamose e basali: studio di coorte basato su dati nazionali registrati in modo prospettico in Svezia. BMJ 2016; 352: i262.
- Mercer LK, Askling J, Raaschou P, et al: Rischio di melanoma invasivo nei pazienti con artrite reumatoide trattati con biologici: risultati di un progetto collaborativo di 11 registri biologici europei. Ann Rheum Dis 2017; 76(2): 386-391.
- Staples MP, March L, Hill C, Lassere M, Buchbinder R: Rischio di malignità nei pazienti australiani affetti da artrite reumatoide trattati con terapia anti-fattore di necrosi tumorale: un aggiornamento dallo studio di coorte prospettico Australian Rheumatology Association Database (ARAD). BMC Rheumatol 2019; 3: 1.
- Cordtz R, Mellemkjær L, Glintborg B, et al: Progressione maligna delle lesioni precancerose della cervice uterina in seguito a terapia biologica DMARD in pazienti con artrite. Ann Rheum Dis 2015; 74(7): 1479-1480.
- Calip GS, Patel PR, Adimadhyam S, et al: Inibitori del fattore di necrosi tumorale-alfa e rischio di linfoma non-Hodgkin in una coorte di adulti con condizioni reumatologiche. Int J Cancer 2018; 143(5): 1062-1071.
- Mercer LK, Galloway JB, Lunt M, et al: Rischio di linfoma nei pazienti esposti alla terapia con fattore di necrosi antitumorale: risultati del Registro Biologico della Società Britannica di Reumatologia per l’Artrite Reumatoide. Ann Rheum Dis 2017; 76(3): 497-503.
- Perez-Ruiz E, Minuto L, Otano I, et al: Il blocco profilattico del TNF disaccoppia l’efficacia e la tossicità nell’immunoterapia duale CTLA-4 e PD-1. Natura 2019; 569(7756): 428-432.
- Bertrand F, Montfort A, Marcheteau E, et al: Il blocco del TNFα supera la resistenza agli anti-PD-1 nel melanoma sperimentale. Nat Commun 2017; 8(1): 2256.
- Badran YR, Cohen JV, Brastianos PK,et al: Terapia concomitante con inibitori del checkpoint immunitario e blocco del TNFα in pazienti con eventi avversi gastrointestinali immuno-correlati. J Immunother Cancer 2019; 7(1): 226.
- Kim ST, Tayar J, Trinh VA, et al: Trattamento di successo dell’artrite indotta da inibitori del checkpoint con tocilizumab: una serie di casi. Ann Rheum Dis 2017; 76(12): 2061-2064.
- Kim SC, Pawar A, Desai RJ, et al: Rischio di malignità associato all’uso di tocilizumab rispetto ad altri biologici nei pazienti con artrite reumatoide: uno studio di coorte multi-database. Semin Arthritis Rheum 2019; 49(2): 222-228.
- Wadström H, Frisell T, Askling J; Gruppo di studio Anti-Rheumatic Therapy in Sweden (ARTIS): Neoplasie maligne in pazienti con artrite reumatoide trattati con inibitori del fattore di necrosi tumorale, Tocilizumab, Abatacept o Rituximab nella pratica clinica: uno studio di coorte nazionale dalla Svezia. JAMA Intern Med 2017; 177(11): 1605-1612.
- Montastruc F, Renoux C, Dell’Aniello S, et al: Iniziazione di Abatacept nell’artrite reumatoide e rischio di cancro: uno studio di coorte comparativo basato sulla popolazione. Rheumatology (Oxford) 2019; 58(4): 683-691.
- de Germay S, Bagheri H, Despas F, et al: Abatacept nell’artrite reumatoide e il rischio di cancro: uno studio osservazionale mondiale post-marketing. Rheumatology (Oxford) 2019 Dec 27; [Epub ahead of print].
- Nast A, Amelunxen L, Augustin M, et al: S3-Leitlinie zur Therapie der Psoriasis vulgaris Update 2017. AWMF-Register Nr. 013/001.
- Fiorentino D, Ho V, Lebwohl MG, et al: Rischio di malignità con il trattamento della psoriasi sistemica nel Psoriasis Longitudinal Assessment Registry. J Am Acad Dermatol 2017; 77(5): 845-854.e5.
- Ridker PM, MacFadyen JG, Thuren T, et al: Effetto dell’inibizione dell’interleuchina-1β con canakinumab sull’insorgenza del cancro al polmone nei pazienti con aterosclerosi: risultati esplorativi di uno studio randomizzato, in doppio cieco, controllato con placebo. Lancet 2017; 390(10105): 1833-1842.
- Porpaczy E, Tripolt S, Hoelbl-Kovacic A, et al: Linfomi aggressivi a cellule B in pazienti con mielofibrosi che ricevono una terapia con inibitori di JAK1/2. Sangue 2018; 132(7): 694-706.
- Pemmaraju N, Kantarjian H, Nastoupil L, et al: Caratteristiche dei pazienti con neoplasie mieloproliferative con linfoma, con o senza terapia con inibitore JAK. Sangue 2019; 133(21): 2348-2351.
- Riassunto di sicurezza integrato, dati Abbvie in archivio.
- Smolen JS, Genovese MC, Takeuchi T, et al: Profilo di sicurezza di Baricitinib nei pazienti con artrite reumatoide attiva con oltre 2 anni di tempo mediano di trattamento. J Rheumatol 2019; 46(1): 7-18.
- Kremer J, Bingham C, Cappelli L, et al: Confronto dei tassi di malignità e mortalità tra Tofacitinib e i DMARD biologici nella pratica clinica: risultati a cinque anni di un registro sull’artrite reumatoide basato negli Stati Uniti [abstract]. Arthritis Rheumatol 2019; 71 (suppl. 10).
- Schmalzing M.: Terapia reumatologica medikamentöse nei casi di Malignomanamnese. Aktuelle Rheumatologie 2020; Georg Thieme Verlag KG Stuttgart; doi: 10.1055/a-1247-4252.
InFo ONCOLOGIA & EMATOLOGIA 2021; 9(1): 10-15