La patogenesi dell’hidradenitis suppurativa (HS) non è ancora stata completamente chiarita; si presume che ci siano interazioni multifattoriali. I fattori di rischio e le comorbidità più importanti includono il fumo, l’obesità e la sindrome metabolica. In genere si raccomanda un approccio terapeutico multimodale. Oltre alle misure non farmacologiche e ai preparati topici, vengono utilizzate anche terapie sistemiche, interventi chirurgici e altre modalità terapeutiche, a seconda della gravità. Oltre ad adalimumab, anche il secukinumab è disponibile come biologico in Svizzera dal 2023.
L’idradenite suppurativa (HS), nota anche come “acne inversa”, è una malattia cutanea cronica, ricorrente e mutilante dell’apparato terminale della ghiandola del follicolo pilifero, caratterizzata da lesioni nodulari infiammatorie dolorose con ascessi e formazione di fistole nelle aree del corpo che ospitano le ghiandole apocrine (Fig. 1) [1,39,49]. I siti di predilezione sono le regioni ascellare, inguinale e perianale [1]. I dati sulla prevalenza dell’HS variano; in Europa centrale è attualmente stimata intorno all’1% [14]. L’HS di solito si manifesta per la prima volta dopo la pubertà e raggiunge il picco massimo intorno ai 20-25 anni di età. A seconda dello studio, il rapporto tra donne e uomini è dato da 1:2 a 1:5 [2,3].
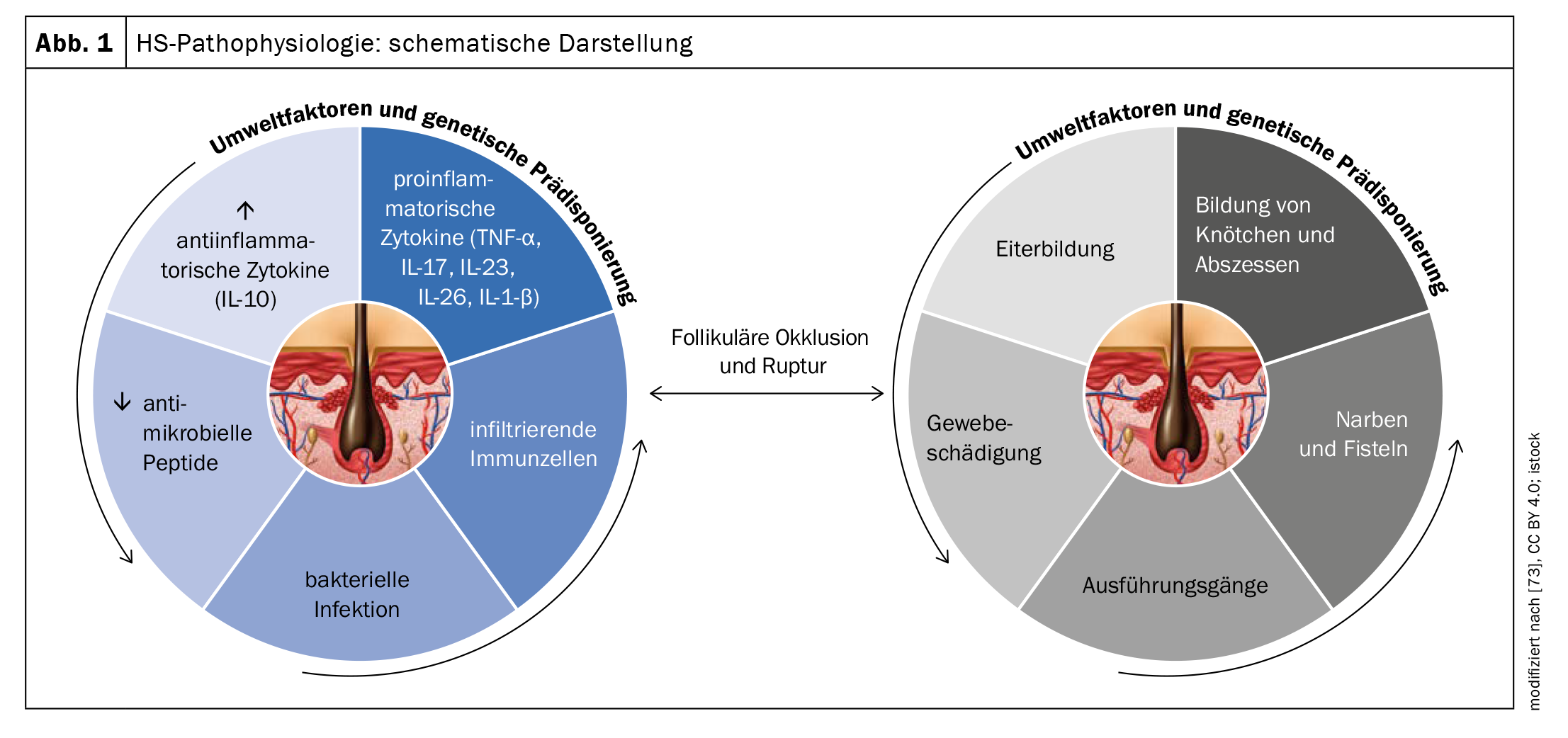
L’esatta patogenesi dell’HS non è ancora del tutto chiara, ma si presume che una combinazione di fattori genetici, ormonali e ambientali contribuisca al suo sviluppo (Fig. 1). Il fatto che il 35-40% abbia un’anamnesi familiare positiva suggerisce un coinvolgimento genetico. In termini di pato-meccanismo, le analisi delle biopsie indicano che l’HS si avvia a causa dell’occlusione del follicolo pilifero terminale in risposta all’ipercheratinizzazione, con conseguente formazione di noduli/cisti e infine rottura dell’epitelio follicolare [4–8]. Ne consegue un’infiammazione cronica con formazione di seni e fistole e un’estesa cicatrizzazione cutanea.
Caratteristiche cliniche e diagnosi
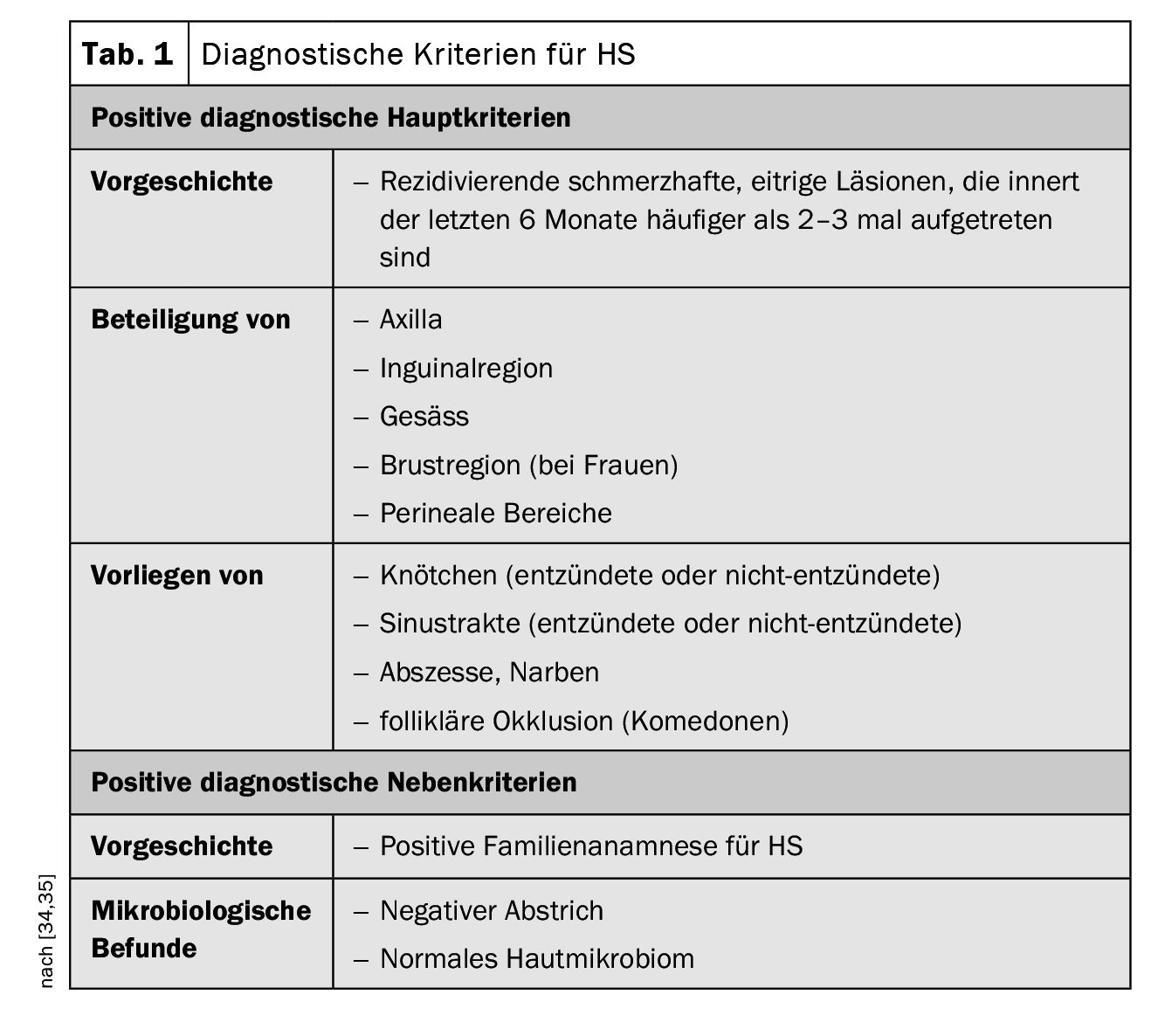
La presentazione clinica dell’HS è caratterizzata da un’infiammazione ricorrente che si è verificata più di due o tre volte nei sei mesi precedenti sotto forma di noduli, tratti fistolosi e/o cicatrici, in particolare nelle regioni delle pieghe del corpo [34,45]. Nelle fasi iniziali, la malattia viene spesso confusa con i comuni ascessi o la follicolite. In uno studio prospettico, la latenza media fino alla diagnosi corretta di HS è stata di 7,2-8,7 anni [35]. Se l’HS non viene diagnosticato e trattato adeguatamente in tempo, il processo infiammatorio può progredire, portando nel tempo alla distruzione dei tessuti. [47]. Ma i sintomi possono anche avere gravi conseguenze psicosociali. Le infezioni batteriche, la formazione di fistole e le contratture possono comportare una mobilità limitata e sono molto stressanti per i pazienti, come dimostrano gli studi empirici sulla qualità della vita (Box) [9]. L’esame clinico è centrale nel work-up diagnostico dell’HS. Le biopsie cutanee di solito non sono necessarie, ma possono essere utili per escludere una diagnosi differenziale con una causa batterica Gram-positiva (ad esempio, foruncoli o carbuncoli) [34]. Le tre principali caratteristiche cliniche dell’HS sono [1,16]:
- Localizzazione anatomica tipica (ascelle, inguine, natiche, seno, perianale, perigenitale),
- Lesioni tipiche: noduli profondi e dolorosi; ascessi; fistole drenanti; cicatrici),
- Decorso ricorrente o cronico
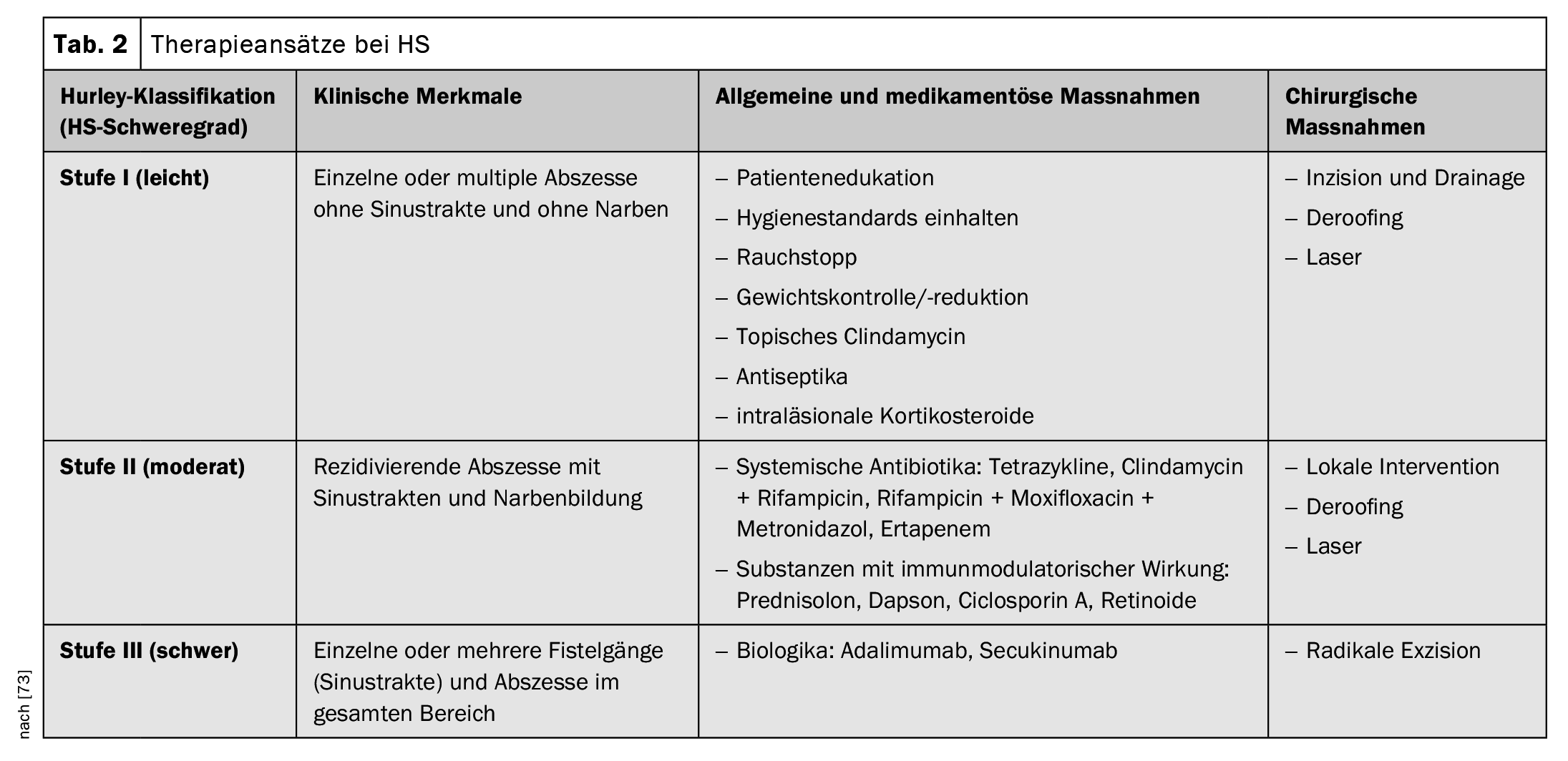
I criteri diagnostici postulati nelle raccomandazioni pratiche svizzere pubblicate nel 2017 sono riassunti nella Tabella 1; si basano sulle tre caratteristiche principali menzionate [16,34,35]. Attualmente non esiste un consenso internazionale sui punteggi da utilizzare per l’HS, ma le fasi di Hurley e il punteggio di Sartorius sono i più comunemente utilizzati [17,34,35]. Secondo la classificazione di Hurley, si distinguono i seguenti tre gradi di gravità a seconda della manifestazione clinica [17,46]:
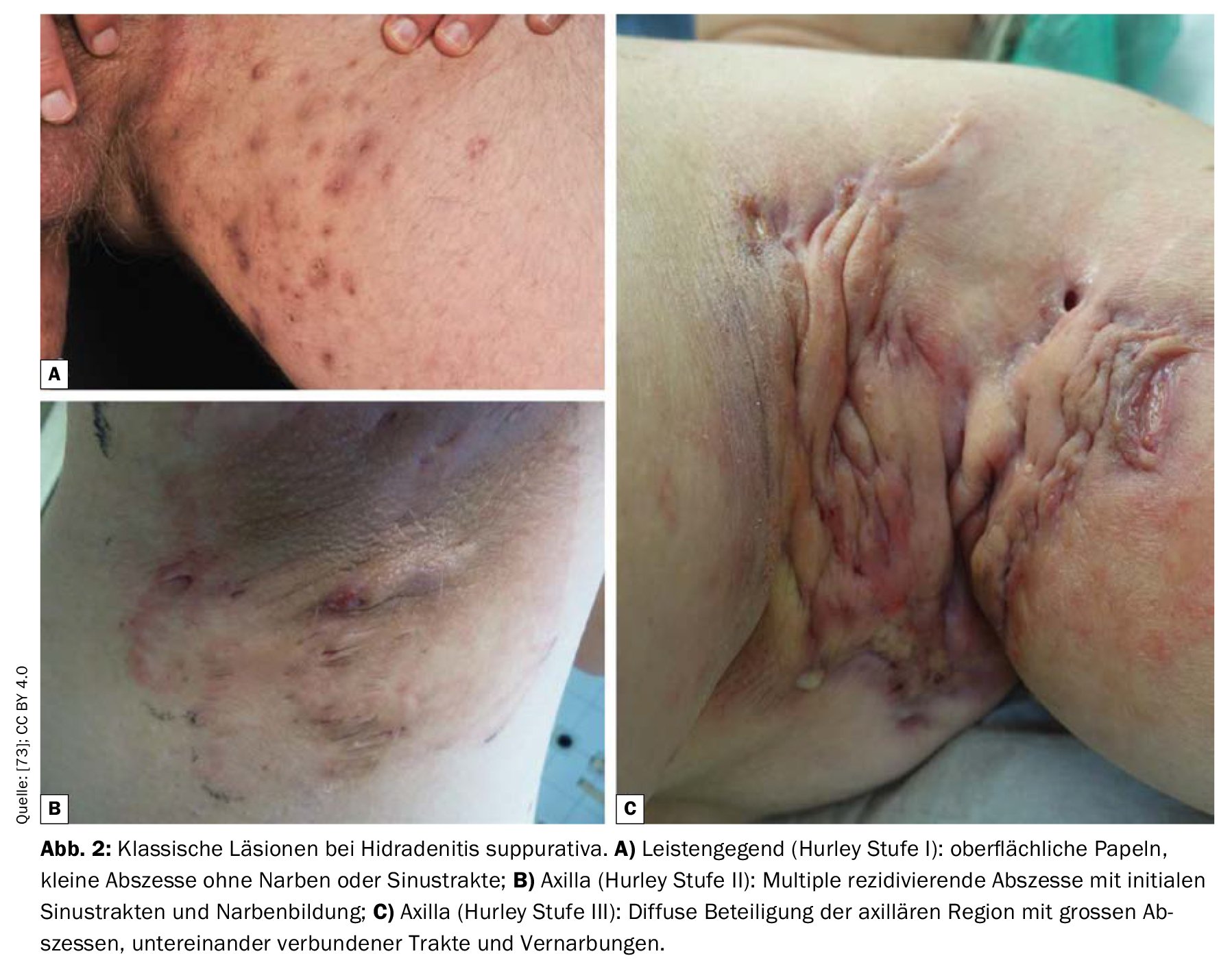
Fase I: Ascessi dolorosi isolati, singoli o multipli, senza filamenti cicatriziali;
Stadio II: ascessi dolorosi ricorrenti con formazione di filamenti e cicatrici, singoli o multipli, ma non estesi;
Stadio III: infiltrazioni infiammatorie diffuse, a placche, dolorose, o filamenti multipli interconnessi e ascessi. Esiste il rischio di contratture articolari come conseguenza della limitazione del movimento legata al dolore.
L’HS di livello I è la più comune (65%), seguita dal livello II (31%) e dal livello III (4%) [17]. Il punteggio Sartorius registra il numero di noduli infiammatori, ascessi, fistole e aree colpite e assegna dei punti. Un altro sistema di classificazione è l’International Hidradenitis Suppurativa Severity Score System (IHS4). Tutte le lesioni infiammate vengono valutate e sommate, per cui un nodulo infiammato viene contato una volta, un ascesso due volte e una fistola drenante quattro volte. Il totale risulta in una categorizzazione in tre gradi di gravità (lieve, moderata, grave) [50].
| Alto “carico di malattia” I dati empirici dimostrano che la qualità della vita, operazionalizzata utilizzando la Indice di qualità della vita in dermatologia (DLQI), è significativamente compromesso nei pazienti, per cui l’entità del carico varia a seconda della gravità dei sintomi: Il DLQI medio era di 5,77 per il livello I secondo Hurley, 13,1 per il livello II e 20,4 per il livello III. Si tratta di valori elevati, considerando che nella psoriasi da moderata a grave il DLQI è in media di 12-13 [10,11]. Il dolore è stato percepito come il più fastidioso dall’85% dei pazienti con HS, seguito dal gonfiore/infiammazione e dalla tenerezza [12]. Le menomazioni possono comportare l’impossibilità di lavorare, e i cattivi odori e le macchie sui vestiti causati dagli ascessi purulenti possono portare alla stigmatizzazione sociale . |
Fattori di rischio e comorbidità associati all’HS
La gravità e il decorso dell’HS sono correlati all’indice di massa corporea (BMI) e, secondo diversi studi, un numero superiore alla media di pazienti con HS sono fumatori (70-90%). Revuz et al. ha trovato un odds ratio ( OR) di 4,42 per i pazienti obesi (BMI >30) e di 12,55 per i fumatori rispetto ai controlli sani [2]. Un altro studio di Miller et al. ha trovato un OR di 6,38 per l’obesità [20]. Il rischio che i pazienti con HS sviluppino il diabete mellito di tipo 2 (OR=5,74) o la sindrome metabolica (OR=3,89) è significativamente aumentato [20]. Nel complesso, la prevalenza dei fattori di rischio cardiovascolare è significativamente aumentata nelle persone con HS rispetto ai soggetti sani .
Per quanto riguarda la progressione dell’HS, i seguenti cinque fattori sono stati associati a un aumento del rischio di progressione dallo stadio Hurley I a II o III in uno studio retrospettivo su 846 persone: sesso maschile, durata della malattia, BMI, anni di fumo e posizione della lesione [22]. Altri fattori scatenanti dell’HS sono l’irritazione meccanica e alcune condizioni di comorbidità (ad esempio, la sindrome dell’ovaio policistico e la depressione) [23–26]. Alcuni studi riportano un aumento dei tassi di comorbilità dell’HS e di altre malattie infiammatorie. Oltre alla sindrome dell’ovaio policistico, questo vale anche per la malattia infiammatoria intestinale e il pioderma gangraenosum .
Eziopatogenesi multifattoriale e disregolazione del sistema immunitario
La predisposizione genetica, i fattori legati allo stile di vita (in particolare il fumo e l’obesità), i componenti ormonali e i processi immunologici disfunzionali sono coinvolti sia nello sviluppo che nel mantenimento della malattia [51,65]. Più recentemente, è stata postulata l’ipotesi che l’interazione di fattori endogeni ed esogeni provochi l’attivazione del sistema immunitario innato [49]. Questo provoca un’infiammazione perifollicolare, nonché ipercheratosi e iperplasia dell’epitelio follicolare, in particolare nell’area dell’infundibolo, che porta alla chiusura follicolare [52]. La dilatazione e la rottura del follicolo pilifero inducono un’intensa risposta immunitaria infiammatoria associata al reclutamento di neutrofili, macrofagi, cellule B, cellule Th1 e Th17 nella pelle, che porta a noduli infiammatori o alla formazione di ascessi [51].
Le vie di segnalazione proinfiammatorie contribuiscono in modo significativo allo sviluppo dell’HS. Nella pelle lesionata dei pazienti con HS, è stata dimostrata l’aumentata produzione di un gran numero di citochine proinfiammatorie, come l’interleuchina (IL)-1, l’IL-6, l’IL-10, l’IL-12, l’IL-17, l’IL-23, l’IL-32, l’IL-36 e il TNF-α) come indicazione di una disregolazione immunologica [51,53–56]. Alcune vie sembrano essere particolarmente importanti per la patogenesi dell’HS [53]. Diversi studi hanno dimostrato che la secrezione di IL-23 e IL-12 porta a una risposta immunitaria dominante Th17 e all’iperplasia cheratinocitica [56,58]. L’IL-23 induce le cellule T helper che producono IL-17, che si infiltrano nel derma nelle lesioni HS [59]. È noto che la famiglia IL-17 è coinvolta nella patogenesi di varie malattie autoimmuni. L’IL-17 svolge anche un ruolo essenziale nella difesa dell’ospite contro i batteri e i funghi extracellulari ed è stato dimostrato che aumenta l’espressione dei peptidi antimicrobici/alarmine della pelle [58]. Il blocco dell’IL-17 sembra quindi essere un valido approccio terapeutico per l’HS [58].
Con il progredire dell’hidradenitis suppurativa, nel tessuto si riscontra un aumento dei livelli di TNF, IL-1β, IL-17, caspasi-1 e IL-10, che porta al reclutamento di neutrofili, mastociti e monociti, che si differenziano in macrofagi e cellule dendritiche [59–61,65]. Recenti scoperte indicano anche che un meccanismo autoinfiammatorio è coinvolto nell’HS: la pelle dell’HS, ad esempio, mostra un’aumentata formazione di reti extracellulari di neutrofili (NET) [65]. Le risposte immunitarie agli antigeni legati ai neutrofili e ai NET sono state associate a un aumento della disregolazione immunitaria e dell’infiammazione [62].
La cicatrizzazione del tessuto precedentemente infiammato può portare a limitazioni del movimento a lungo termine [58–60]. Lo sviluppo delle cicatrici e dei tratti sinusali è associato al fattore di crescita trasformante (TGF)-β e alla molecola di adesione ICAM-1 [58]. La superinfezione batterica delle lesioni consolidate può contribuire al mantenimento dell’infiammazione cronica [61]. Le principali specie batteriche isolate nelle lesioni HS comprendono i cocci Gram-positivi, tra cui Staphylococcus aureus e Streptococcus species, gli stafilococchi coagulasi-negativi, Proteus mirabilis e i batteri anaerobi misti [61]. Staphylococcus epidermidis e Corynebacterium spp. nonché batteri atipici come Proteus mirabilis, Escherichia coli, Enterobacter aerogens ed Enterococcus faecalis sono stati rilevati in campioni microbiologici provenienti da linfonodi drenanti in pazienti affetti da HS a seguito di escissione chirurgica [64].
Trattamento multimodale – anti-IL-17A-Ak come nuova strategia terapeutica
Le raccomandazioni terapeutiche svizzere pubblicate nel 2017 fanno riferimento a diverse modalità di malattia o punti di partenza per il trattamento, per cui le opzioni terapeutiche raccomandate sono adattate alla gravità dell’HS (Tabella 2) [34,35]. In termini di opzioni terapeutiche, l’autorizzazione di Swissmedic di quest’anno dell’inibitore dell’IL-17-A secukinumab rappresenta un’importante espansione dello spettro terapeutico.
Farmacoterapia: l’algoritmo di trattamento raccomandato si basa in primo luogo sulla scala di gravità Hurley (I-III) e in secondo luogo sulle caratteristiche specifiche della malattia.
- Preparati topici: i disinfettanti topici (ad esempio, triclosan, bituminosolfonato di ammonio) o gli antibiotici topici (ad esempio, la soluzione di clindamicina) sono consigliati per prevenire la sovrainfezione batterica e ridurre l’infiammazione e la macerazione [30,34,35]. I noduli infiammati possono essere trattati con steroidi intralesionali [34,35].
- Antibiotici sistemici: Se gli agenti topici non sono sufficienti, di solito vengono somministrati antibiotici sistemici. Si suggerisce la doxiciclina (50-200 mg al giorno, per 3-6 mesi) o la rifampicina in combinazione con la clindamicina (300 mg due volte al giorno, per un massimo di tre mesi); il gluconato di zinco (3× 30 mg, al giorno) può essere aggiunto come combinazione [31,34,35].
- Terapeutici sistemici convenzionali e biologici: Secukinumab o adalimumab possono essere prescritti nel dosaggio raccomandato per l’HS attivo da moderato a grave che ha risposto in modo inadeguato alla terapia antibiotica sistemica [72]. In alternativa, possono essere utilizzati acitretina sistemica (0,2-0,5 mg/kg al giorno), dapsone (50-150 mg al giorno), metformina, ciclosporina A o steroidi sistemici [34,35]. L’efficacia viene solitamente valutata negli studi clinici utilizzando l’Hidradenitis Suppurativa Clinical Response Score (HiSCR) [48]. La HiSCR è definita come una riduzione ≥50% delle lesioni infiammatorie (somma di ascessi e noduli infiammatori) e nessun aumento del numero di ascessi e fistole secernenti rispetto alla situazione iniziale [48].
- Antidolorifici: il dolore può derivare da noduli e ascessi infiammati, ma anche cicatrici, cheloidi, ulcerazioni aperte, linfedema, ragadi anali o artrite possono causare dolore. Oltre ai preparati topici (ad esempio, lidocaina e agenti antinfiammatori), nella letteratura specialistica sono menzionati gli agenti antinfiammatori non steroidei sistemici, gli anticonvulsivanti atipici (ad esempio, gabapentin o pregabalin) e gli inibitori della ricaptazione della serotonina/norepinefrina [70,71]. La duloxetina si è dimostrata efficace per la depressione in comorbilità [71].
Misure chirurgiche ed escissione laser: l’ escissione locale di singole lesioni è raccomandata solo nei casi localizzati e ben circoscritti di Hurley I e II [1]. In tutti gli altri casi, si deve prendere in considerazione un’ampiaescissione con bisturi olaser CO2 della pelle, comprese parti del tessuto adiposo dell’intera area interessata [1]. L’esatto piano di trattamento chirurgico – come la terapia convenzionale – deve essere chiarito individualmente e in consultazione con il paziente. La fisioterapia è indicata fino alla completa guarigione della ferita.
Fattori dello stile di vita: per promuovere la qualità di vita dei pazienti con HS, i legami tra i fattori dello stile di vita e l’HS dovrebbero essere enfatizzati come parte dell’educazione del paziente. Si ritiene che la nicotina induca l’iperplasia epidermica e la congestione follicolare [67]. Inoltre, i pazienti affetti da HS presentano già un rischio cardiovascolare elevato, che viene aggravato dal fumo [68]. Oltre al fumo, anche l’obesità è associata alla gravità della malattia. C’è un consenso generale sul fatto che la cessazione del fumo e la riduzione del peso siano misure importanti per contrastare un’esacerbazione della malattia [2,66]. Le linee guida internazionali affermano esplicitamente che la riduzione del peso può avere un effetto positivo sulla gravità della malattia nelle persone in sovrappeso con HS e che i pazienti dovrebbero essere consigliati a tal fine [68]. Inoltre, si consiglia di indossare abiti larghi per evitare le sollecitazioni meccaniche [68].
Supporto psicosociale: l ‘HS ha un impatto negativo sulla qualità della vita e può portare a disturbi depressivi e alla disintegrazione sociale. Esistono prove empiriche che i pazienti affetti da HS sperimentano un alto livello di angoscia e si consiglia di includere non solo i sintomi fisici, ma anche le dimensioni psicologiche della malattia nella gestione della malattia [68,69]. In uno studio pubblicato nel 2019, che includeva 110 pazienti affetti da HS (età media 38±12 anni; 61 donne, 49 uomini), sono state trovate correlazioni significative tra lo Skindex-29 e il punteggio Sartorius (sintomi: p=0,024; emozioni: p=0,019; stato funzionale: p=0,002) [69]. Inoltre, la VAS per il dolore era correlata in modo significativo con il DLQI (p=0,000) e il BMI era associato al punteggio Sartorius (p=0,038) [69].
Messaggi da portare a casa
- L’idradenite suppurativa (HS) è una malattia infiammatoria cronica della pelle con noduli ricorrenti, ascessi e formazione di fistole e cicatrici nelle regioni del corpo con ghiandole apocrine (ascella, inguine, regione perianale e perineale). L’anamnesi familiare è positiva in circa il 40% dei casi. Le donne sono colpite più spesso degli uomini.
- I fattori di rischio e le comorbidità più importanti includono il fumo, l’obesità e la sindrome metabolica. Tuttavia, anche le spondiloartropatie e le malattie infiammatorie croniche intestinali (IBD) sono rappresentate con una frequenza superiore alla media in questa popolazione di pazienti.
- La patogenesi non è ancora stata completamente chiarita; si presume che ci siano interazioni multifattoriali. Tra l’altro, è stata rilevata una forte espressione di citochine pro-infiammatorie nelle lesioni cutanee dei pazienti HS. Questo è un punto di partenza per le nuove opzioni di terapia sistemica, come i biologici.
- In genere si raccomanda un approccio terapeutico multimodale. Oltre ai fattori legati allo stile di vita e ai preparati topici, si ricorre a terapie sistemiche, interventi chirurgici e altri metodi a seconda della gravità. Oltre ad adalimumab, anche il secukinumab è disponibile come biologico in Svizzera dal 2023. La gestione del dolore e l’inclusione degli aspetti psicosociali sono misure di accompagnamento importanti.
Letteratura:
- Zouboulis CC, et al: Linea guida S1 per il trattamento dell’hidradenitis suppurativa/acne inversa (numero ICD-10 L73.2) (in tedesco). JDDG 2012;10(suppl 5): S1-S31.
- Revuz JE, et al: Prevalenza e fattori associati all’hidradenitis suppurativa: risultati di due studi caso-controllo. JAAD 2008;59: 596-601.
- Jemec GB, Heidenheim M, Nielsen NH: La prevalenza dell’hidradenitis suppurativa e le sue potenziali lesioni precursori. JAAD 1996;35: 191-194.
- Woodruff CM, Charlie AM, Leslie KS: Hidradenitis suppurativa: una guida per il medico professionista. Mayo Clin Proc 2015; 90: 1679-1693.
- Hunger RE, et al: Il recettore Toll-like 2 è altamente espresso nelle lesioni dell’acne inversa e colocalizza con il recettore della lectina di tipo C. BJD 2008; 158: 691-697.
- Jemec GB, Hansen U: Istologia dell’hidradenitis suppurativa. JAAD 1996; 34: 994-999.
- Schlapbach C, et al: Espressione del percorso IL-23/Th17 nelle lesioni dell’hidradenitis suppurativa. JAAD 2011; 65: 790-798.
- von Laffert M, et al: Hidradenitis suppurativa (acne inversa): eventi infiammatori precoci nei follicoli terminali e nell’epidermide interfollicolare. Exp Dermatol 2010;19: 533-537.
- Margesson LJ, Danby FW: Hidradenitis suppurativa. Le migliori pratiche e la ricerca. Clin Obstet Gynaecol 2014; 28: 1013-1027.
- Alavi A: Hidradenitis suppurativa: demistificare una malattia cronica e debilitante. JAAD 2015; 73(5 suppl 1): S1-S2.
- Revicki D, et al: Impatto del trattamento con adalimumab sulla qualità di vita correlata alla salute e su altri risultati riferiti dai pazienti: risultati di uno studio randomizzato controllato di 16 settimane in pazienti con psoriasi a placche da moderata a grave. BJD 2008;158: 549-557.
- Kimball A, et al: Le esperienze dei pazienti con l’hidradenitis suppurativa: uno studio qualitativo dei sintomi e degli impatti. JAAD 2013; 68: AB57.
- Kimball AB, et al: Adalimumab per il trattamento dell’hidradenitis suppurativa da moderata a grave: uno studio parallelo randomizzato. Ann Intern Med 2012;157: 846-855.
- Jemec GB: Pratica clinica. Hidradenitis suppurativa. NEJM 2012;366: 158-164.
- Saunte DM, et al: Il ritardo diagnostico nell’hidradenitis suppurativa è un problema globale. BJD 2015;173: 1546-1549.
- Zouboulis CC, et al: Hidradenitis suppurativa/acne inversa: criteri di diagnosi, valutazione della gravità, classificazione e valutazione della malattia. Dermatologia 2015;231: 184-190.
- Revuz J: Hidradenitis suppurativa. JEADV 2009; 23: 985-998.
- Sartorius K, et al: Punteggio oggettivo dell’hidradenitis suppurativa che riflette il ruolo del fumo di tabacco e dell’obesità. BJD 2009; 161: 831-839.
- Sartorius K, et al: Suggerimenti per variabili di esito uniformi quando si riportano gli effetti del trattamento nell’hidradenitis suppurativa. BJD 2003; 149: 211-213.
- Miller IM, et al: Associazione tra sindrome metabolica e hidradenitis suppurativa. JAMA Dermatol 2014;150: 1273-1280.
- Tzellos T, et al: Fattori di rischio per le malattie cardiovascolari nei pazienti con hidradenitis suppurativa: una revisione sistematica e una meta-analisi di studi osservazionali. BJD 2015; 173: 1142-1155.
- Schrader AM, et al: Hidradenitis suppurativa: uno studio retrospettivo su 846 pazienti olandesi per identificare i fattori associati alla gravità della malattia. JAAD 2014; 71: 460-467.
- Boer J, Nazary M, Riis PT: Il ruolo dello stress meccanico nell’hidradenitis suppurativa. Dermatol Clin 2016; 34: 37-43.
- Nazary M, et al: Patogenesi e farmacoterapia dell’hidradenitis suppurativa. Eur J Pharmacol 2011; 672: 1-8.
- van der Zee HH, et al: L’associazione tra l’hidradenitis suppurativa e la malattia di Crohn: alla ricerca del legame patogeno mancante. J Invest Dermatol 2016;136: 1747-1748.
- Shavit E, et al: Comorbilità psichiatriche in 3.207 pazienti con hidradenitis suppurativa. JEADV 2015;29: 371-376.
- van der Zee HH, et al: Hidradenitis suppurativa e malattia infiammatoria intestinale: sono associate? Risultati di uno studio pilota. BJD 2010; 162: 195-197.
- Hsiao JL, et al: Hidradenitis suppurativa e pyoderma gangrenosum concomitante: una serie di casi e una revisione della letteratura. Arch Dermatol 2010; 146: 1265-1270.
- Kraft JN, Searles GE: Hidradenitis suppurativa in 64 pazienti di sesso femminile: studio retrospettivo di confronto tra antibiotici orali e terapia antiandrogena. J Cutan Med Surg 2007; 11: 125-131.
- Jemec GB, Wendelboe P: Clindamicina topica rispetto alla tetraciclina sistemica nel trattamento dell’hidradenitis suppurativa. JAAD 1998; 39: 971-974.
- Gener G, et al: Terapia combinata con clindamicina e rifampicina per l’hidradenitis suppurativa: una serie di 116 pazienti consecutivi. Dermatologia 2009;219: 148-154.
- Kimball AB, et al: Due studi di fase 3 sull’adalimumab per l’hidradenitis suppurativa. NEJM 2016;375: 422-434.
- Boer J, Nazary M: Risultati a lungo termine della terapia con acitretina per l’hidradenitis suppurativa. Anche l’acne inversa è un termine improprio? BJD 2011; 164: 170-175.
- Hunger RE, et al: Raccomandazioni pratiche svizzere per il trattamento dell’hidradenitis suppu-rativa (acne inversa). Compass Dermatol 2019; 7 (1): 8-13.
- Hunger RE, et al: Raccomandazioni pratiche svizzere per la gestione dell’Hidradenitis Suppurativa/Acne inversa. Dermatologia, 2017, 233 (2-3).
- van der Zee HH, et al: Il trattamento con adalimumab (anti-TNF-α) dell’hidradenitis suppurativa migliora l’infiammazione cutanea: uno studio in situ ed ex vivo. BJD 2012; 166: 298-305.
- Wolk K, et al: La carenza di IL-22 contribuisce a una malattia infiammatoria cronica: meccanismi patogenetici nell’acne inversa. J Immunol 2011, 186: 1228-1239.
- Högenauer C, et al.: Gestione interdisciplinare delle malattie immunomediate – una prospettiva austriaca. Journal of Gastroenterological and Hepatological Diseases 2019; 17: 108-124.
- Fimmel S, Zouboulis CC: Comorbilità dell’hidradenitis suppurativa (acne inversa). Dermatoendocrinol 2010; 2(1): 9-16.
- Sabat R, et al: Aumento della prevalenza della sindrome metabolica nei pazienti con acne inversa. PloS One 2012; 7(2):e31810.
- Gold DA, et al: La prevalenza della sindrome metabolica nei pazienti con hidradenitis suppurativa. JAAD 2014; 70(4): 699-703.
- Deckers IE, et al: La malattia infiammatoria intestinale è associata all’hidradenitis suppurativa: risultati di uno studio trasversale multicentrico. JAAD 2017; 76(1): 49-53.
- Shlyankevich J, et al: L’Hidradenitis suppurativa è una malattia sistemica con un carico di comorbilità sostanziale: un’analisi caso-controllo verificata da una cartella clinica. JAAD 2014; 71(6): 1144-1150.
- Richette P, et al: Hidradenitis suppurativa associata a spondiloartrite – risultati di uno studio prospettico nazionale multicentrico. J Rheumatol 2014; 41(3): 490-494.
- Esmann S, Jemec GB: Impatto psicosociale dell’hidradenitis suppurativa: uno studio qualitativo. Acta Derm Venereol 2011; 91: 328-332.
- Hurley HJ: Iperidrosi ascellare, bromidrosi apocrina, hidradenitis suppurativa e pemfigo benigno familiare: approccio chirurgico. In: Roenigk RK, Roenigk HH, Jr, eds. Chirurgia dermatologica: principi e pratica. 2ª ed. New York: Marcel Dekker 1996: 623-645.
- Kokolakis G, et al: La diagnosi ritardata di Hidradenitis Suppurativa e il suo effetto sui pazienti e sul sistema sanitario. Dermatologia 2020; 236(5): 421-430.
- Kimball AB, et al: Valutare la validità, la reattività e la significatività della Risposta Clinica dell’Hidradenitis Suppurativa (HiSCR) come endpoint clinico per il trattamento dell’hidradenitis suppurativa. Br J Dermatol 2014; 171(6): 1434-1442.
- Kurzen H, et al: Quali sono le cause dell’hidradenitis suppurativa? Exp Dermatol 2008; 17(5): 455-456; discussione 457-472.
- Zouboulis CC, et al; European Hidradenitis Suppurativa Foundation Investigator Group. Sviluppo e validazione dell’International Hidradenitis Suppurativa Severity Score System (IHS4), un nuovo sistema di punteggio dinamico per valutare la gravità dell’HS. Br J Dermatol 2017; 177(5): 1401-1409.
- Vossen A, van der Zee HH, Prens EP: Hidradenitis suppurativa: una revisione sistematica che integra i percorsi infiammatori in un modello patogenetico coesivo. Front Immunol 2018; 9: 2965.
- Von Laffert M, et al: Hidradenitis suppurativa/acne inversa: iperplasia epiteliale bilocata con sequele molto diverse. BJD 2011; 164: 367-371.
- Schuch A, Absmaier-Kijak M, Volz T: Acne inversa/Hidradenitis suppurativa – Von der Pathogenese zur Therapie. Act Dermatol 2019; 45: 277-287.
- Melnik BC, et al: Squilibrio tra cellule T helper 17 e cellule T regolatorie nell’hidradenitis suppurativa/acne inversa: il legame con la dissezione del follicolo pilifero, l’obesità, il fumo e le comorbidità autoimmuni. BJD 2018; 179: 260-272.
- Van der Zee HH, et al: Livelli elevati di fattore di necrosi tumorale (TNF)-α interleuchina (IL)-1β e IL-10 nella pelle dell’hidradenitis suppurativa: un razionale per colpire TNF-α e IL-1β. BJD 2011; 164: 1292-1298.
- Zouboulis CC, et al: Cosa causa l’hidradenitis suppurativa? 15 anni dopo. Exp Dermatol 2020; 29: 1154-1170.
- Sabat R, et al: Hidradenitis suppurativa. Nat Rev Dis Prim 2020; 6: 18.
- Thomi R, et al: Associazione tra Hidradenitis Suppurativa e fenotipi T Helper 1/T Helper 17: Un’analisi della mappa semantica. JAMA Dermatol 2018; 154: 592.
- Wieland CW, et al: Marcatore mieloide S100A8/A9 e marcatore linfocitario, recettore solubile dell’interleuchina 2: biomarcatori dell’attività della malattia dell’hidradenitis suppurativa? Br J Dermatol 2013; 168: 1252-1258.
- 60 Saunte DML, Jemec GBE: Hidradenitis Suppurativa: progressi nella diagnosi e nel trattamento. JAMA 2017; 318: 2019-2032.
- Gierek M, et al: Hidradenitis suppurativa: studio batteriologico nel trattamento chirurgico. Postep. Dermatol Alergol 2022; 39: 1101-1105.
- Jastrząb B, et al: La prevalenza della parodontite e la valutazione del microbiota orale nei pazienti con Hidradenitis Suppurativa: uno studio descrittivo trasversale. J Clin Med 2022; 11: 7065.
- Ganzetti G, et al: Malattia parodontale: una manifestazione orale della psoriasi o un reperto occasionale? Drug Dev. Res. 2014, 75, S46-S49.
- 64 Vaienti S, et al: Coinvolgimento dei linfonodi nell’idradenite suppurativa ascellare: uno studio clinico, ecografico e batteriologico condotto durante la chirurgia radicale. J Clin Med 2021; 10: 1433.
- 65 Molinelli E, et al: Nuove conoscenze sul meccanismo molecolare della patologia e sui trattamenti immunomodulatori dell’Hidradenitis Suppurativa. Int J Mol Sci 2023; 24(9): 8428. www. mdpi.com/1422-0067/24/9/8428,(ultimo accesso 16/10/2023)
- Brajac I, et al: Smjernice za Dijagnostiku i Liječenje Gnojnog Hidradnitisa (Hidradenitis Suppurativa) Liječ Vjesn 2017; 139: 247-253.
- Hana A, et al: Significato funzionale dell’acetilcolina non neuronale negli epiteli cutanei. Life Sci 2007; 80: 2214-2220.
- Ingram JR, et al. : Linee guida della British Association of Dermatologists per la gestione dell’hidradenitis suppurativa (acne inversa) 2018. British Journal of Dermatology 2019; 180 (5): 1009-1017.
- Frings VG, et al. Valutare il carico psicologico dei pazienti con hidradenitis suppurativa. Eur J Dermatol 2019; 29: 294-301.
- Ballard K, Shuman VL: Hidradenitis Suppurativa. [Updated 2023 Apr 17]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 gennaio.
- Fernandez JM, et al: Modalità di gestione del dolore per l’hidradenitis suppurativa: un sondaggio tra i pazienti. J Dermatolog Treat 2022; 33(3): 1742-1745.
- Swissmedic: Informazioni sui medicinali, www.swissmedicinfo.ch,(ultimo accesso 16.10.2023)
- Scala E, et al: Hidradenitis Suppurativa: dove siamo e dove stiamo andando. Cells 2021, 10, 2094. www.mdpi.com/2073-4409/10/8/2094#,(ultimo accesso 16 ottobre 2023).
Immagine di copertina: Dr Thomas Brinkmeyer, wikimedia. Hurley fase II
PRATICA DERMATOLOGICA 2023; 33(5): 6-11