Negli ultimi anni si è enormemente ampliata la gamma delle farmacoterapie disponibili per il trattamento dell’epilessia. Oggi è possible effettuare una scelta più mirata e una prioritizzazione in base a criteri quali la forma di epilessia, le comorbidità e le caratteristiche individuali del paziente. La mancanza o il basso livello di induzione enzimatica nei medicamenti antiepilettici di seconda e terza generazione evita gli effetti collaterali un tempo consueti come osteoporosi, polineuropatie e sindromi metaboliche.
Per la profilassi degli attacchi epilettici, dal 1990 ad oggi sono stati resi disponibili 20 nuovi medicinali che si differenziano non solo in termini di modalità d’azione ma anche dal punto di vista del dosaggio, della tendenza all’interazione e degli effetti collaterali tipici. Il loro impiego mirato richiede, da un lato, maggiori conoscenze da parte dell’utilizzatore, dall’altro consente una scelta sempre più orientata alle esigenze individuali del paziente. Il presente articolo fornisce indicazioni per la scelta appropriata dei medicamenti antiepilettici destinati a gruppi di pazienti in base all’età, al sesso e alle comorbilità.
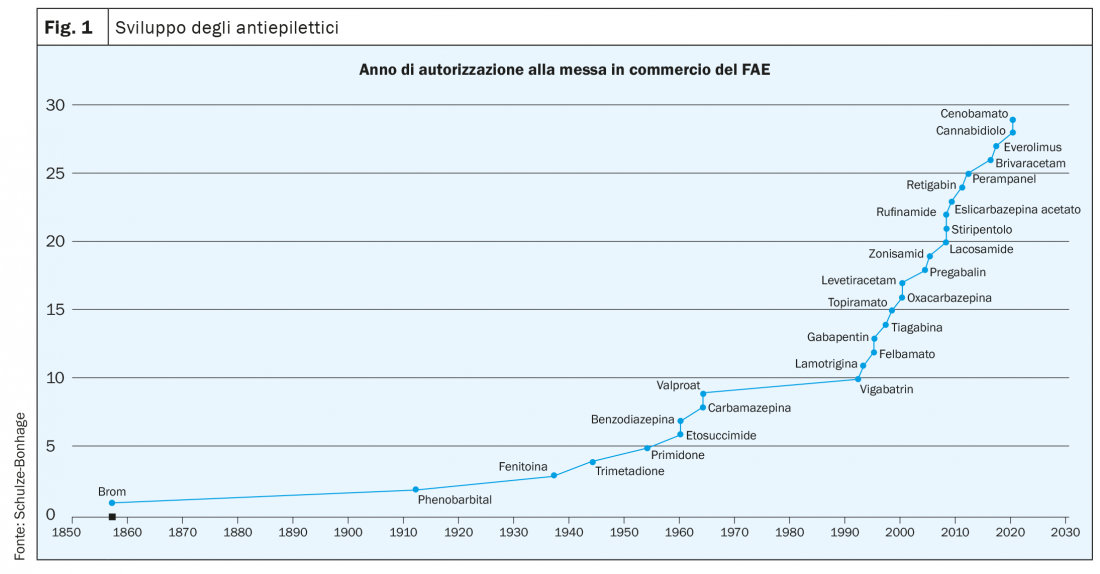
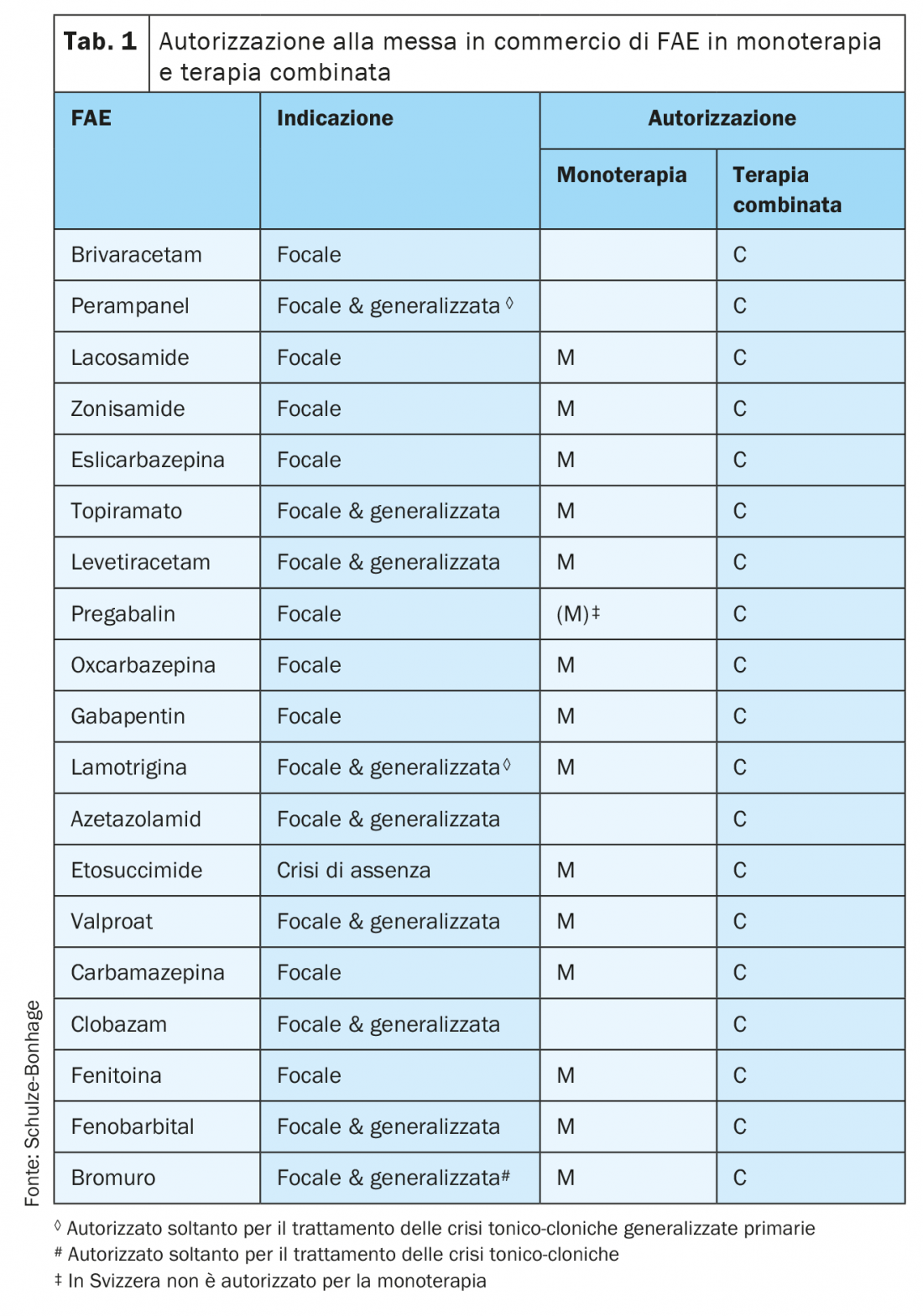
A partire dall’introduzione dei medicamenti antiepilettici di seconda generazione, negli ultimi 30 anni si è enormemente ampliata la gamma delle farmacoterapie disponibili per il trattamento dell’epilessia (fig. 1). Pur non avendo ancora risolto il problema della farmacoresistenza in circa un terzo dei pazienti affetti da epilessia, quest’ampliamento ha consentito una scelta più mirata e una prioritizzazione in base a criteri quali la forma di epilessia, le comorbidità e le caratteristiche individuali del paziente (sesso, età, esigenze professionali) (tab. 1).
Sindromi epilettiche e terapia anticonvulsiva
Tra i principali gruppi di epilessie trattate in età adulta rientrano, da un lato, le epilessie strutturali con origine focale (o multifocale) delle crisi, e dall’altro le epilessie di presunta origine genetica con insorgenza delle crisi generalizzata, cioè che interessa precocemente entrambi gli emisferi. Più del 60% delle epilessie in età adulta sono classificate come focali; in tale gruppo la percentuale di pazienti con controllo incompleto delle crisi supera il 40%. Per questo i nuovi medicamenti antiepilettici vengono messi a punto prevalentemente con l’indicazione del trattamento delle epilessie focali e relative crisi.
Tra i nuovi medicamenti sviluppati nell’ultimo decennio per il trattamento delle epilessie focali si annoverano brivaracetam, eslicarbazepina acetato, perampanel, lacosamide e più recentemente cenobamato*. Brivaracetam ed eslicarbazepina acetato sono medicamenti antiepilettici di terza generazione, risultanti dal coerente sviluppo di precedenti sostanze. Il brivaracetam è un ulteriore sviluppo di terza generazione del piracetam e del levetiracetam, possiede una maggiore efficacia specifica al punto di insorgenza e la sua tollerabilità è stata migliorata in particolare per quanto riguarda gli effetti collaterali psichiatrici. -L’eslicarbazepina acetato è un profarmaco risultante dallo sviluppo della carbamazepina e dell’oxcarbazepina, caratterizzato da un uso più selettivo di un enantiomero e da una farmacocinetica notevolmente migliorata che consente l’impiego in un’unica dose senza picchi plasmatici elevati. Anche la lacosamide ha una modalità d’azione modificata relativamente ai canali del sodio e quindi rientra nella categoria dei bloccanti dei canali del sodio con un potenziale d’interazione particolarmente ridotto. Il perampanel è un farmaco di nuovo sviluppo con i subrecettori del glutammato come bersaglio, il che amplia la gamma delle modalità d’azione. Infine, il cenobamato combina in un’unica sostanza due meccanismi d’azione: il blocco dei canali del sodio e l’incremento dell’inibizione GABAergica (tab. 2).
* attualmente non ancora autorizzato in Svizzera
Come utilizzare in modo proficuo questa molteplicità di medicamenti antiepilettici nei singoli pazienti?
In alcuni Paesi, per certificare l’esistenza di un valore aggiunto si richiede, oltre alla prova di efficacia ottenuta in studi controllati con placebo, anche un’effettiva superiorità dimostrata tramite comparazione diretta. Tali studi non soddisfano però i requisiti internazionali per gli studi finalizzati all’autorizzazione, quindi non sono solitamente disponibili; inoltre gli esiti delle comparazioni dirette, almeno negli studi brevi, dipendono fortemente dai parametri di studio selezionati (velocità di titolazione, dosi target).
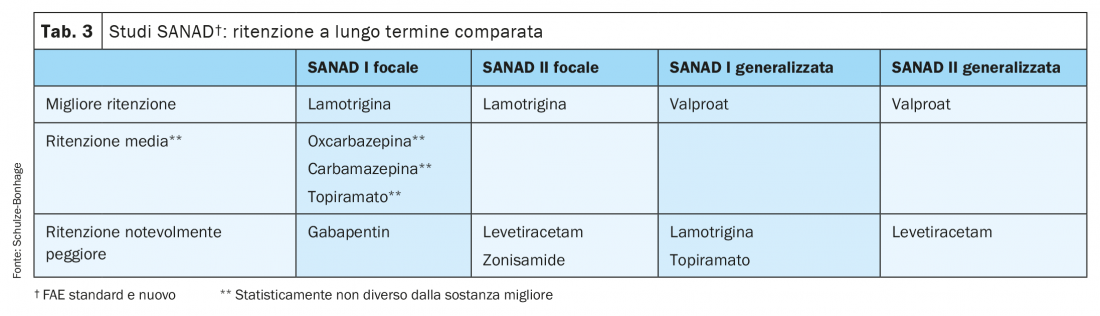
Le più importanti informazioni comparative riguardo all’efficacia e tollerabilità delle monoterapie scaturiscono dagli studi SANAD effettuati in Gran Bretagna (tab. 3). Qui, dopo randomizzazione della sostanza di trattamento ma trattamento aperto con dosaggio libero, è stato registrato quale parametro di effettivo risultato pratico il tasso di ritenzione su un arco temporale pluriennale; il tasso di ritenzione rileva aspetti sia di efficacia che di adeguata tollerabilità a lungo termine.
Il primo studio SANAD ha così evidenziato per la prima volta, in un gruppo di grandi dimensioni con una selezione corrispondente alla pratica clinica, la superiorità della lamotrigina e l’inferiorità del gabapentin; anche l’oxcarbazepina ha dato buoni risultati mentre quelli del topiramato sono stati peggiori. Nello studio SANAD II di recente pubblicazione la lamotrigina si è confrontata con il levetiracetam e la zonisamide. Anche in questo caso la lamotrigina ha dato i migliori risultati, sostanzialmente grazie alla sua tollerabilità che è spesso molto buona; in confronto il levetiracetam, spesso favorito, ha prodotto in particolare effetti collaterali molto più frequenti di tipo psichiatrico, come depressione e irritabilità. Nel complesso vi sono quindi buone ragioni per optare per la lamotrigina e oxcarbazepina per la monoterapia delle epilessie focali.
Le terapie delle epilessie generalizzate presentano diversi livelli di efficacia
Mentre nel trattamento delle epilessie focali i diversi livelli di efficacia sono graduali e di regola sono altri aspetti a determinare la scelta di un dato farmaco, nella terapia delle epilessie generalizzate si riscontra una chiara gerarchia di efficacia: il valproato si è dimostrato nettamente superiore a lamotrigina, levetiracetam e topiramato in un’ampia serie di studi, ivi compresi entrambi gli studi SANAD. L’etosuccimide può essere considerata altrettanto efficace solo nel trattamento delle crisi di assenza.
L’esempio del valproato mostra tuttavia con enorme chiarezza che l’efficacia è solo uno dei criteri per la scelta individuale del farmaco, e questo perché gli effetti collaterali del valproato sono molteplici e rilevanti per i pazienti trattati. Tali effetti indesiderati comprendono: aumento di peso spesso persistente e spesso oltre i 5 kg, sindrome metabolica, sindrome delle ovaie policistiche, trombocitopenia, encefalopatia, coagulopatia/disturbi della coagulazione, patologie ossee, caduta dei capelli, tremore; inoltre rischio notevolmente maggiore di teratogenicità e rischio di disabilità intellettiva del nascituro in caso di esposizione durante la gravidanza. Molti di questi rischi non vengono affatto evidenziati dai risultati degli studi di breve durata (i consueti studi trimestrali) e sono scarsamente evidenti anche nei parametri risultanti dagli studi della durata di un anno o più. Nonostante il fatto che gli studi mostrino una chiara preferenza per il valproato, almeno nelle donne in età fertile quest’ultimo, tenendo conto dei rischi e degli effetti collaterali che comporta, vale quale farmaco di ultima scelta solo se le altre opzioni disponibili non sortiscono alcun risultato.
Scelta personalizzata dei medicamenti antiepilettici
Anziché adottare uno schema terapico generalizzato si prende quindi in considerazione l’individualità del paziente. Alcuni degli aspetti importanti ai fini della scelta del farmaco sono l’età, il sesso, la natura delle crisi e la compliance (fig. 2).
Il ruolo dell’eziologia
L’eziologia dell’epilessia è un fattore importante ai fini della possibilità di liberare completamente i pazienti dalle crisi. Il rischio di farmacoresistenza, ad esempio, è particolarmente elevato nei casi di malformazioni dello sviluppo corticale, in particolare la displasia corticale o tubera, e nella sclerosi ippocampale. L’imaging riveste quindi un ruolo fondamentale già nell’accertamento precoce delle reali possibilità di trattamento ed eventualmente di proficui trattamenti precoci non farmacologici, quali ad es. la chirurgia dell’epilessia.
In caso di epilessie difficili da trattare, i trattamenti combinati con medicamenti antiepilettici particolarmente potenti (come topiramato, perampanel o cenobamato) sono più frequentemente indicati rispetto, per esempio, ai casi di epilessie vascolari in cui risultano spesso sufficienti le monoterapie con medicamenti antiepilettici quali lamotrigina, eslicarbazepina acetato/oxcarbazepina o pregabalin.
L’attuale sviluppo dei medicamenti orfani mette in particolare evidenza la sindrome epilettica. Da qualche tempo, ad esempio, per la sindrome di Dravet e per la sindrome di Lennox-Gastaut sono disponibili il cannabidiolo e la fenfluramina, mentre vigabatrin, cannabidiolo ed everolimus si sono dimostrati efficaci per la sclerosi tuberosa. Nella sclerosi tuberosa everolimus è un esempio di influenza pionieristica sull’epilettogenesi con finestre temporali prolungate fino al raggiungimento della piena efficacia con una modalità d’azione che per la prima volta è specifica per la patologia.
Natura delle crisi
La decisione riguardante la titolazione di un antiepilettico può essere fortemente influenzata dalla gravità del pregiudizio arrecato al paziente dall’intensità e frequenza delle crisi. Già con la prima dose di pregabalin, levetiracetam e brivaracetam si può ottenere un trattamento efficace, mentre con molti bloccanti dei canali del sodio ad eccezione della lamotrigina tale risultato è raggiungibile entro una settimana; lamotrigina, zonisamide e cenobamato* richiedono invece da molte settimane ad alcuni mesi per giungere a concentrazioni efficaci tollerabili.
* attualmente non ancora autorizzato in Svizzera
Per le serie ad alta frequenza può risultare vantaggiosa la disponibilità di una forma di somministrazione endovenosa, anche se l’incremento della forma orale è solitamente sufficiente. Più precisamente, la disponibilità di un eventuale trattamento endovenoso non dovrebbe portare alla scelta di un farmaco altrimenti non preferenziale (come la fenitoina).
Dosaggio e compliance
La compliance nell’assunzione del regime farmacologico prescritto e l’aderenza costante dei pazienti trattati sono di fondamentale importanza per il successo a lungo termine del trattamento. Le sostanze che devono essere somministrate solo una volta al giorno (eslicarbazepina acetato, perampanel, cenobamato*, a mio parere anche zonisamide o valproato) favoriscono la regolarità di assunzione; se possibile sarebbe bene evitare i protocolli con tripla assunzione giornaliera.
Anche una buona tollerabilità del trattamento è fondamentale. Ciò rappresenta spesso un problema di scarsa entità nelle epilessie che rispondono bene ai bassi dosaggi; laddove vi è la necessità di dosi più elevate e di una politerapia, assumono invece grande importanza la scelta di medicamenti ben tollerati individualmente e la loro appropriata combinazione. Gli effetti collaterali sono percepiti soggettivamente in modi molto diversi; ai fini della cooperazione tra medico e paziente è fondamentale prendere sul serio le indicazioni personali fornite dal secondo.
I dosaggi complessi (ad esempio nel caso della lamotrigina) possono sovraccaricare i pazienti affetti da disabilità intellettive o disturbi della memoria e causare errori nell’assunzione delle dosi target previste. Una strategia concordata è anche di grande importanza per una diminuzione graduale e coordinata dei trattamenti.
Per i pazienti con comprovate difficoltà a seguire i regimi medicamentologici prestabiliti possono essere utili i medicamenti dotati di una lunga emivita (perampanel, zonisamide, eslicarbazepina acetato e valproato) poiché la dimenticanza di una singola dose causa minori fluttuazioni della concentrazione sierica.
Il ruolo dell’età
Secondo tutti i dati disponibili, i medicamenti antiepilettici sono generalmente efficaci a qualsiasi età; tutti i medicamenti sono sempre stati testati negli adulti e poi somministrati con successo anche a pazienti anziani e bambini. Di conseguenza, la FDA si astiene da studi speciali di approvazione per la fascia di età 4–18 anni.
Le specificità legate all’età devono comunque essere prese in considerazione:
- Soprattutto nello stadio prenatale e nel primo anno di vita, la composizione dei recettori dei neurotrasmettitori può differire notevolmente. Per quanto riguarda nella fattispecie i recettori GABA, è noto che gli effetti delle sostanze GABA-ergiche possono essere invertiti con possibili esiti proconvulsivi.
- Nei primi mesi di vita, l’eliminazione epatica di molte sostanze è ritardata, e ciò aumenta il rischio di sintomi di intossicazione da medicamenti prevalentemente eliminati per via epatica.
- In età prescolare e scolare, l’eliminazione renale è invece più rapida rispetto all’età adulta. Si rende quindi opportuno un dosaggio più elevato ed eventualmente una più frequente somministrazione di dosi individuali per raggiungere il livello di efficacia desiderato.
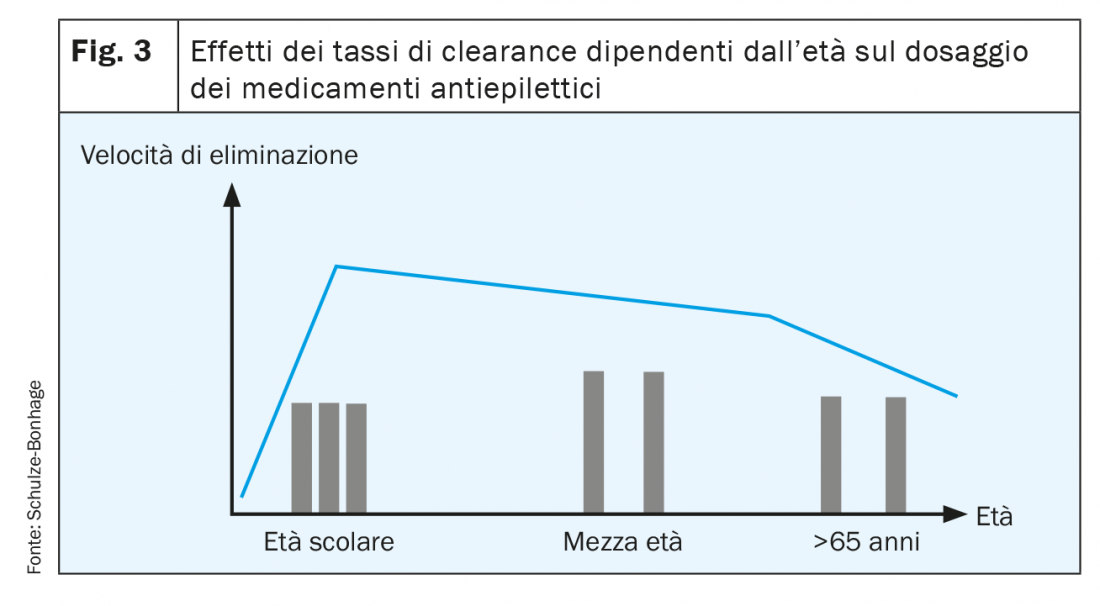
- In età avanzata si riduce soprattutto l’eliminazione per via renale, il che consente l’uso di dosi più basse o di intervalli più lunghi tra le singole dosi (fig. 3).
- In età avanzata aumenta il rischio di effetti collaterali, tra cui quelli riguardanti il metabolismo osseo: se vi è una tendenza generale all’osteoporosi sarebbe opportuno evitare gli induttori enzimatici e il valproato, in quanto sono associati a un rischio molto maggiore di frattura.
- In età avanzata diminuisce la tolleranza degli effetti collaterali, in special modo quelli dei bloccanti dei canali del sodio e dei medicamenti che compromettono la capacità cognitiva. Le differenze fra trattamenti che nella mezza età hanno un peso limitato, in età avanzata diventano invece significative: ad esempio la minore tolleranza della carbamazepina rispetto alla lamotrigina o al gabapentin (fig. 5) [1].
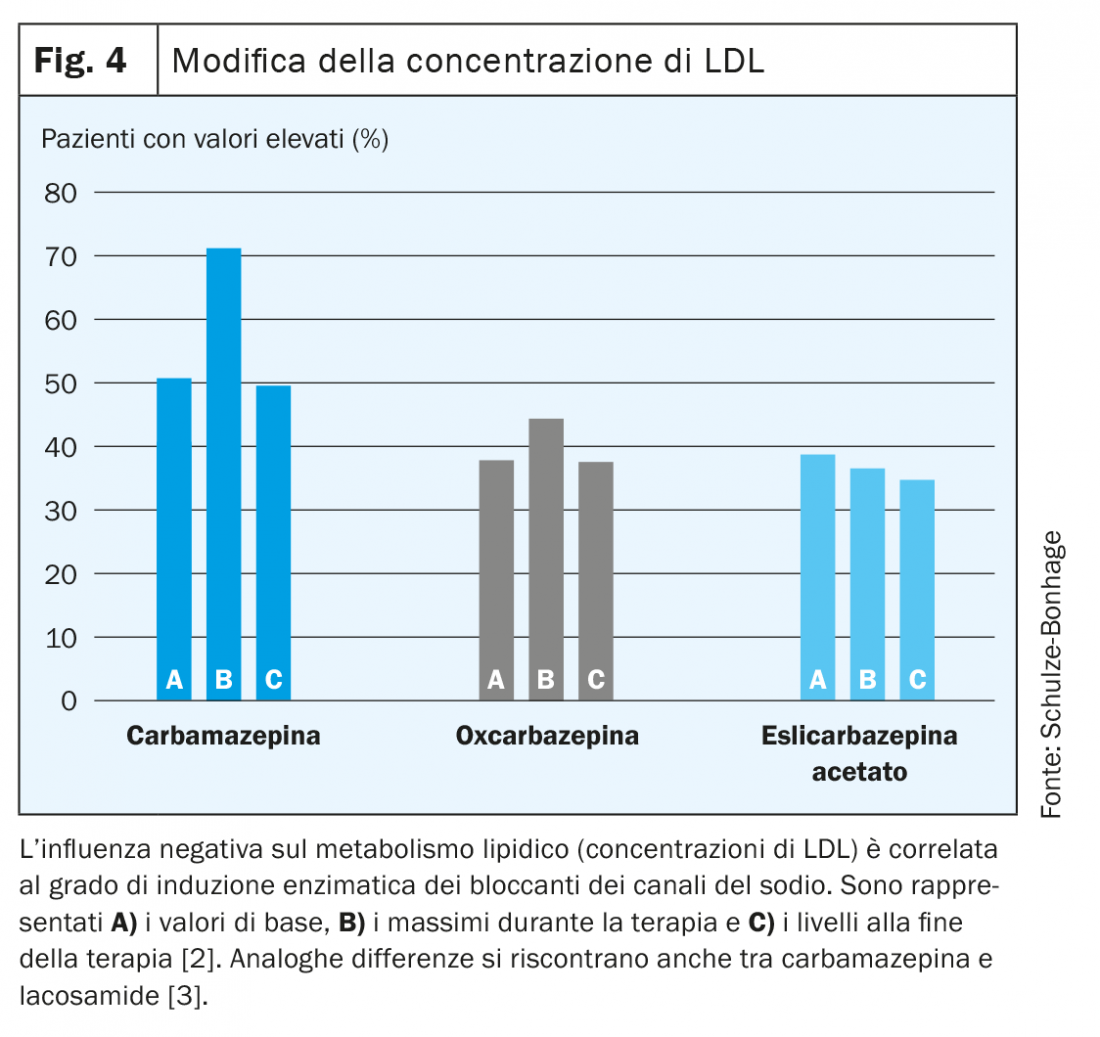
- Infine, nel corso della vita cambia lo spettro eziologico delle epilessie: per le epilessie de novo in età avanzata, che costituiscono ormai la maggior parte dei casi, ciò si traduce in una buona risposta anche a medicamenti meno potenti quali il gabapentin (fig. 4).
Aspetti specifici del trattamento delle donne
Tutti gli anticonvulsivanti affermati mostrano un’efficacia comparabile negli uomini e nelle donne, seppure con differenze nella disponibilità a tollerare determinati effetti collaterali. Ad esempio, le donne rifiutano più degli uomini quei medicamenti che spesso comportano un aumento di peso (come carbamazepina, vigabatrin, pregabalin, valproato) nonché la caduta dei capelli che si verifica durante il trattamento con valproato o le macchie cutanee indotte dalla lamotrigina. Per contro, i forti induttori enzimatici causano spesso negli uomini un’impotenza altamente destabilizzante.
Donne in età fertile: con il menarca, le fluttuazioni della concentrazione di estrogeni influenzano notevolmente la medicamentocinetica dei medicamenti antiepilettici eliminati per via epatica; gli alti livelli di estrogeni accelerano la degradazione soprattutto della lamotrigina e dell’oxcarbazepina. Tali fluttuazioni possono accentuare gli effetti proconvulsivanti intrinseci degli estrogeni e causare aumenti ciclici della frequenza delle crisi. In tali evenienze può essere opportuno optare per medicamenti antiepilettici con minori fluttuazioni nelle concentrazioni sieriche.
Effetti simili si verificano con la contraccezione tramite assunzione di inibitori dell’ovulazione contenenti estrogeni: alle dosi assunte a tale scopo, oltre alle riduzioni clinicamente rilevanti delle concentrazioni sieriche di lamotrigina, oxcarbazepina e levetiracetam si verifica anche un effetto proconvulsivo proprio. Nelle giovani donne a cui vengono prescritti contraccettivi a base di estrogeni senza contemporaneamente adeguare il farmaco anticonvulsivante, ciò comporta spesso crisi ricorrenti anche dopo un periodo prolungato di controllo delle stesse. Quale mezzo contraccettivo sono quindi preferibili i preparati a base di gestageni puri («minipillola») o i dispositivi intrauterini («IUD»).
Nella preparazione e nel trattamento durante la gravidanza assume rilevanza assoluta la necessità di minimizzare il rischio teratogeno. Soprattutto nella fase di embriogenesi, sono importantissimi la profilassi con acido folico, il trattamento in monoterapia e l’uso preferenziale delle dosi minime richieste di lamotrigina, levetiracetam e oxcarbazepina, evitando il valproato. Nel periodo precedente al parto, un leggero incremento della dose del farmaco di base o una somministrazione aggiuntiva temporanea e a basso dosaggio di clobazam (5–10 mg) possono contribuiree a ridurre il rischio di crisi.
In fase post-parto, le concentrazioni di anticonvulsivanti aumentano di nuovo nelle prime settimane; nonostante il sonno notturno spesso disturbato, l’aumento del dosaggio effettuato in gravidanza può essere gradualmente invertito. Con i moderni medicamenti antiepilettici, le percentuali di anticonvulsivanti che passano nel latte materno sono innocue e non giustificano il mancato allattamento del neonato (fig. 6).
Donne a partire dai 45 anni: durante la menopausa, circa un quarto delle pazienti evidenzia un peggioramento del controllo delle crisi. Talvolta il rischio di crisi si fa più acuto soprattutto nelle donne con un’elevata sensibilità alle fluttuazioni degli ormoni sessuali e un andamento ciclico della frequenza delle crisi (le cosiddette epilessie catameniali). Può quindi rendersi necessario intensificare il trattamento, e a tal proposito risulta utile il fatto di poter ricorrere all’intero spettro di medicamenti antiepilettici utilizzabili.
Con la menopausa aumenta il rischio di sviluppare l’osteoporosi, favorito dagli anticonvulsivi e che rappresenta un particolare pericolo qualora le crisi diano luogo a cadute. La terapia ormonale sostitutiva, efficace quale profilassi, accentua il rischio di convulsioni a causa degli estrogeni che contiene; di conseguenza può essere necessario aumentare il dosaggio della terapia anticonvulsivante.
L’incidenza delle fratture aumenta considerevolmente soprattutto in chi assume forti induttori enzimatici e valproato. È dunque opportuno optare per sostanze meno induttrici di enzimi (passando, ad esempio, dalla carbamazepina a bloccanti del canale del sodio meno induttori di enzimi come la lamotrigina, la lacosamide, l’oxcarbazepina o l’eslicarbazepina acetato).
Aspetti professionali
Obiettivo essenziale del trattamento sociosanitario è una compromissione minima della performance occupazionale. Il raggiungimento di un buon controllo delle crisi, in particolare scongiurando episodi gravi e stigmatizzanti e una prolungata compromissione postictale, contribuiscono ovviamente al raggiungimento di tale obiettivo; ma anche la tolleranza cognitiva, psicologica e motoria riveste grande importanza ai fini della conservazione del posto di lavoro. Soprattutto chi svolge attività intellettuali deve quindi evitare le sostanze sedative (come carbamazepina, fenobarbital) e quelle cognitivamente problematiche (topiramato e in alcuni casi anche dosi elevate di zonisamide, benzodiazepine e barbiturici) e preferire sostanze cognitivamente ben tollerate (ad esempio brivaracetam/levetiracetam, lacosamide, lamotrigina, eslicarbazepina acetato, pregabalin o valproato).
Per i pazienti con elevato impegno motorio non sono medicamenti di prima scelta quelli che causano tremore (valproato, lacosamide, lamotrigina) o atassia (soprattutto i bloccanti dei canali del sodio con picchi plasmatici, dosi elevate di oxcarbazepina non ritardata o lacosamide, e a mio avviso anche alcune combinazioni di perampanel).
Anche gli effetti collaterali psichiatrici dei medicamenti antiepilettici possono essere determinanti in un’ottica di integrazione professionale: gli stati d’animo depressivi e la maggiore irritabilità, comuni nel trattamento con levetiracetam, risultano spesso problematici. Questi sintomi devono essere accuratamente analizzati ed è consigliabile cambiare tempestivamente i medicamenti prima che insorgano conflitti professionali.
Politerapia e ruolo della comedicazione
Con l’ampliamento della gamma di medicamenti antiepilettici disponibili si moltiplica anche la possibilità di loro combinazioni. Di seguito esponiamo alcune importanti regole di base per un’adeguata terapia combinata:
- Evitare gli induttori enzimatici in combinazione con medicamenti antiepilettici metabolizzati a livello epatico (esempio: combinazione negativa di carbamazepina e lamotrigina)
- Scegliere medicamenti con diverse modalità -d’azio-ne per ottenere almeno un effetto additivo ed effetti collaterali subadditivi
- Evitare combinazioni di più di due medicamenti antiepilettici
- Prestare attenzione alla dose totale e regolare le singole dosi per lasciare spazio all’azione di un farmaco aggiuntivo.
Le interazioni hanno notevole importanza anche qualora si assumano medicamenti per il trattamento di altre malattie. Di particolare importanza nei pazienti con epilessia sono i medicamenti psicotropi; tenere conto delle interazioni avverse medicamentodinamiche con amoxapina, bupropione, clomipramina e maprotilina e delle interazioni medicamentocinetiche con sertralina e fluoxetina.
Comorbidità
A seconda dell’età le comorbilità sono un aspetto rilevante dell’epilessia, essenziale per evitare effetti indesiderati. In tal senso le patologie maggiormente rilevanti sono quelle psichiatriche e quelle interne (fig. 7).
- In presenza di depressione è opportuno evitare le sostanze potenzialmente depressogene (barbiturici, fenitoina, levetiracetam e a mio avviso zonisamide).
- Sono invece particolarmente adatte le sostanze che stabilizzano l’umore come i bloccanti dei canali del sodio, il gabapentin/pregabalin e il valproato.
- In presenza di disturbi psicotici evitare l’uso di levetiracetam e perampanel.
- In caso dei disturbi del sonno sono indicate le sostanze che migliorano la struttura del sonno (per esempio pregabalin e a mio parere perampanel)
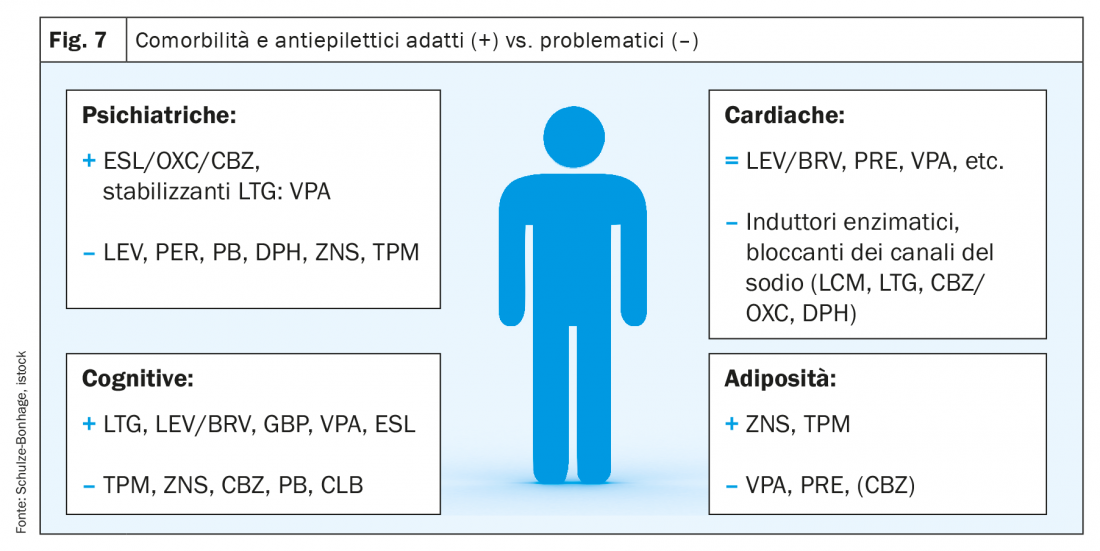
Lo spettro delle possibili concomitanze con patologie interne è ampio, di notevole importanza sono spesso le seguenti:
- Disturbi cardiaci preesistenti: evitare i bloccanti dei canali del sodio in presenza di aritmie cardiache o disturbi della conduzione, oppure se utilizzati monitorarli tramite ECG
- Obesità: evitare i medicamenti antiepilettici che comportano il rischio di sviluppare una sindrome metabolica (specialmente valproato, pregabalin e carbamazepina)
- In caso di insufficienza epatica o renale sono da preferire sostanze eliminabili per via alternativa.
Sintesi
L’ampia disponibilità di antiepilettici consente la scelta di medicamenti su misura per il singolo paziente. In tale scelta si dovrà tenere conto di vari aspetti importanti, riassunti nel presente articolo. Molti dei nuovi medicamenti sono ben tollerati anche se assunti per un lungo periodo di tempo e i loro regimi di dosaggio favoriscono l’aderenza terapeutica. Un altro vantaggio di molti medicamenti antiepilettici moderni è la notevole riduzione del rischio di interazioni medicamentologiche, soprattutto nei pazienti più anziani. È quindi opportuno non adottare un regime medicamentologico fisso, bensì avvalersi di una gamma di medicamenti antiepilettici adattati al paziente.
Di regola è bene evitare gli induttori enzimatici e i medicamenti con un notevole rischio di effetti collaterali come il valproato e le benzodiazepine. In una fase iniziale possono essere utilizzate anche sostanze di recente sviluppo come brivaracetam, eslicarbazepina acetato e lacosamide in virtù della loro migliore tollerabilità, mentre altri nuovi medicamenti ad azione potenziata come perampanel e cenobamato* offrono nuove opportunità per epilessie difficili da trattare.
* attualmente non ancora autorizzato in Svizzera
Take-Home-Messages
- La mancanza o il basso livello di induzione enzimatica nei medicamenti antiepilettici di seconda e terza generazione evita gli effetti collaterali un tempo consueti come osteoporosi, polineuropatie e sindromi metaboliche. Fra questi medicamenti si annoverano lacosamide, levetiracetam, pregabalin e altri medicamenti antiepilettici di recente sviluppo come brivaracetam, eslicarbazepina acetato e cenobamato.
- Per le pazienti in età più avanzata, un’importante opzione è fornita dai i bloccanti dei canali del sodio con poca o nessuna induzione enzimatica (lacosamide, lamotrigina, eslicarbazepina acetato).
- I dati di teratogenesi in gravidanza evidenziano che i rischi più bassi vengono dai trattamenti a basso dosaggio con lamotrigina, levetiracetam e oxcarbazepina.
- La somministrazione di una sola dose, possibile con l’eslicarbazepina acetato e il perampanel, favorisce la compliance.
- I medicamenti antiepilettici con basso potenziale di interazione, effetto neutro sul metabolismo osseo e lipidico ed effetti limitati a livello cardiaco producono vantaggi soprattutto a partire dai 50 anni di età.

Bibliografia:
- Rowan AJ, Ramsay RE, Collins JF, et al.: VA Cooperative Study 428 Group. New onset geriatric epilepsy: a randomized study of gabapentin, lamotrigine, and carbamazepine. Neurology 2005; 64: 1868–1873.
- Ley M, Principe A, Rocamora R: Efectos a largo plazo de las dibenzacepinas sobre los parámetros metabólicos: comparación retrospectiva de carbamacepina, oxcarbacepina y acetato de eslicarbacepina en el mundo real. Rev Neurol. 2020; 71: 54–60.
- Mintzer S, Dimova S, Zhang Y, et al.: Effects of lacosamide and carbamazepine on lipids in a randomized trial. Epilepsia. 2020; 61(12): 2696–2704.
Ulteriore bibliografia:
- Marson A, Burnside G, Appleton R, et al.: SANAD II collaborators. The SANAD II study of the effectiveness and cost-effectiveness of valproate versus levetiracetam for newly diagnosed generalised and unclassifiable epilepsy: an open-label, non-inferiority, multicentre, phase 4, randomised controlled trial. Lancet 2021; 397(10282): 1375–1386.
- Marson A, Burnside G, Appleton R, et al.: SANAD II collaborators. The SANAD II study of the effectiveness and cost-effectiveness of levetiracetam, zonisamide, or lamotrigine for newly diagnosed focal epilepsy: an open-label, non-inferiority, multicentre, phase 4, randomised controlled trial. Lancet 2021; 397(10282): 1363–1374.
- Marson AG, Al-Kharusi AM, Alwaidh M, et al.: SANAD Study group. The SANAD study of effectiveness of valproate, lamotrigine, or topiramate for generalised and unclassifiable epilepsy: an unblinded randomised controlled trial. Lancet 2007; 369(9566): 1016–1026.
- Marson AG, Al-Kharusi AM, Alwaidh M, et al.: SANAD Study group. The SANAD study of effectiveness of carbamazepine, gabapentin, lamotrigine, oxcarbazepine, or topiramate for treatment of partial epilepsy: an unblinded randomised controlled trial. Lancet. 2007; 369(9566): 1000–1015.
- Sake JK, Hebert D, Isojärvi J, et al.: A pooled analysis of lacosamide clinical trial data grouped by mechanism of action of concomitant antiepileptic drugs. CNS Drugs 2010; 24(12): 1055–1068.
- Schulze-Bonhage A: Epilepsien: Formen, Diagnostik und Therapie. Medizinische Monatsschrift für Pharmazeuten 2021, 44: 160–170
- Schulze-Bonhage A, Hintz M: Perampanel in the management of partial-onset seizures: a review of safety, efficacy, and patient acceptability. Patient Prefer Adherence 2015; 9: 1143–1151.
- Semah F, Picot MC, Adam C, et al.: Is the underlying cause of epilepsy a major prognostic factor for recurrence? Neurology 1998; 51: 1256–1262.