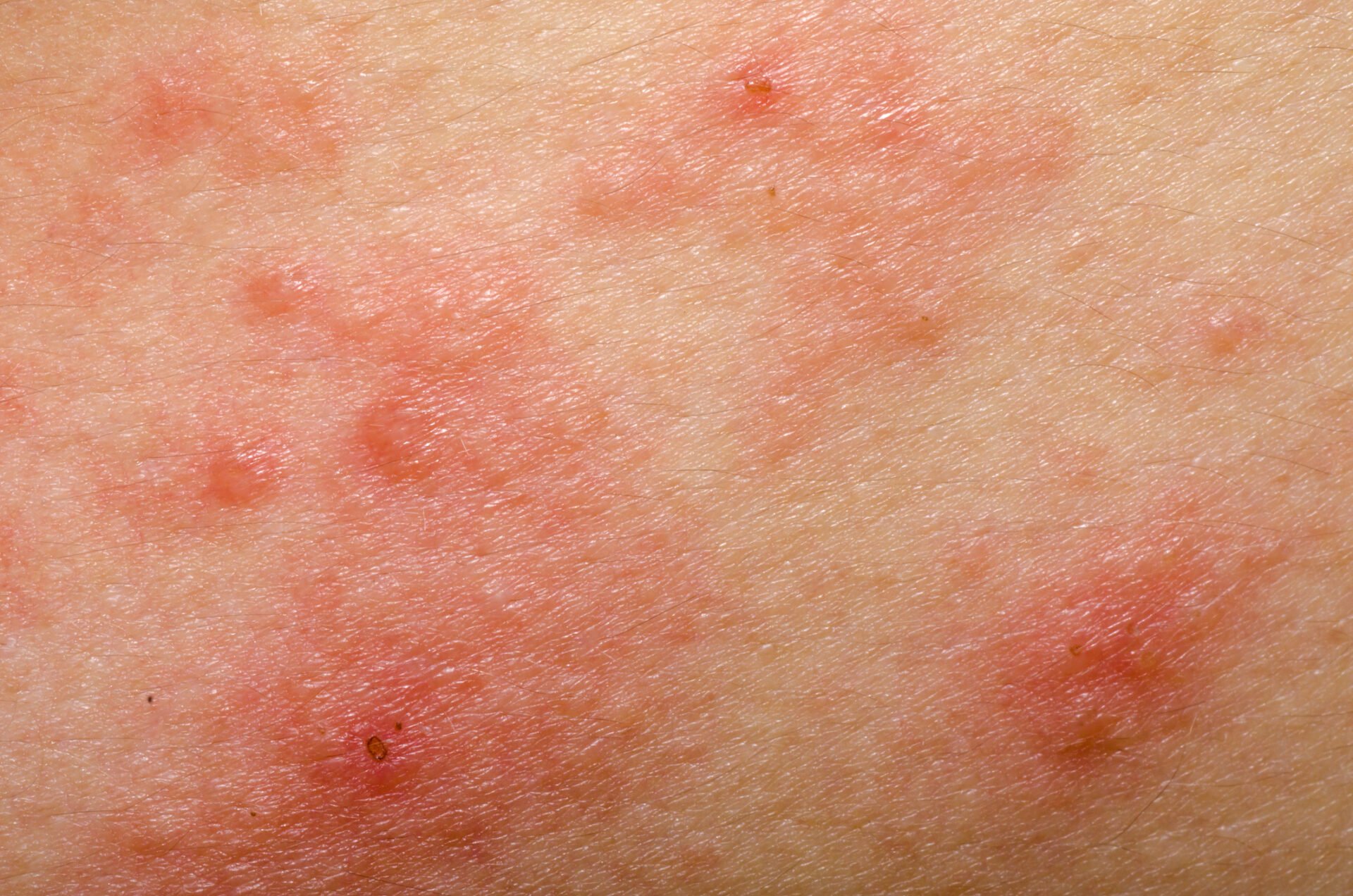
I pato-meccanismi della dermatite atopica (AD) stanno diventando sempre più comprensibili. Uno squilibrio immunologico geneticamente determinato è caratterizzato da un aumento della risposta Th2 ed è associato alla produzione di citochine infiammatorie, come l’interleuchina (IL)-4 e l’IL-13. Ci sono anche altre molecole che svolgono un ruolo importante nel processo infiammatorio. Il panorama terapeutico sta cambiando. Due biologici e tre inibitori della Janus chinasi sono attualmente autorizzati nell’area di indicazione dell’AD in Svizzera e altri sono in fase di sviluppo.
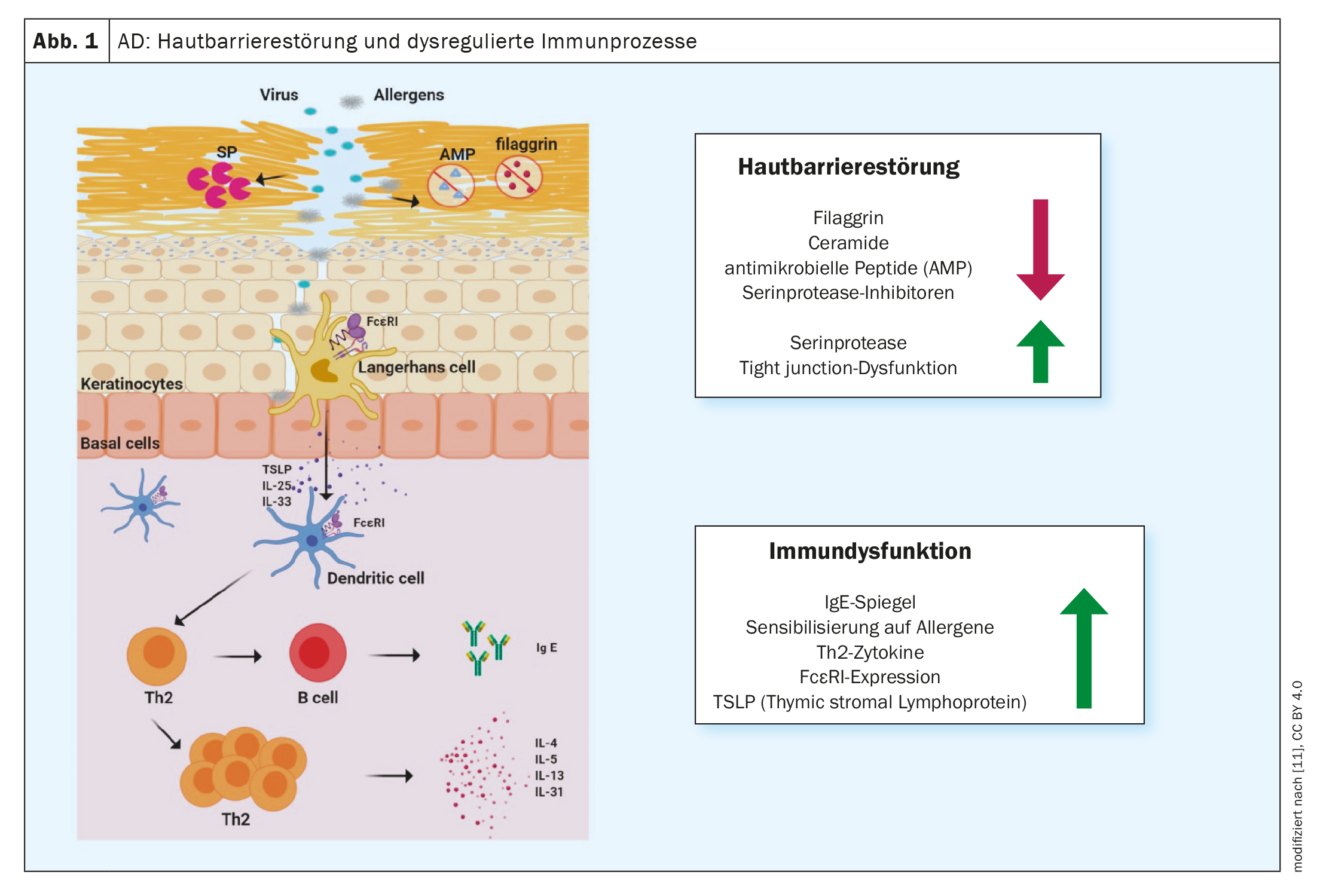
L’infiammazione di tipo 2 è una causa comune di varie malattie allergiche, tra cui la dermatite atopica (AD), l’asma bronchiale, la rinosinusite cronica, l’esofagite eosinofila e la rinite allergica [1]. Nella lotta contro le malattie allergiche vengono sviluppati metodi di trattamento sempre più efficaci. Gli anticorpi monoclonali e gli inibitori della Janus chinasi (JAK) hanno contribuito in modo significativo a migliorare le opzioni di trattamento, ha sottolineato il Prof. Dr. Peter Schmid-Grendelmeier, allergologo, Dipartimento di Dermatologia, Ospedale Universitario di Zurigo, in occasione del congresso annuale della Società Svizzera di Allergologia e Immunologia [2]. Questo sviluppo incoraggiante è stato preceduto da un’intensa ricerca sui processi fisiopatologici. Oggi è noto che una risposta immunitaria dominante T helper (TH)2 è associata alla secrezione di citochine come l’interleuchina (IL)-4, IL-5 e IL-13 (Fig. 1). Questo ambiente infiammatorio non solo promuove la generazione, la maturazione e l’attivazione dei granulociti eosinofili e basofili, ma anche l’attivazione dei mastociti [3].
Base molecolare delle reazioni immunitarie di tipo 2
In alcuni casi, le malattie allergiche si manifestano anche in comorbilità – per esempio, ci sono pazienti che hanno un’asma o una DA grave e soffrono anche di rinite allergica. Tali comorbilità possono aumentare ulteriormente il peso della malattia. L’infiammazione di tipo 2 è mantenuta da TH2, cellule linfoidi innate di tipo 2 (ILC2) e mediatori del sistema immunitario innato e adattativo [1]. Studi empirici dimostrano che il 58-79% di tutti i pazienti adulti con MA soffre di almeno un’altra malattia atopica, indipendentemente dalla gravità [4–6].
Le risposte immunitarie di tipo 2 sono il correlato cellulare dell’infiammazione cutanea nella DA e influenzano in modo significativo anche la funzione barriera e la disbiosi microbica [7]. “Ora sappiamo molto sulla dermatite atopica”, ha riassunto il relatore. Qualche anno fa questo era semplicemente ‘bello da sapere’, ma nel frattempo la crescente comprensione delle relazioni fisiopatologiche ha portato a diverse opzioni terapeutiche immunomodulanti innovative. A differenza dei biologici, gli inibitori della Janus chinasi (JAK) non intercettano i segnali delle citochine nello spazio extracellulare, ma a livello intracellulare.
Biologici e inibitori della JAK in aumento
Il primo biologico approvato nell’indicazione AD è stato dupilumab (Dupixent®) nel 2019. Si tratta di un anticorpo monoclonale diretto contro la subunità α del recettore IL-4, che blocca la segnalazione dei mediatori infiammatori IL-4 e IL-13 [8,9]. Questo approccio terapeutico si è dimostrato molto efficace, secondo il Prof. Schmid-Grendelmeier. Tralokinumab (Adtralza®), un altro biologico che neutralizza specificamente l’IL-13, è disponibile per i pazienti affetti da AD dal 2022 [8]. Sebbene siano attualmente disponibili prove reali meno estese rispetto a dupilumab, le prove di efficacia sono state finora molto convincenti.
Gli inibitori della JAK rappresentano un altro approccio terapeutico promettente. In Svizzera, tre inibitori JAK – baricitinib (Olumiant®), abrocitinib (Cibinqo®) e upadacitinib (Rinvoq®) – hanno recentemente superato gli ostacoli dell’autorizzazione nell’indicazione AD [8]. Gli inibitori della JAK esercitano il loro effetto attraverso il meccanismo intracellulare JAK-STAT.
| Come anticorpi o proteine di fusione, i biologici bloccano una singola citochina a livello extracellulare o un recettore di citochina o una molecola di superficie della cellula, mentre le JAK-i agiscono a livello intracellulare e modulano diverse citochine. A differenza dei biologici, l’obiettivo di JAK-i è quello di ridurre reversibilmente l’attività di una o più isoforme JAK, in modo simile all’abbassamento di un termostato. L’effetto è quindi più ampio e meno specifico. |
| a [12] |
Decisione terapeutica basata su criteri
“Un biologico ha come bersaglio una o due citochine e le blocca più o meno completamente. Un JAK-i, invece, riduce diverse citochine con affinità diverse. Ci sono pro e contro in entrambi gli approcci”, ha spiegato il Prof. Schmid-Grendelmeier [2]. La selezione della rispettiva opzione terapeutica deve essere adattata individualmente al paziente, tenendo conto di aspetti come le malattie concomitanti, lo stato di infezione e l’età. Anche i fattori situazionali possono giocare un ruolo in queste considerazioni; per esempio, JAK-i tende ad avere un inizio d’azione più rapido ma, a differenza dei biologici, richiede uno screening relativamente esteso e un monitoraggio di laboratorio in parallelo alla terapia [10]. Un’altra differenza importante per la vita quotidiana dei pazienti riguarda la forma di somministrazione: baricitinib, abrocitinib e upadacitinib vengono assunti per via orale sotto forma di compresse una volta al giorno, mentre i biologici dupilumab e tralokinumab vengono somministrati sotto forma di iniezioni a intervalli di qualche settimana o mese. Lo spettro terapeutico esteso per l’AD si riflette ora anche nella versione aggiornata della linea guida S3. Mentre dupilumab era già incluso nella versione precedente della linea guida, ora sono coperti anche tralokinumab, abrocitinib, baricitinib e upadacitinib [9].
Conclusione e prospettive
Per i pazienti con un alto grado di gravità dell’AD, le nuove opzioni di trattamento rappresentano un importante progresso, secondo il relatore [2]. Ma c’è ancora molta ricerca da fare. In Svizzera, dupilumab è finora l’unico rappresentante del gruppo di terapie sistemiche più recenti (biologici, JAK-i) che ha ricevuto un’estensione dell’indicazione per i pazienti pediatrici con AD di età pari o superiore a 6 anni. Tralokinumab è autorizzato in Svizzera a partire dai 18 anni di età e nell’UE a partire dai 12 anni. Nel caso di JAK-i, l’autorizzazione è stata finora limitata ai pazienti adulti. Ma questo potrebbe cambiare in un futuro non troppo lontano, soprattutto perché si sta studiando l’uso di diversi biologici e di JAK-i nei pazienti con AD pediatrico.
Inoltre, sono in corso di ricerca altri principi attivi con nuovi bersagli. Lebrikizumab, nemolizumab, tezelumab e Ox-40-Ak si sono dimostrati finora dei candidati promettenti [2]. Il lebrikizumab si lega specificamente all’IL-13 liberamente circolante e il nemolizumab blocca la subunità α del recettore dell’IL-31. Tezelumab è un anticorpo contro la TSLP (linfoproteina stromale timica) e Ox-40 è un recettore costimolatorio sulle cellule T attivate.
Per i pazienti con MA da moderato a grave, l’ampliamento delle opzioni terapeutiche offre migliori possibilità di recupero, a condizione che sia disponibile l’accesso alle terapie. L’assistenza di base con emollienti e l’educazione del paziente rimangono pilastri importanti del trattamento della DA di qualsiasi gravità [2]. I pazienti ricevono molte informazioni e consigli preziosi sulla gestione della malattia durante le sessioni di formazione sulla dermatite atopica.
Congresso: Società Svizzera di Allergologia e Immunologia (SSAI), Congresso annuale
Letteratura:
- Klimek L, et al: Infiammazione di tipo 2: il valore dei diversi biologici nella pratica. Dtsch Arztebl 2021; 118(50): [20]; DOI: 10.3238/PersPneumo.2021.12.17.05
- “Nuovi concetti nell’allergia”, Prof. Dr. Peter Schmid-Grendelmeier, Congresso annuale SSAI, 24-25 agosto 2023.
- Kühn M, et al: Risposta immunitaria TH2: significato e influenza terapeutica. Swiss Med Forum 2021; 21(0102): 13-17.
- Weidinger S, et al: Dermatite atopica. Nat Rev Dis Primers 2018; 4(1): 2.
- Chiesa Fuxench ZC, Ong P: Poster presentato all’AAD 2018. Poster 6236.
- Drucker AM, et al: L’onere della dermatite atopica: sintesi di un rapporto per la National Eczema Association. J Invest Dermatol 2017; 137(1): 26-30.
- Lauffer F, Biedermann T: Eczema atopico: un fuoco inquietante per una relazione triangolare. Dtsch Arztebl 2021; 118(24): [24]; DOI: 10.3238/PersDerma.2021.06.18.04
- Swissmedic: Informazioni sui medicinali, www.swissmedicinfo.ch,(ultimo accesso 15.11.2023)
- Linea guida S3 “Dermatite atopica”, registro AWMF n.: 013-027, stato 17/06/2023.
- Worm M, et al: Terapia moderna della dermatite atopica: biologici e farmaci a piccole molecole. JDDG 2020; 18(10): 1085-1093.
- Yang G, et al: Anomalie della barriera cutanea e disfunzione immunitaria nella dermatite atopica. International Journal of Molecular Sciences 2020; 21(8): 2867.
www.mdpi.com/1422-0067/21/8/2867,(ultimo accesso 15 novembre 2023) - Choy EH: Significato clinico della selettività degli inibitori della Janus chinasi. Reumatologia (Oxford) 2019; 58(6): 953-962.
DERMATOLOGIE PRAXIS 2023; 33(6): 22-23 (pubblicato il 12.12.23, prima della stampa)