Se un paziente soffre di apnea ostruttiva del sonno (OSA), questo lo predispone a un’intera gamma di comorbidità, dai disturbi cardiovascolari e renali a quelli polmonari e neuropsichiatrici. Ma ci sono anche prove crescenti di un effetto inverso. I ricercatori irlandesi hanno studiato la relazione tra OSA e comorbilità, concentrandosi sulle comorbilità che mostrano prove di una relazione bidirezionale.
I possibili meccanismi associati all’OSA che contribuiscono alla comorbilità includono l’ipossia intermittente, la pressione intratoracica fluttuante e le microeccitazioni ricorrenti, che sono caratteristiche integrali dell’apnea ostruttiva. Le conseguenze cellulari o molecolari possono includere l’eccitazione simpatica, l’infiammazione sistemica e lo stress ossidativo, oltre alla disfunzione metabolica ed endoteliale, scrivono la Dr.ssa Margaret Gleeson e il Prof. Dr. Walter McNicholas della School of Medicine, University College Dublin, e del Dipartimento di Medicina Respiratoria e del Sonno, St Vincent’s Hospital Group, Dublin [1]. In presenza di determinate comorbidità, possono prevalere meccanismi diversi.
Obesità
Circa il 70% dei pazienti affetti da OSA sono obesi, mentre il 50% di coloro che hanno un indice di massa corporea (BMI) >40 hanno un’OSA con un indice di apnea-ipopnea (AHI) >10. Un IMC più elevato porta in genere a un’OSA più grave, soprattutto negli uomini e nella popolazione più giovane. La maggior parte della ricerca si è concentrata sull’obesità come fattore di rischio per l’OSA, ma ci sono prove che la relazione è bidirezionale.
L’accumulo di grasso nella zona del collo contribuisce al restringimento dell’orofaringe, con conseguente aumento del rischio di collasso delle vie aeree superiori. Inoltre, l’obesità addominale riduce la trazione delle vie aeree superiori, predisponendo ulteriormente al collasso. Inoltre, l’ipossia intermittente, che è una caratteristica centrale dell’OSA, innesca una risposta proinfiammatoria nel tessuto adiposo viscerale e contribuisce all’insulino-resistenza.
Effetto terapeutico di una forte riduzione del peso, soprattutto dopo la chirurgia bariatrica. L’intervento dietetico da solo, invece, ha mostrato solo un piccolo effetto in un periodo di follow-up di 10 anni, scrivono gli autori. I pazienti affetti da OSA con un piccolo volume maxillomandibolare preesistente hanno avuto i maggiori benefici dalla perdita di peso, indicando un’importante interazione tra l’anatomia delle vie aeree superiori e gli effetti dell’obesità.
Gli uomini in sovrappeso con OSA perdono meno peso in risposta a un programma di dieta ed esercizio fisico della durata di un anno, rispetto agli uomini di pari peso senza OSA. Sebbene la terapia con pressione positiva continua delle vie aeree (CPAP) sia altamente efficace nel controllo dell’OSA, paradossalmente alcuni pazienti aumentano di peso dopo aver iniziato il trattamento con CPAP, in particolare le donne e i pazienti non obesi. Nel complesso, la relazione tra obesità e OSA è sinergica in termini di rischio cardiometabolico, con una varietà di potenziali meccanismi intermedi, tra cui l’infiammazione, la disfunzione endoteliale e l’insulino-resistenza, che vengono amplificati dalla co-occorrenza di entrambe le condizioni, affermano il dottor Gleeson e il professor McNicholas.
BPCO
La relazione tra BPCO e OSA è descritta dagli autori come “complessa”: Alcuni fattori, come l’iperinflazione polmonare, proteggono dall’OSA, mentre altri, come la ritenzione di liquidi, favoriscono l’OSA. L’aumento dell’IMC e l’anamnesi del fumo sono correlati positivamente con la probabilità di OSA nei pazienti con BPCO (Fig. 1).
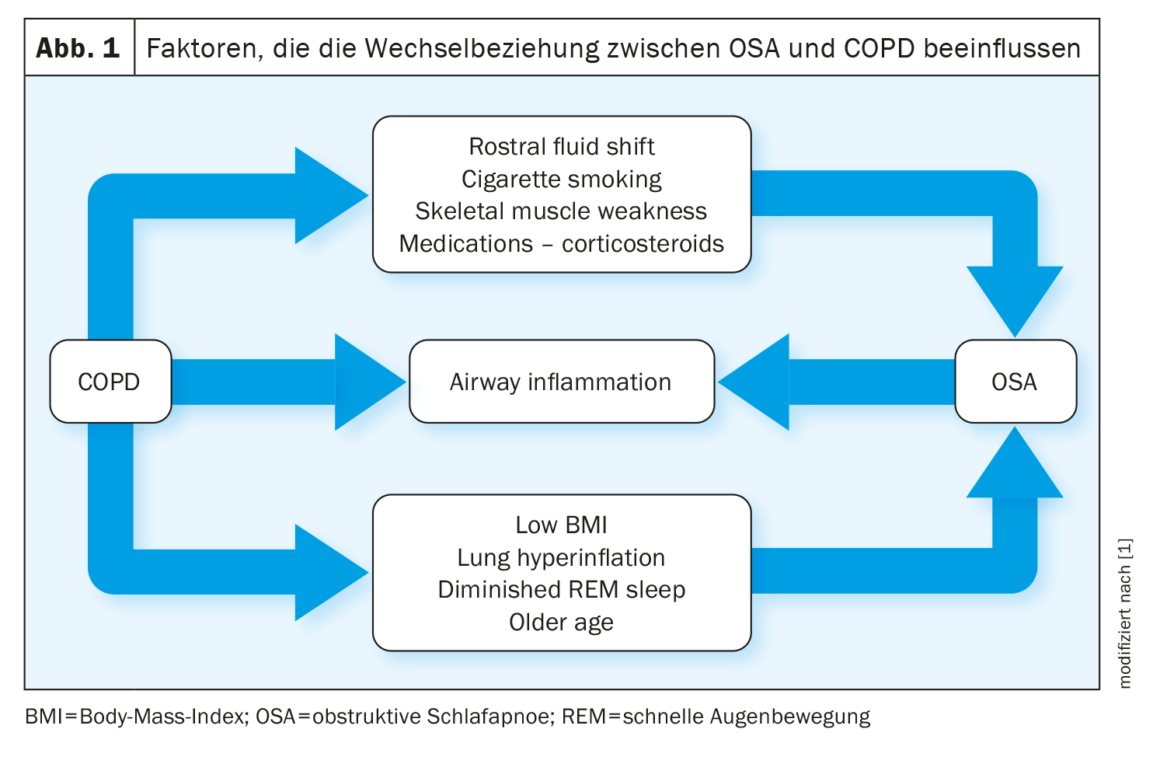
Il lavoro sull’OSA come fattore di rischio per la BPCO ha prodotto risultati contrastanti. Per esempio, uno studio mostra una maggiore prevalenza di BPCO e asma nei pazienti con OSA rispetto a una corrispondente popolazione di controllo, soprattutto nelle donne. L’OSA sembra anche esacerbare l’infiammazione delle vie aeree inferiori nei pazienti con BPCO, e gli studi sugli animali riportano che l’ipossia cronica intermittente contribuisce al danno polmonare nei topi, inducendo infiammazione e stress ossidativo.
I pazienti con sovrapposizione BPCO-OSA trattati con CPAP a lungo termine hanno una sopravvivenza simile a quella dei pazienti con la sola BPCO, mentre i pazienti con sovrapposizione non trattati con CPAP hanno una mortalità più elevata e tassi di ospedalizzazione con esacerbazioni acute. Questi risultati evidenziano l’importanza di identificare l’OSA coesistente nei pazienti con BPCO grave, in modo da poter selezionare la terapia ottimale, hanno detto il dottor Gleeson e il professor McNicholas.
Diabete
Il diabete e l’OSA spesso coesistono, e ci sono sempre più prove di una relazione bidirezionale.
Diversi studi di coorte trasversali hanno dimostrato un’associazione indipendente con il diabete di tipo 2 e l’insulino-resistenza; una stima congiunta del rischio relativo di diabete da nove studi originali era di 1,69 (95% CI 1,45-1,80). I meccanismi del diabete e dell’insulino-resistenza includono l’ipossia intermittente e la frammentazione del sonno che portano all’eccitazione simpatica e all’infiammazione. Uno studio di coorte su 8678 adulti sottoposti a screening per l’OSA ha riportato che le persone con OSA grave avevano un rischio del 30% più elevato di sviluppare il diabete rispetto a quelle senza OSA, dopo un follow-up medio di 67 mesi, dopo aver controllato i fattori confondenti.
La sola terapia CPAP per 24,5 settimane non ha promosso la sensibilità all’insulina nei pazienti non diabetici con OSA, a differenza della riduzione del peso. Gli studi di controllo randomizzati sulla CPAP nei pazienti diabetici con OSA hanno prodotto risultati contrastanti.
Alcune conseguenze del diabete mellito possono predisporre all’OSA, tra cui la neuropatia che colpisce i muscoli delle vie aeree superiori e i disturbi del controllo respiratorio. Uno studio prospettico su quasi 300.000 professionisti della salute ha rilevato che l’OSA era un fattore di rischio indipendente per il diabete di nuova insorgenza, ma al contrario, il diabete insulino-dipendente era un fattore di rischio indipendente per l’OSA nelle donne.
Ipertensione
Sebbene l’ipertensione sia molto comune nei pazienti con OSA, la maggior parte della ricerca su questo argomento si è concentrata sull’OSA come fattore di rischio per l’ipertensione.
Molti studi epidemiologici basati sulla popolazione indicano chiaramente che l’OSA è un fattore di rischio per l’ipertensione sistemica, spesso con un profilo di pressione sanguigna (BP) notturna non decrescente. I dati dello Sleep Heart Health Study hanno mostrato un’associazione dose-dipendente con l’ipertensione prevalente e il Wisconsin Cohort Study ha riportato una maggiore presenza di ipertensione associata all’OSA dopo 4 anni di follow-up. I dati dello studio ESADA, che ha coinvolto 4372 pazienti con OSA lieve, hanno trovato un’associazione indipendente con l’ipertensione prevalente, mentre uno studio prospettico su 744 pazienti con OSA lieve/moderata e normotesi al basale ha riportato un’associazione con l’ipertensione di nuova insorgenza dopo 9 anni nei pazienti <60 anni.
Ci sono prove limitate che l’ipertensione possa predisporre all’OSA. I dati provenienti da studi su animali e piccoli esseri umani suggeriscono che le fluttuazioni della pressione sanguigna possono influenzare il tono delle vie aeree superiori, mostrando cambiamenti inibitori nell’elettromiogramma (EMG). Questo indica che l’abbassamento della pressione sanguigna può migliorare il flusso d’aria e ridurre la gravità dell’OSA.
Insufficienza cardiaca
La relazione bidirezionale tra l’apnea del sonno e l’insufficienza cardiaca può essere in parte spiegata da fattori di rischio comuni come l’età, l’IMC elevato e lo stile di vita sedentario. I meccanismi unificanti, in particolare la ritenzione e la ridistribuzione dei liquidi, portano a una relazione bidirezionale in cui può essere difficile determinare la causa e l’effetto.
L’OSA è associata a un aumento del rischio di insorgenza e progressione della malattia coronarica, dell’insufficienza cardiaca congestizia e della mortalità cardiovascolare. Può indurre il rimodellamento cardiaco, contribuendo all’insufficienza cardiaca, e può compromettere acutamente la funzione cardiaca, esacerbando gli episodi di insufficienza cardiaca acuta. I pazienti con un AHI più alto hanno un grado maggiore di disfunzione diastolica. I pazienti con OSA lieve o assente avevano un’incidenza di eventi fatali inferiore del 50% rispetto ai pazienti con malattia moderata o grave non trattata. L’OSA può influire negativamente sulla prognosi dell’insufficienza cardiaca ed è associata a un aumento dei ricoveri ospedalieri e della mortalità post-dimissione nei pazienti OSA ospedalizzati.
Il trattamento dell’OSA con la CPAP migliora gli endpoint cardiovascolari intermedi, come la pressione sanguigna, la frequenza e il ritmo cardiaco e la frazione di eiezione. Uno studio ha riscontrato un aumento del 9% della frazione di eiezione ventricolare sinistra (LVEF), oltre a una diminuzione diurna della frequenza cardiaca e della pressione sanguigna, che potrebbe riflettere una riduzione dell’escrezione urinaria notturna di epinefrina. Tuttavia, mentre è stato dimostrato un miglioramento fisiologico immediato con la terapia CPAP, mancano dati che dimostrino un miglioramento della mortalità e della sopravvivenza senza trapianto per quanto riguarda l’effetto a lungo termine.
In uno studio controllato randomizzato (RCT) su pazienti con OSA grave, la restrizione di sodio e la terapia diuretica hanno determinato solo un miglioramento limitato dell’AHI, suggerendo che la ritenzione di liquidi spiega solo parzialmente l’eziologia dell’OSA nell’insufficienza cardiaca. In un’esacerbazione acuta di insufficienza cardiaca diastolica ipertensiva, la terapia diuretica ha determinato una riduzione del peso corporeo, un aumento del calibro faringeo e una diminuzione dell’AHI di 17. Al contrario, in uno studio osservazionale, la terapia diuretica ha migliorato l’OSA nei pazienti obesi o con ipertensione, ma non è stato osservato alcun miglioramento significativo della gravità dell’OSA nei pazienti con insufficienza cardiaca.
Disfunzione renale
Le prove attuali suggeriscono che la malattia renale e l’apnea del sonno hanno una relazione bidirezionale. La prevalenza dell’OSA è fino a dieci volte superiore nei pazienti con malattia renale cronica (CKD) rispetto alla popolazione generale, ma l’OSA rimane poco riconosciuta nella CKD, spiegano i ricercatori irlandesi. L’incidenza dell’OSA aumenta proporzionalmente alla gravità della CKD, a sostegno del suo ruolo nella patogenesi. Uno studio clinico ha riportato una prevalenza di OSA del 27%, 41% e 57% nei pazienti con eGFR >60, nei pazienti con eGFR <60 ma senza terapia sostitutiva renale e nei pazienti in emodialisi, rispettivamente.
I fattori che contribuiscono all’OSA nella CKD includono l’aumento della sensibilità della membrana, la diminuzione della clearance delle tossine uremiche e l’ipervolemia. In un gruppo di 40 pazienti in emodialisi, il 70% aveva un AHI >15 e un volume totale di fluido extracellulare maggiore, compresi i volumi del collo, del torace e delle gambe, anche se non c’era alcuna differenza nel BMI rispetto a quelli con un AHI <5.
L’aumento del sovraccarico di liquidi predice il peggioramento dell’OSA e il trattamento aggressivo dell’ESRD può ridurre la gravità. La dialisi quotidiana, la dialisi notturna e la dialisi peritoneale automatizzata notturna sono state trattate in studi osservazionali con benefici per l’OSA legati alla riduzione dell’AHI, alla riduzione della congestione respiratoria e al miglioramento della clearance uremica. Il trapianto di rene inverte molte delle complicazioni metaboliche dell’ESRD e rallenta la progressione delle comorbidità associate, ma il suo ruolo nel beneficio dell’OSA rimane inconcludente.
Sebbene l’OSA possa verificarsi come conseguenza della CKD, ci sono prove che possa anche contribuire alla CKD e al progressivo declino del GFR. L’OSA è stata anche associata a una maggiore morbilità e mortalità nei pazienti con ESRD, che può essere correlata agli effetti di comorbilità come le malattie cardiovascolari e cerebrovascolari, tra cui aritmie, malattie coronariche e ictus.
La malattia renale indotta dall’OSA può essere spiegata da due meccanismi primari: Ipertensione e ipossia intrarenale con iperfiltrazione glomerulare. La midollare renale è particolarmente sensibile all’ipossia, che innesca lo stress ossidativo, l’infiammazione sistemica e la disfunzione endoteliale, portando al danno tubulo-interstiziale, segno distintivo della CKD. Gli episodi di apnea stimolano il sistema nervoso simpatico e il sistema RAAS, portando all’ipertensione sistemica e glomerulare, al danno vascolare e alla rigidità della parete arteriosa, culminando nell’ischemia renale.
In uno studio, la terapia con CPAP ha influenzato positivamente l’emodinamica renale nei pazienti con funzione renale normale al basale, suggerendo un beneficio nel rallentare il danno renale. Tuttavia, il ruolo della CPAP nell’attenuare la progressione della disfunzione renale nell’OSA è incerto, con pochi studi incentrati su pazienti con CKD esistente.
Ictus
La respirazione disturbata dal sonno (SDB) si verifica spesso nei pazienti dopo un ictus. Non è chiaro se l’OSA sia un fattore scatenante, che potenzia i fattori di rischio vascolare noti come l’ipertensione, o una conseguenza della lesione cerebrale legata all’ictus.
L’OSA è un fattore di rischio per l’ictus e comporta un aumento di circa due volte dell’incidenza dell’ictus. Una meta-analisi ha identificato un aumento dell’incidenza di ictus nei pazienti con OSA non trattata, anche dopo aver tenuto conto di potenziali fattori confondenti come età, BMI, diabete e pressione alta. Gli studi osservazionali indicano una riduzione del rischio di ictus nei pazienti con OSA che assumono la CPAP, soprattutto nei pazienti conformi. Gli RCT hanno suggerito che un’adesione al trattamento di >4 ore potrebbe fornire qualche beneficio.
La prevalenza dell’OSA è elevata nell’ictus, con un terzo dei sopravvissuti che documentano un AHI >30, anche se è possibile che l’ictus riveli un’OSA preesistente. L’architettura del sonno post-ictus può influenzare i meccanismi di controllo respiratorio a livello centrale, ma in particolare l’ictus può compromettere la funzione muscolare delle vie aeree superiori, aumentando la collassabilità.
Depressione
La depressione e l’OSA possono condividere sintomi simili, tra cui scarsa concentrazione, disturbi della memoria e affaticamento, che complicano la valutazione clinica e la diagnosi (Fig. 2). I disturbi del sonno sono un sintomo comune auto-riferito della depressione e possono essere predittivi del successivo sviluppo della depressione. Una teoria recente è che le persone affette da depressione hanno un rischio maggiore di OSA più avanti nella vita. I meccanismi previsti alla base di ogni processo includono la frammentazione del sonno, i risvegli frequenti e gli episodi ipossici intermittenti che portano all’ipoperfusione cerebrale e alla disfunzione dei neurotrasmettitori. Nonostante la plausibilità biologica, ci sono poche ricerche sulle possibili relazioni bidirezionali e i risultati sono stati contraddittori.
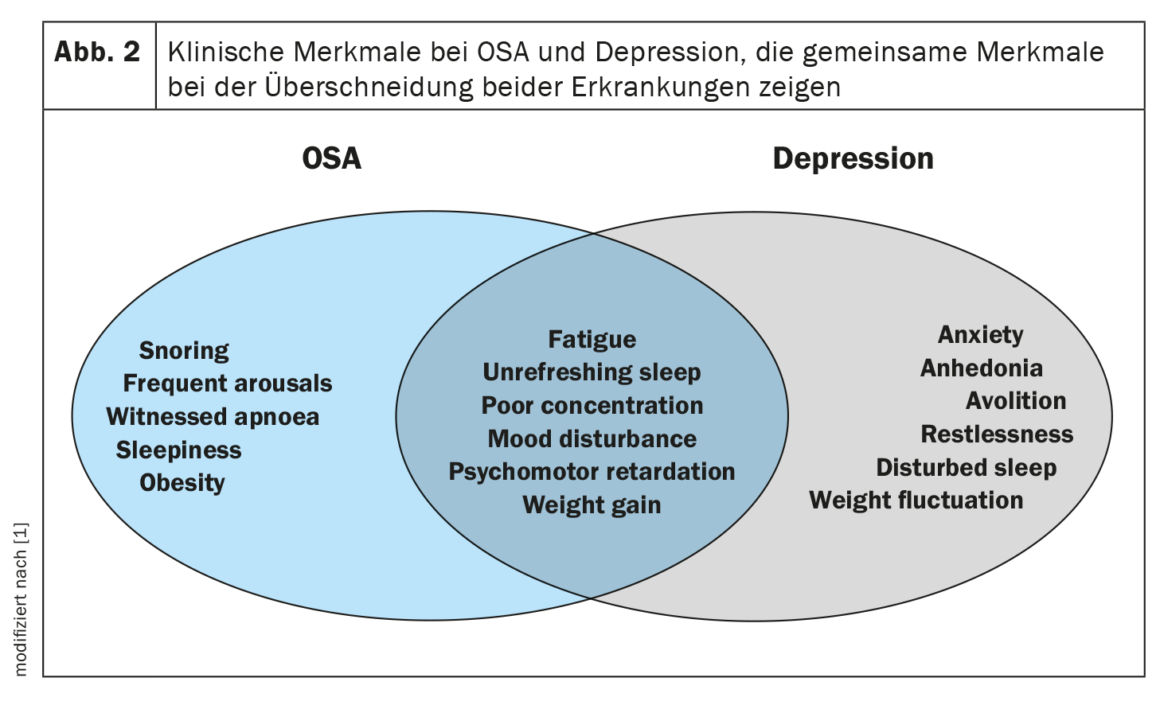
Nelle coorti cliniche, la prevalenza della depressione nell’OSA è compresa tra il 20 e il 40% e sembra esserci un aumento dell’odds ratio per la depressione con l’aumentare della gravità della SDB. Tuttavia, altri studi più piccoli hanno riportato che la presenza o la gravità dell’OSA non erano predittori indipendenti dei punteggi di depressione o dei successivi ricoveri ospedalieri.
Il trattamento dell’OSA con CPAP per 5 o più ore a notte per almeno 3 mesi ha migliorato i sintomi depressivi, compresa l’ideazione suicida, indipendentemente dall’uso di antidepressivi.
Al contrario, la depressione non è stata ben studiata come possibile causa di OSA. I rapporti di prevalenza indicano che il 15% dei pazienti psichiatrici con disturbo depressivo maggiore (MDD) presenta un AHI elevato alla polisonnografia notturna e il 18% dei pazienti con MDD soddisfa anche i criteri diagnostici per l’OSA.
Una revisione di studi prospettici con cinque diversi antidepressivi ha rilevato che solo due avevano un effetto positivo sulla riduzione dell’AHI, ma nessun effetto sulla sonnolenza o sulla qualità del sonno. Inoltre, l’OSA non diagnosticata può peggiorare con alcuni trattamenti farmacologici che mirano alla depressione, e l’aumento di peso è un possibile fattore. Le benzodiazepine possono aumentare la frequenza e la durata degli eventi di apnea, influenzando il tono delle vie aeree superiori e la soglia di eccitazione.
Letteratura:
- Gleeson M, McNicholas WT: Relazioni bidirezionali di comorbilità con l’apnea ostruttiva del sonno. Eur Respir Rev 2022; 31: 210256; doi: 10.1183/16000617.0256-2021.
InFo PNEUMOLOGIA & ALLERGOLOGIA 2023; 5(1): 24-25











