La resistenza alle sostanze antibiotiche è in aumento in tutto il mondo. Ciò comporta una graduale perdita di efficacia di molti antibiotici e rende più difficile il trattamento di molte infezioni. La resistenza agli antibiotici β-lattamici nei batteri Gram-negativi è spesso associata alla produzione di β-lattamasi. Alcuni degli sforzi per superare questo meccanismo di resistenza comune hanno avuto successo. Oltre alle sostanze già approvate, diversi principi attivi sono attualmente oggetto di studi clinici.
La crescente resistenza agli antibiotici dei patogeni batterici è un problema importante. Questo riguarda sia i contesti di assistenza ospedaliera che ambulatoriale, soprattutto perché circa l’80% degli antibiotici viene prescritto in ambito ambulatoriale [1,2]. Le strategie per combattere la resistenza agli antibiotici possono essere implementate come parte dei programmi di stewardship antibiotica o in modo indipendente. La Società Svizzera di Malattie Infettive pubblica linee guida su vari tipi di infezioni e sono stati lanciati numerosi progetti sul tema della resistenza agli antibiotici (box) [3]. “I più difficili da trattare rimangono i batteri Gram-negativi multi-resistenti, perché ci sono solo poche opzioni valide per questo”, ha spiegato la Prof.ssa Sarah Tschudin Sutter, MD, Clinica di Infettivologia e Igiene Ospedaliera presso l’Ospedale Universitario di Basilea [4]. Gli Acinetobacter baumannii resistenti ai carbapenemi , gli Pseudomonas aeruginosa resistenti ai carbapenemi e gli agenti patogeni resistenti alle cefalosporine di terza generazione sono stati classificati dall’OMS come “agenti patogeni di prima categoria” nell’elenco delle priorità per lo sviluppo di nuovi antibiotici.
|
Il Centro svizzero per la resistenza agli antibiotici (ANRESIS), un sistema di sorveglianza nazionale e un’unità di ricerca per la resistenza agli antibiotici e il consumo di antibiotici, offre, tra l’altro, una visualizzazione interattiva degli ultimi dati sulla resistenza su [15]. Il Dipartimento degli Affari Interni e il Dipartimento degli Affari Economici, dell’Istruzione e della Ricerca sono responsabili dell’attuazione della strategia nazionale sulla resistenza agli antibiotici (StAR) [17]. StAR persegue l’obiettivo di preservare l’efficacia degli antibiotici per l’uomo e gli animali nel lungo periodo. Tra le altre cose, vengono formulate anche raccomandazioni specifiche sulle misure igieniche per migliorare l’igiene della cucina, al fine di evitare la trasmissione di batteri resistenti agli antibiotici attraverso alimenti vegetali o animali. Questo è in linea con l’approccio “One Health” dell’Organizzazione Mondiale della Sanità (OMS) per combattere i batteri resistenti agli antibiotici [18]. Il Centro europeo per il controllo delle malattie (ECDC) offre un “ATLAS di sorveglianza delle malattie infettive” sulla sua homepage. Questo strumento consente di rilevare la resistenza agli antibiotici in diversi Paesi per numerosi importanti patogeni batterici [16]. La ricerca viene condotta in tutto il mondo in numerosi progetti di studio sui temi dei meccanismi di resistenza e dello sviluppo di nuovi antibiotici. |
I meccanismi di resistenza più importanti e le esigenze non soddisfatte
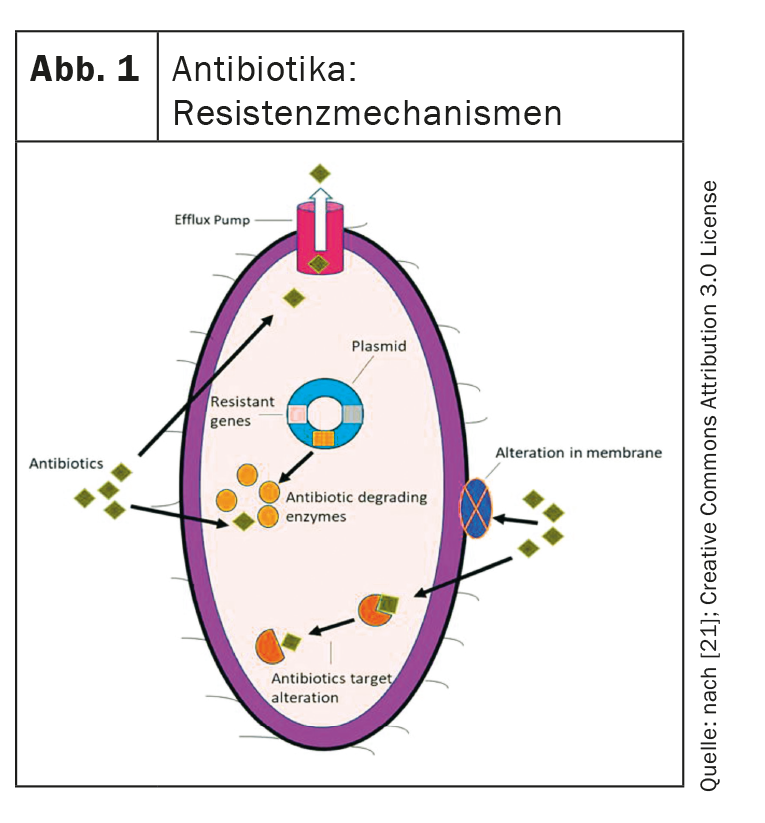
Questi sono i quattro meccanismi di resistenza più importanti che i batteri possono sviluppare e che i nuovi antibiotici devono superare (Fig. 1) [4,21,22]:
- Perdita di porina: le mutazioni nei geni della porina portano alla perdita di porina e quindi a una ridotta permeabilità della membrana cellulare batterica. Questo ostacola l’assorbimento degli antibiotici.
- Pompe di efflusso: anche le pompe di efflusso sono un fattore importante. Questi trasportano gli antibiotici verso l’extracellulare e possono essere regolati.
- Modifica del bersaglio: il sito di legame degli antibiotici può essere modificato in modo tale che gli antibiotici non possano più esercitare il loro effetto.
- Enzimi idrolizzanti: possono scomporre enzimaticamente gli antibiotici.
La maggior parte delle sostanze antibiotiche attualmente disponibili sono sostanze prodotte dai funghi e dai batteri stessi; tra queste ci sono solo poche sostanze prodotte sinteticamente. Negli ultimi 10-15 anni, quasi nessun nuovo antibiotico è stato immesso sul mercato. A fronte dello sviluppo della resistenza agli antibiotici, c’è un’urgente necessità di sviluppare nuovi agenti antibiotici [5].
Resistenza alle β-lattamasi: un problema mondiale
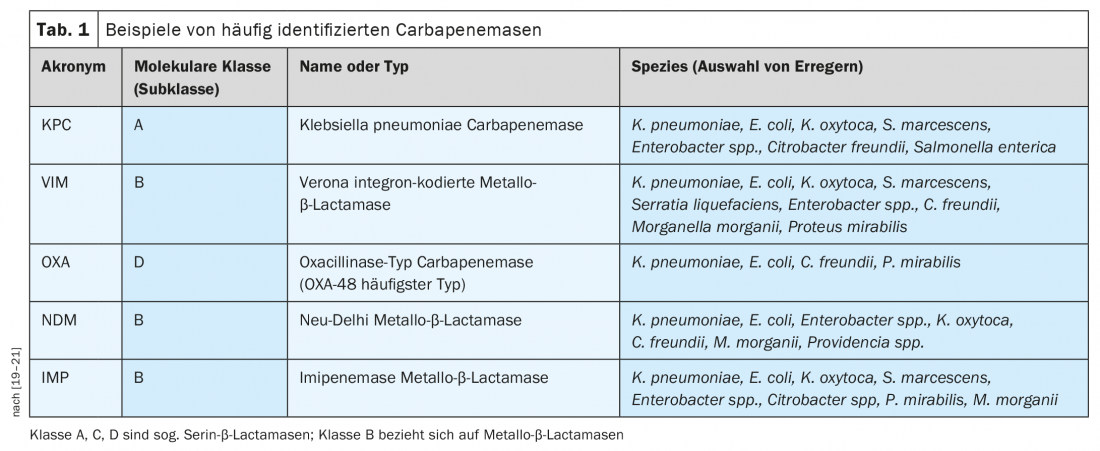
L’Organizzazione Mondiale della Sanità (OMS) ha rilasciato una dichiarazione sulla priorità dello sviluppo degli antibiotici [6]. Questo dimostra che c’è una grande necessità, in particolare, di antibiotici con efficacia nei patogeni Gram-negativi per combattere la resistenza ai carbapenemi [6]. La resistenza agli antibiotici β-lattamici nei batteri Gram-negativi è spesso associata alla produzione di β-lattamasi, comprese le β-lattamasi a spettro esteso ( ESBL) e le carbapenemasi (Tab. 1), che appartengono a diverse classi molecolari [7]. Le carbapenemasi sono enzimi batterici il cui sviluppo di resistenza agli antibiotici rappresenta una minaccia attuale o potenziale per la salute pubblica [8]. Il gruppo ESBL è omogeneo, cioè ha gli stessi substrati, il che rappresenta un vantaggio in termini di trattamento. Al contrario, le carbapenemasi sono un gruppo molto eterogeneo di enzimi con diverse proprietà chimiche e diversi substrati. “Di conseguenza, è difficile trovare sostanze efficaci per tutte le diverse classi di carbapenemasi”, ha detto il relatore [4]. Le varie carbapenemasi sono diffuse a livello globale, anche in Europa. In particolare, la Pseudomonas aeruginosa resistente ai carbapenemi (CRPA) e l’Acinetobacter baumannii resistente ai carbapenemi (CRAB) possono esprimere contemporaneamente diversi meccanismi di resistenza.
Quali sono le strategie di soluzione?
Molte delle sostanze arrivate sul mercato negli ultimi anni sono modifiche di antibiotici già disponibili o combinazioni di β-lattami con inibitori della β-lattamasi. Purtroppo, non esiste una nuova classe di antibiotici, afferma il Prof. Tschudin Sutter. In termini di β-lattamici, cefiderocol – una cefalosporina con un nuovo meccanismo d’azione che è stata approvata dall’Agenzia Europea dei Medicinali (EMA) nel 2020 per il trattamento delle infezioni causate da patogeni Gram-negativi aerobi negli adulti. [9]. Il cefiderocol è strutturalmente una cefalosporina a cui è stata accoppiata una catena laterale con una struttura di catecolo. Le catene laterali della molecola aumentano la stabilità contro le β-lattamasi. Il cosiddetto cefiderocolo sideroforo è caratterizzato dalla capacità di legare il ferro trivalente. I batteri Gram-negativi aerobi hanno bisogno di ferro e hanno un sistema di trasporto attivo di siderofori carichi di ferro per soddisfare le loro esigenze. Il cefiderocol lo utilizza per attraversare la membrana cellulare esterna e poi distruggere la cellula interrompendo la sintesi della parete cellulare [10]. Il cefiderocol ha un’elevata stabilità idrolitica nei confronti di quasi tutte le β-lattamasi, comprese le beta-lattamasi a spettro esteso (ESBL), gli enzimi AmpC e le serina e metallo-carbapenemasi.
Risultati promettenti sono disponibili anche per l’antibiotico orale tebipenem. In uno studio di fase III pubblicato sul New England Journal of Medicine , il tebipenem (orale) è risultato non inferiore all’ertapenem (i.v.) per il trattamento delle infezioni complicate del tratto urinario e ha mostrato un profilo di effetti collaterali comparabile [11].
Sono necessarie anche nuove opzioni terapeutiche in grado di superare la resistenza contro il patogeno Gram-negativo Pseudomonas aeruginosa. I meccanismi più comuni di resistenza agli antibiotici β-lattamici nella P. aeruginosa sono l’aumento dell’espressione delle β-lattamasi intrinseche, l’acquisizione di nuove β-lattamasi, l’aumento dell’efflusso della pompa di efflusso e la perdita o la diminuzione dell’espressione delle porine nella membrana cellulare, che riduce o impedisce l’assorbimento degli antibiotici [12]. Tra l’altro, i pazienti con fibrosi cistica hanno bisogno di antibiotici efficaci contro le infezioni croniche da P. aeruginosa. La levofloxacina per via inalatoria ha mostrato una tendenza a migliorare la funzione polmonare e un intervallo di tempo più lungo per l’esacerbazione in questa popolazione di pazienti rispetto alla tobramicina [13].
Anche la Delafloxacina è un chinolone ed è stata approvata in Svizzera nel 2020 come antibiotico di riserva per il trattamento delle infezioni batteriche acute della pelle e della struttura cutanea (ABSSSI) [14] Gli effetti si basano sull’inibizione della topoisomerasi IV batterica e della girasi del DNA. Il fluorochinolone ha proprietà battericide contro i batteri gram-positivi e gram-negativi ed è efficace anche contro germi problematici come Klebsiella pneumoniae, MRSA, Pseudomonas aeruginosa. La Delafloxacina ha un carattere anionico a pH neutro ed è principalmente in forma non carica a pH leggermente acido, il che rappresenta una differenza rispetto ad altri fluorochinoloni, che sono presenti come cationi a pH acido e principalmente come zwitterioni a valori più alti e la cui attività diminuisce in ambiente acido. [23].
Congresso: medArt
Letteratura:
- Weber R, Chmiel C: Infektiologie – Therapieempfehlungen, Aktualisiert am: 12/2021, www.medix.ch/media/gl_infektiologie_therapieempfehlungen_06.2021_23.6.21_mh_1.pdf, (ultimo accesso 31/08/2022).
- UFSP: Come vengono prescritti oggi gli antibiotici in Svizzera? www.bag.admin.ch/bag/de/home/krankheiten/infektionskrankheiten-bekaempfen/antibiotikaresistenzen/wie-werden-heute-in-der-schweiz-antibiotika-verschrieben.html, (ultimo accesso 31.08.2022)
- Società Svizzera di Infettivologia, www.ssi.guidelines.ch, (ultimo accesso 31.08.2022)
- “Nuovi antibiotici”, Prof. Dr. med. Sarah Tschudin Sutter, medArt 20.-24.06.2022
- BAG: Condizioni quadro nel campo degli antibiotici, www.bag.admin.ch/bag/de/home/strategie-und-politik/nationale-gesundheitsstrategien/strategie-antibiotikaresistenzen-schweiz/rahmenbedingungen-im-bereich-der-antibiotika.html, (ultimo accesso 31.08.2022)
- Tacconelli E, et al: Scoperta, ricerca e sviluppo di nuovi antibiotici: l’elenco prioritario dell’OMS sui batteri resistenti agli antibiotici e sulla tubercolosi. Lancet Infect Dis 2018; 18: 318-327.
- Bush K, Bradford PA: Interazione tra le β-lattamasi e i nuovi inibitori delle β-lattamasi. Nat Rev Microbiol 2019; 17(5): 295-306.
- BAG: Enterobatteri produttori di carbapenemasi (CPE), www.bag.admin.ch/bag/de/home/krankheiten/krankheiten-im-ueberblick/antibiotikaresistente-bakterien.html, (ultimo accesso 31.08.2022)
- Informazioni sui farmaci, www.ema.europa.eu/en/documents/product-information/fetcroja-epar-product-information_de.pdf, (ultimo accesso 31.08.2022)
- Rössler A: “Cefiderocol: nuovo antibiotico per superare la resistenza”, Pharmazeutische Zeitung, 19.01.2021
- Eckburg PB, et al: Tebipenem Pivoxil Idrobromide orale nell’infezione complicata delle vie urinarie. N Engl J Med 2022; 386(14): 1327-1338.
- Poole K: Pseudomonas aeruginosa: resistenza al massimo. Front Microbiol 2011(2): 1-13.
- Elborn JS, et al: Uno studio randomizzato di fase 3, in aperto, per valutare la sicurezza e l’efficacia della soluzione inalatoria di levofloxacina (APT-1026) rispetto alla soluzione inalatoria di tobramicina nei pazienti con fibrosi cistica stabile. J Cyst Fibros 2015; 14(4): 507-514.
- Informazioni sui farmaci, www.swissmedicinfo.ch/default.aspx, (ultimo accesso 31.08.2022)
- ANRESIS, www.anresis.ch/de, (ultimo accesso 31.08.2022)
- Centro europeo per la prevenzione e il controllo delle malattie (ECDC), www.ecdc.europa.eu/en/surveillance-and-disease-data, (ultimo accesso 31.08.2022).
- Strategia Resistenza agli antibiotici Svizzera (StAR), https://www.blv.admin.ch/blv/de/home/das-blv/strategien/nationale-strategie-antibiotikaresistenzen.html, (ultimo accesso 31.08.2022).
- Walsh TR: Un approccio monosanitario alla resistenza antimicrobica. Nat Microbiol. 2018; 3: 854-855.
- Magiorakos AP, et al: Misure e strumenti di prevenzione e controllo delle infezioni per prevenire l’ingresso di pazienti resistenti ai carbapenemi. Antimicrob Resist Infect Control 2017; 6: 113. https://dx.doi.org/10.1186/s13756-017-0259-z.
- Tzouvelekis LS, et al: Carbapenemasi in Klebsiella Pneumoniae e altre Enterobacteriaceae: una crisi in evoluzione di dimensioni globali. Clin Microbiol Rev 2012; 25(4): 682-707. https://dx.doi.org/10.1128/CMR.05035-11.
- Swissnoso, www.swissnoso.ch/fileadmin/swissnoso/Dokumente/5_Forschung_und_Entwicklung/8_Swissnoso_Publikationen/211115_StAR_Teil_II_DE_MDRO-non-outbreak_FINAL.pdf, (ultimo accesso 31.08.2022)
PRATICA GP 2022; 17(9): 20-21