L’insufficienza renale che richiede la dialisi può essere il risultato di una malattia glomerulare riconosciuta troppo tardi e solitamente accompagnata da sintomi e segni non specifici. Lo screening delle patologie renali comprende quindi non solo la misurazione della pressione arteriosa, ma anche la determinazione della creatinina sierica, l’emocromo e l’analisi delle urine da parte del medico di base. In caso di reperti patologici, ulteriori chiarimenti devono essere eseguiti da uno specialista. La terapia della malattia di base comprende sempre un buon controllo della pressione arteriosa e l’evitamento di sostanze nefrotossiche come i FANS e i mezzi di contrasto radiografici.
Se gli elementi filtranti dei reni, i glomeruli, si infiammano, si parla di glomerulonefrite (GN). Causano solo sintomi e segni aspecifici; tuttavia, la localizzazione e la gravità del danno glomerulare sono associate a modelli clinici caratteristici di danno che spesso consentono la diagnosi differenziale della malattia glomerulare sottostante. Una biopsia renale aiuta a chiarire la specifica patologia renale, che a sua volta consente di trarre conclusioni per stabilire se si tratta di una patologia limitata al rene o addirittura di una patologia sistemica. Mentre gli esami e gli interventi specifici per il rene vengono eseguiti dallo specialista, lo screening delle patologie renali è di competenza del medico di famiglia. Il riconoscimento, il trattamento e il follow-up del danno glomerulare seguono alcuni principi generali che possono essere applicati alla maggior parte delle GN.
Modelli clinici di danni nella glomerulonefrite
Vari tipi di cellule e strutture possono essere alterati patologicamente in un glomerulo. Molti di questi cambiamenti possono essere ricondotti a una malattia immunocomplessa. Il danno alla membrana basale e/o ai podociti adiacenti all’esterno spesso porta ad un aumento della permeabilità del filtro glomerulare e alla conseguente proteinuria (PU). Il danno all’endotelio con rottura della parete capillare o proliferazione delle cellule mesangiali è solitamente accompagnato da microematuria. L’infiltrazione da parte delle cellule infiammatorie può portare alla formazione di lesioni necrotiche con formazione di mezzaluna glomerulare associata a una rapida e progressiva GN con insufficienza renale acuta.
L’assunzione di meno di 2 g al giorno è solitamente asintomatica. Una PU grave, superiore a 3 g al giorno, provoca il modello di danno noto come sindrome nefrosica, che, oltre alla PU, è caratterizzata clinicamente dall’edema delle parti dipendenti e laboratoristicamente dall’ipoalbuminemia e dall’iperlipidemia. Questa malattia è spesso accompagnata da ipercoagulabilità, con un aumento del rischio di trombosi delle gambe e delle vene renali con conseguente embolia polmonare. Le cause più comuni di sindrome nefrosica negli adulti sono la nefropatia diabetica, la glomerulosclerosi focale segmentaria (FSGS) e la nefropatia membranosa.
Il modello di danno nella sindrome nefritica è caratterizzato da ematuria, oliguria, ipertensione arteriosa e insufficienza renale. Le malattie che possono essere associate alla sindrome nefritica includono le nefropatie da IgA, la GN infettiva e post-infettiva, le nefriti da lupus e le vasculiti dei piccoli vasi ANCA-positive e negative. La GN associata ad ANCA con crescite o la GN associata alla membrana basale antiglomerulare possono portare a una perdita rapidamente progressiva della funzione renale.
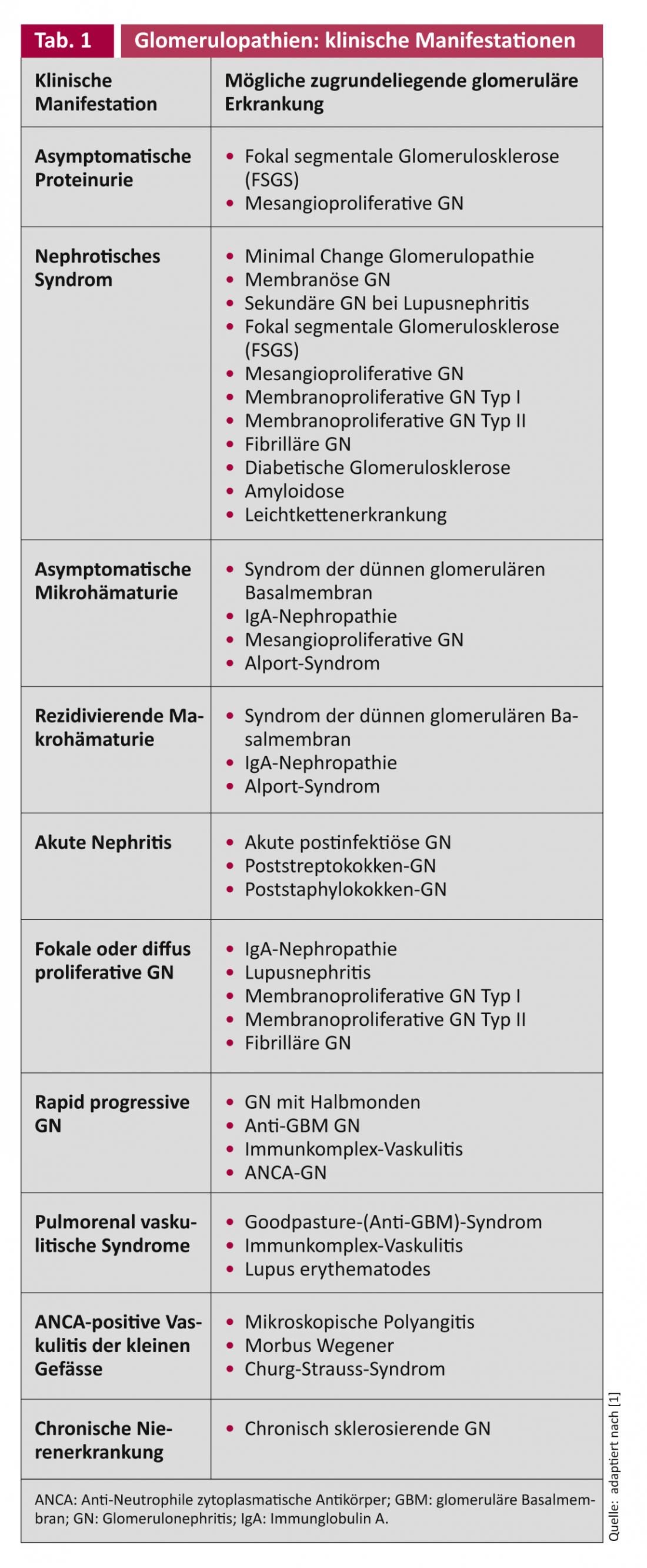
Sebbene la GN presenti caratteristiche di entrambe le sindromi, nefrosica e nefritica, in misura variabile, c’è spesso un modello dominante di danno. Tuttavia, poiché la stessa malattia glomerulare può manifestarsi clinicamente in modi diversi e, d’altra parte, la stessa clinica può essere causata da diverse malattie glomerulari (Tab. 1) , negli adulti spesso solo una biopsia renale porta a chiarire la patologia glomerulare specifica. Se la malattia glomerulare rimane non diagnosticata e quindi non trattata, può evolvere in una GN cronica con glomeruli sclerificati, fibrosi interstiziale e arteriosclerosi renale con insufficienza renale da lieve a pre-dialitica. Quando si valuta la biopsia del rene, è quindi importante sapere se la lesione è attiva e ancora potenzialmente responsiva a una terapia specifica, oppure se il danno è già cronico e quindi irreversibile e non trattabile [1].
Screening delle patologie glomerulari
I pazienti con danno glomerulare di solito si presentano al medico di famiglia con sintomi e segni non specifici, come mal di testa, affaticamento, nausea, respiro corto o gambe gonfie. Oltre all’anamnesi e all’esame fisico, si deve sempre misurare la pressione arteriosa, perché l’ipertensione arteriosa spesso si manifesta come segno clinico precoce della malattia glomerulare. Gli esami di laboratorio aiutano nella diagnosi precoce, nella verifica e nella classificazione approssimativa della malattia renale. A questo scopo, nel siero vengono determinati creatinina, urea, sodio, potassio, calcio, fosfato, acido urico e proteine totali. Inoltre, sono necessari un emocromo e un esame delle urine con stick e, se possibile, una semplice valutazione microscopica del sedimento (“biopsia del piccolo uomo”). Tuttavia, se c’è un sospetto urgente, non si deve ritardare a causa di un risultato di laboratorio non disponibile in tempi brevi, poiché potrebbe essere presente una forma di malattia renale rapidamente progressiva. In questo caso, è importante sottolineare il valore di un esame orientativo mediante stick di urina, che è disponibile immediatamente.
Un marcato aumento della creatinina sierica nell’arco di alcuni giorni o settimane, con una perdita significativa della funzione renale, è caratteristico della GN rapida e progressiva. Dopo che è stato possibile escludere ecograficamente una causa postrenale, si deve sempre cercare tempestivamente un’assistenza nefrologica per eseguire esami e interventi specifici per il rene e quindi preservare o recuperare il più possibile la funzione renale.
Il rilevamento e la quantificazione di una PU sono di grande importanza per il riconoscimento e la valutazione di una GN. In caso di reperti patologici, l’esame delle urine mediante strisce reattive deve essere seguito da una determinazione quantitativa delle proteine e della creatinina in un’urina spot con determinazione del rapporto proteine-creatinina (= proteine totali [g/l]) / creatinina [mmol/l]; Norm: <0,030 g/mmol), che può essere facilmente eseguita in qualsiasi studio medico e non è influenzata dal livello di assunzione di liquidi o dalla quantità di urina. Nel caso di un test su striscia positivo ma di un rilevamento quantitativo non evidente di un PU, una diversa concentrazione di urina potrebbe aver portato a un limite di rilevamento inferiore e dovrebbe essere controllata. Tuttavia, se l’esame delle urine è negativo e si rileva la presenza di proteine nelle proteine totali, si deve considerare l’escrezione di catene leggere monoclonali nelle urine (Bence-Jones-PU). Nei pazienti con diabete mellito, il rilevamento della microalbuminuria nelle urine del mattino (norma: <20 mg/l) è il parametro di screening più sensibile per la presenza di nefropatia diabetica. A volte è difficile distinguere la microalbuminuria come espressione di disfunzione endoteliale che indica un aumento del rischio cardiovascolare dalla malattia glomerulare incipiente. Pertanto, se viene rilevata una microalbuminuria, si devono utilizzare tutti i segni clinici disponibili per fare la diagnosi differenziale.
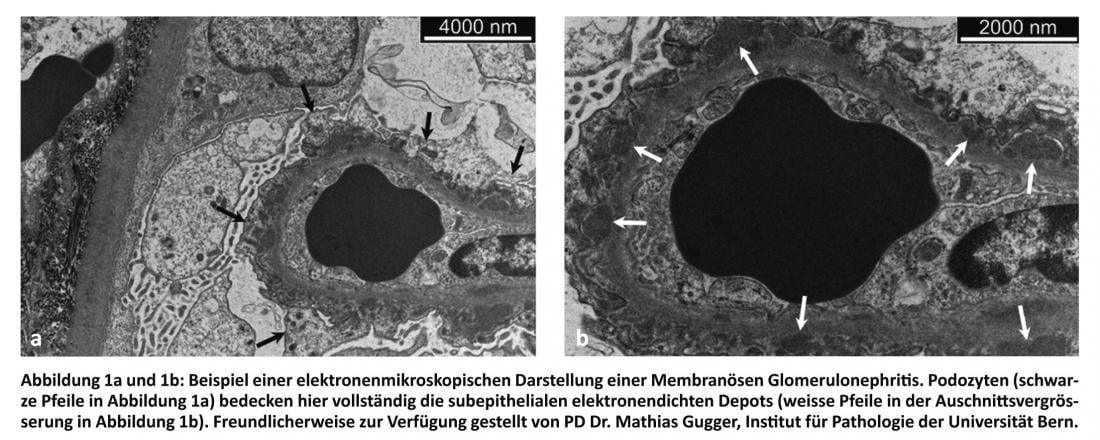
La PU è soggetta a fluttuazioni nel corso della giornata a causa dell’attività fisica e della postura, tra le altre cose. Tuttavia, è stato dimostrato che una misurazione dell’urina spot mattutina di proteine e creatinina è equivalente a una raccolta di 24 ore per la determinazione della PU [2].
L’ematuria asintomatica rilevata per la prima volta senza ulteriori segni di sindrome nefritica o nefrosica richiede inizialmente un controllo. L’ematuria ricorrente asintomatica è causata dalla glomerulopatia solo nel 10% circa dei casi; molto più spesso l’ematuria è dovuta a una patologia postrenale del tratto urinario. Gli eritrociti di origine glomerulare sono probabilmente presenti quando la proporzione di forme dismorfiche nell’esame microscopico delle urine è di un terzo o più. In presenza di eritrocituria glomerulare o per escluderla e in caso di ematuria ricorrente non chiara, è necessario effettuare una cogestione nefrologica, in quanto possono essere presenti anche diverse glomerulopatie non infiammatorie, come la sindrome per lo più benigna della membrana basale glomerulare sottile o la sindrome di Alport, un difetto congenito della catena α del collagene di tipo IV delle membrane basali dell’orecchio interno e del rene. Quest’ultima si manifesta clinicamente nell’infanzia o anche nell’età adulta con micro- o macroematuria e perdita uditiva neurosensoriale bilaterale; la maggior parte delle persone colpite sviluppa una PU nell’intervallo nefrosico e un’insufficienza renale progressiva nel corso del tempo.
Raccomandazioni terapeutiche
Il trattamento può essere assegnato alla terapia differenziale nelle forme GN senza fattori scatenanti secondari identificabili in base all’istologia. La situazione delle forme secondarie è più complessa, poiché in questo caso, da un lato si deve controllare la malattia scatenante e dall’altro, in determinate situazioni, un trattamento antinfiammatorio sufficiente deve controllare il processo infiammatorio secondario per preservare la funzione renale. È sempre importante trattare la malattia di base se è nota e trattabile, come ad esempio un adeguato controllo della glicemia nella nefropatia diabetica da parte del medico di famiglia o il trattamento dell’epatite C nella GN membranoproliferativa da parte dell’epatologo.
Indipendentemente dalla patologia di base, bisogna sempre prestare attenzione anche a un buon controllo della pressione arteriosa, per ridurre al minimo la progressione del danno glomerulare a lungo termine. Sulla base degli studi disponibili, attualmente si può raccomandare una pressione sanguigna target di 120-140/70-90 mmHg. Se i pazienti con malattia glomerulare e senza malattia coronarica possano trarre beneficio da valori target di pressione arteriosa <120/70 mmHg non è attualmente chiaro a causa della scarsità di dati disponibili [3]. È consigliabile lasciare che i pazienti controllino e documentino la loro pressione arteriosa a casa, anche perché in questo modo si omette la componente pratica dell’ipertensione. I valori della pressione arteriosa misurati a casa che rientrano nell’intervallo target devono essere oggettivati mediante una misurazione della pressione arteriosa di 24 ore, in quanto questo è l’unico modo per escludere un calo mancante giorno-notte e un dipping mancante.
Ci sono prove che la riduzione della microalbuminuria e della PU con gli ACE-inibitori può essere utilizzata come marker surrogato di un’ulteriore nefroprotezione. Se gli ACE-inibitori non sono tollerati, in alternativa si possono usare i bloccanti del recettore dell’angiotensina (ARB). La doppia inibizione del sistema renina-angiotensina-aldosterone con gli ACE-inibitori e gli ARB deve essere riservata solo alle PU più gravi e può portare a una perdita accelerata della funzione renale [4]. Lo stesso vale per la combinazione dell’inibitore della renina aliskiren con un ACE inibitore o un ARB, che nei pazienti con diabete o con una funzione renale compromessa con un tasso di filtrazione glomerulare di <60ml/min/1,73 m² è controindicato a causa dell’aumento del rischio di sviluppare ipotensione, sincope, ictus, iperkaliemia e deterioramento della funzione renale, compresa l’insufficienza renale acuta. Per altri gruppi di pazienti, non si possono escludere le conseguenze avverse di una terapia combinata corrispondente.
L’edema nefrosico viene trattato in modo diuretico, ma bisogna prestare attenzione all’aumento del rischio di trombosi. Se l’assunzione di sale è eccessiva o l’edema rimane refrattario al trattamento, si deve procedere alla restrizione del sodio. La “resistenza ai diuretici” può essere superata combinando i diuretici dell’ansa con i diuretici tiazidici, eventualmente anche con lo spironolattone.
In presenza di un’iperlipidemia prolungata, come spesso accade nei pazienti con sindrome nefrosica, si deve prendere in considerazione l’uso di una statina. L’ipoalbuminemia di <25 g/l è considerata un marker surrogato per l’aumento del rischio trombogenico nella PU nefrosica, quindi deve essere istituita l’anticoagulazione. Esistono linee guida nefrologiche, le cosiddette “Linee guida KDIGO”, che dovrebbero essere consultate per l’adeguamento preciso dell’anticoagulazione [5]. La valutazione e l’inizio della terapia nell’iperparatiroidismo secondario dovuto a una funzione renale già significativamente compromessa, nonché nell’anemia renale, devono essere effettuate dal nefrologo.
Conclusione per la pratica
- La sindrome nefrosica è caratterizzata da una grave proteinuria (PU) di >3 g/24 h ed è associata a edema, ipoalbuminemia, iperlipidemia e aumento del rischio tromboembolico.
- La sindrome nefritica è caratterizzata da ematuria, oliguria, ipertensione arteriosa e insufficienza renale e può caratterizzare una GN rapidamente progressiva.
- Il danno glomerulare è accompagnato da sintomi e segni non specifici. Lo screening delle patologie renali da parte dei medici di base comprende quindi sempre una misurazione della pressione arteriosa, oltre a esami della chimica del sangue, dell’emocromo e delle urine.
- Si consiglia di rivolgersi a un nefrologo per valutare l’insufficienza renale, l’ematuria ricorrente, la PU e la sospetta ipertensione renale.
- Se la creatinina sierica aumenta rapidamente come segno di perdita della funzione renale e di esclusione ecografica di una causa postrenale, la funzione renale deve essere mantenuta o recuperata con una diagnosi e una terapia nefrologica tempestive.
- Indipendentemente dalla malattia di base, la terapia di una malattia glomerulare comprende sempre l’adeguamento della pressione arteriosa intorno a 120-140/70-90 mmHg secondo gli studi attuali, nonché l’oggettivazione della pressione arteriosa mediante la misurazione della pressione arteriosa nelle 24 ore.
Nasser Dhayat, MD
Prof. Dr. med. Markus Mohaupt
Letteratura:
- Gruppo di lavoro Malattia renale: miglioramento dei risultati globali (KDIGO) Glomerulonefrite. Linea guida di pratica clinica KDIGO per la glomerulonefrite. Capitolo 2: Principi generali nella gestione della malattia glomerulare. Kidney inter Suppl 2012;2:139-274.
- Price CP, et al: Uso delle misurazioni del rapporto proteine:creatinina su campioni di urina casuali per la previsione di una proteinuria significativa: una revisione sistematica. Clin Chem 2005;51:1577-1586.
- Linee guida attuali per il trattamento dell’ipertensione arteriosa della Deutsche Hochdruckliga e.V. DHL, aggiornamento 2011, ultimo aggiornamento: 16.11.2011. www.hochdruckliga.de/tl_files/content/dhl/downloads/DHL-Leitlinien-2011.pdf
- Volpe M, et al: Inibizione del sistema renina-angiotensina-aldosterone: c’è spazio per il doppio blocco nel continuum cardiorenale? J Hypertens 2012;30:647-54.
- Jenette JC, Falk RJ: Sindromi clinicopatologiche glomerulari. In: Greenberg A (ed.): Primer sulle malattie renali. Filadelfia: Elsevier Saunders, 2009:149.
CARDIOVASC 2012; No. 5; 6-10