Nello studio SEQUENCE, risankizumab è stato confrontato con ustekinumab per il trattamento della malattia di Crohn (CD) nei pazienti che avevano fallito le terapie anti-TNF. Sono stati misurati anche biomarcatori come la calprotectina fecale (FC) e la proteina C-reattiva (CRP) [1]. Oltre agli endpoint clinici ed endoscopici, questi biomarcatori hanno permesso una valutazione oggettiva del decorso della malattia [1].
La CD è estremamente stressante per chi ne è affetto: l’infiammazione sottostante nel tratto gastrointestinale può causare danni intestinali permanenti e compromettere significativamente la qualità della vita [2, 3]. I due inibitori dell’interleuchina (IL)-23 e dell’IL-12/-23, risankizumab (SKYRIZI®) e ustekinumab, tra gli altri, sono autorizzati per il trattamento della CD in Svizzera [4, 5]. Le due opzioni terapeutiche sono state confrontate nello studio comparativo SEQUENCE, pubblicato sul New England Journal of Medicine (NEJM) [1]. Si tratta del primo studio testa a testa sulla CD che dimostra la superiorità di un biologico rispetto a un altro(leggere il riassunto dello studio qui) [1].
[1,6] Un’analisi approfondita mostra ora anche la migliore risposta con risankizumab in diversi sottogruppi e in relazione ai biomarcatori.
Anche Risankizumab è favorevole nell’analisi di sottogruppo
Oltre 500 pazienti con mancata risposta a uno o più inibitori del TNF sono stati randomizzati e trattati open-label per 48 settimane con risankizumab (N=255) o ustekinumab (N=265) [1]. In un confronto testa a testa con ustekinumab, risankizumab è risultato superiore e tutti gli endpoint primari e secondari sono stati raggiunti [1]. Questi includevano endpoint clinici ed endoscopici come la remissione clinica (CDAI* < 150) o la remissione endoscopica alla settimana 48 (SES-CD* ≤ 4 e almeno 2 punti in meno rispetto al basale). Inoltre, i risultati nei sottogruppi predefiniti erano generalmente coerenti con i risultati dell’analisi primaria. Ad esempio, risankizumab ha dimostrato di essere più vantaggioso di ustekinumab in termini di raggiungimento della remissione endoscopica dopo 48 settimane in pazienti con durata, gravità e localizzazione della malattia diverse [1].
Riduzione significativamente maggiore dei biomarcatori con risankizumab [6]
Un possibile limite dello studio SEQUENCE è stato il disegno dello studio open-label, che potrebbe aver influenzato la segnalazione dei sintomi. Tuttavia, oltre agli endpoint endoscopici, che sono stati analizzati centralmente senza conoscere l’assegnazione dei gruppi dei singoli pazienti, l’analisi dei biomarcatori oggettivi come FC e CRP sottolinea anche l’efficacia superiore di risankizumab rispetto a ustekinumab [1]. La FC e la CRP sono i due biomarcatori più comunemente utilizzati nella CD e servono come marcatori oggettivi dell’infiammazione intestinale [7]. La normalizzazione della FC e della CRP è pertanto raccomandata come obiettivo terapeutico a medio termine nelle linee guida STRIDE II [7]. Nello studio SEQUENCE, la FC e la CRP sono state misurate nei pazienti prima dell’inizio del trattamento e alle settimane 8, 24 e 48. Dopo 24 e 48 settimane, il livello di FC nel gruppo risankizumab si è ridotto in media in misura significativamente maggiore rispetto ai pazienti con ustekinumab (Fig. 1) [6]. Risultati simili sono stati ottenuti analizzando i valori di CRP. Già dopo 8 settimane, è stata osservata una riduzione significativamente maggiore dal basale con risankizumab rispetto a ustekinumab (Fig. 1) [6]. Complessivamente, la riduzione della FC e della CRP è correlata ai tassi di remissione clinica ed endoscopica dopo 48 settimane, in cui risankizumab ha mostrato una superiorità rispetto a ustekinumab [1].
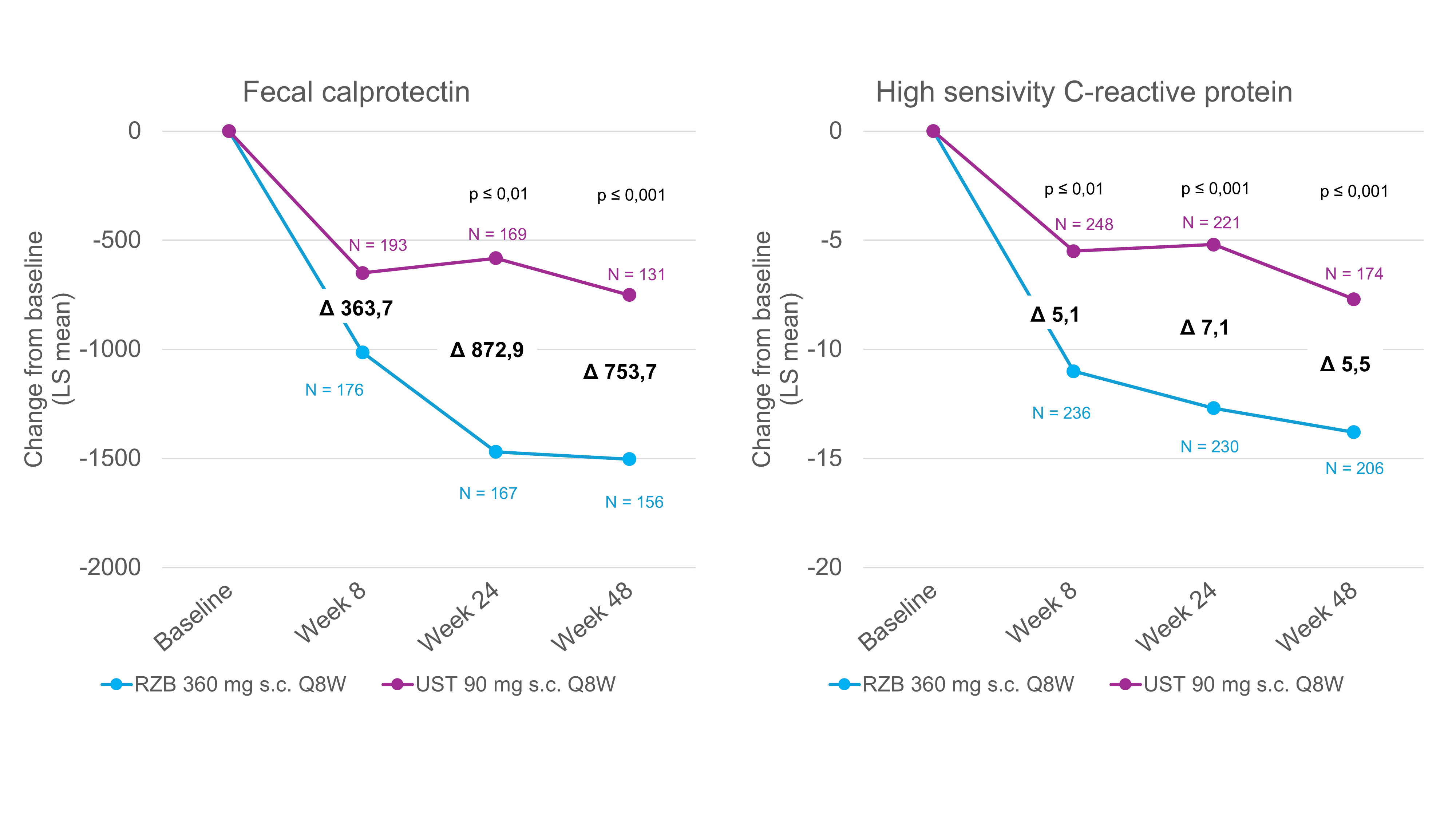
Fig. 1. Risankizumab determina una riduzione significativamente maggiore dei biomarcatori rispetto a ustekinumab. LS = least-squares; Q8W = ogni 8 settimane; RZB = risankizumab; s.c. = sottocutaneo; UST = ustekinumab. Analisi post-hoc, tutti i valori P sono nominali e non controllati per molteplicità. Adattato da [6]
Conclusione
Lo studio SEQUENCE dimostra che risankizumab non solo è clinicamente ed endoscopicamente superiore a ustekinumab nel trattamento della CD, ma consente anche una riduzione più rapida e maggiore dei biomarcatori oggettivi FC e CRP [1]. Il miglioramento dei valori dei biomarcatori sottolinea il potenziale di risankizumab di consentire un controllo sostenuto dell’attività della malattia e di offrire ai pazienti una migliore qualità di vita a lungo termine.
* Abbreviazioni: CDAI = Indice di attività della malattia di Crohn; SES-CD = Punteggio endoscopico semplice per la malattia di Crohn.
Brevi informazioni tecniche SKYRIZI®
Rapporto: Dr sc. Stefanie Jovanovic

Questo articolo è stato realizzato con il sostegno finanziario di AbbVie AG, Alte Steinhauserstrasse 14, Cham.
CH-SKZG-240070 10/2024 Questo articolo è stato pubblicato in tedesco.
Letteratura
1 Peyrin-Biroulet, L., et al, Risankizumab versus ustekinumab per la malattia di Crohn da moderata a grave. N Engl J Med, 2024. 391(3): p. 213-223.
2 Jairath, V. e B.G. Feagan, Onere globale della malattia infiammatoria intestinale. Lancet Gastroenterol Hepatol, 2020. 5(1): p. 2-3.
3 L’onere globale, regionale e nazionale delle malattie infiammatorie intestinali in 195 Paesi e territori, 1990-2017: un’analisi sistematica per il Global Burden of Disease Study 2017. Lancet Gastroenterol Hepatol, 2020. 5(1): p. 17-30.
4. riassunto attuale delle caratteristiche del prodotto di SKYRIZI® (risankizumab) Malattia di Crohn su www.swissmedicinfo.ch.
5. riassunto attuale delle caratteristiche del prodotto di ustekinumab su www.swissmedicinfo.ch.
6 Dubinsky, M., et al. Risankizumab rispetto a Ustekinumab per il raggiungimento della remissione clinica e la riduzione dei biomarcatori infiammatori nei pazienti con malattia di Crohn da moderata a grave: risultati dello studio di fase 3B SEQUENCE. Presentazione orale 763 al DDW 2024; Washington D.C., USA, 19-21 maggio 2024.
7 Turner, D., et al, STRIDE-II: un aggiornamento dell’iniziativa Selecting Therapeutic Targets in Inflammatory Bowel Disease (STRIDE) dell’Organizzazione Internazionale per lo Studio delle IBD (IOIBD): determinare gli obiettivi terapeutici per le strategie Treat-to-Target nelle IBD. Gastroenterologia, 2021. 160(5): p. 1570-1583.
Le referenze possono essere richieste dagli specialisti all’indirizzo medinfo.ch@abbvie.com.