Diroximel fumarato/DRF è un nuovo fumarato orale per i pazienti con sclerosi multipla recidivante-remittente (SMRR), approvato per il rimborso in Svizzera il 1° novembre 2021 e disponibile da allora [3,4]. In un confronto diretto con il dimetil fumarato/DMF, il DRF si è dimostrato significativamente più tollerabile.
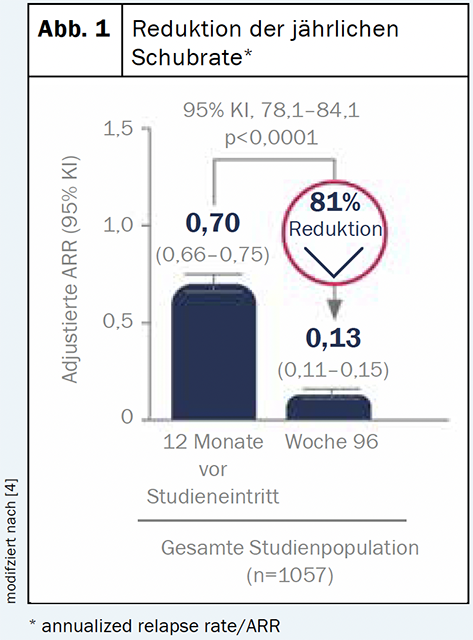
Il diroximelfumarato (Vumerity™) è una sostanza che viene convertita nell’organismo nel metabolita attivo monometil fumarato. Questo corrisponde allo stesso metabolita attivo del dimetil fumarato (Tecfidera®) [4]. È quindi prevedibile che i profili di beneficio e di sicurezza delle due sostanze siano simili [4]. Un’analisi ad interim dello studio di fase III EVOLVEMS-1, attualmente in corso, ha mostrato un profilo beneficio-rischio coerente con i risultati precedenti: Dopo due anni, le misure cliniche e radiologiche erano significativamente ridotte rispetto al basale [2] (Fig. 1). Il basso tasso (<1%) di interruzione del trattamento a causa della gastroenterologia suggerisce anche che la DRF è un’opzione meglio tollerata dal punto di vista gastroenterologico [5].
Miglioramento del profilo di tollerabilità gastrointestinale
Questo è stato confermato nello studio EVOLVE-MS-2 in un confronto diretto [1,2]. L’obiettivo dello studio di fase III in doppio cieco è stato quello di esaminare la tollerabilità gastrointestinale di DRF e DMF per 5 settimane nei pazienti con sclerosi multipla recidivante-remittente. Per questo, 462 mg di DRF o 240 mg di DMF – le due dosi bioequivalenti – sono stati somministrati due volte al giorno a pazienti con sclerosi multipla recidivante-remittente. L’endpoint primario era il numero di giorni con un punteggio d’intensità IGISIS (Individual Gastrointestinal Symptom and Impact Scale) ≥2. Altri endpoint erano la gravità dei sintomi gastrointestinali misurata dalla scala IGISIS/GGISIS (Global Gastrointestinal Symptom and Impact Scale) e la valutazione della sicurezza/tollerabilità. È stata dimostrata una riduzione statisticamente significativa (46%) del numero di giorni con eventi gastrointestinali gravi nei pazienti trattati con DRF rispetto a DMF. Sono stati osservati tassi più bassi di effetti collaterali gastrointestinali (tra cui diarrea, nausea, vomito e dolore addominale) (34,8% contro 49,0%). Ciò ha comportato anche un minor numero di pazienti che hanno interrotto il trattamento a causa di eventi avversi (1,6% vs. 5,6%) e di effetti collaterali gastrointestinali (0,8% vs. 4,8%). Si ritiene che la diversa struttura chimica della DRF provochi una minore irritazione nel tratto gastrointestinale rispetto alla DMF, grazie alla minore produzione di metanolo (un pro-componente irritante per il tratto gastrointestinale) e alla minore reattività con le proteine o i recettori pre-sistemici off-target [1,6].
Malattie da lavaggio in primo piano
Un’analisi post-hoc [7] ha prestato particolare attenzione all’area dei disturbi da vampate di calore. Presentare la frequenza, la gravità e la durata degli eventi avversi legati alle vampate di calore e alle vampate di calore con DRF rispetto a DMF per 5 settimane. Il meccanismo dell’arrossamento indotto dal DMF non è del tutto chiaro, ma potrebbe essere mediato, almeno in parte, dalla prostaglandina D2 (PGD2). Durante lo studio di fase III EVOLVE-MS-2, l’incidenza di vampate di calore è stata inferiore con la DRF rispetto alla DMF (46% contro 55%). Tutte le vampate erano lievi o moderate nella DRF, mentre le vampate gravi si sono verificate in 5 pazienti (2%) nella DMF . Nello studio esaminato, nessun paziente ha interrotto il trattamento con la DRF (Vumerity
TM
), nessun paziente ha interrotto il trattamento a causa delle vampate. Nello studio EVOLVEMS-1 in corso, il tasso di abbandono a causa di arrossamenti è stato <1%. Questo è in contrasto con il 4% dei pazienti trattati con DMF che hanno riportato vampate di calore come interruzione del trattamento negli studi DEFINE/CONFIRM [8–10].
Letteratura:
- Naismith RT, et al: Diroximel Fumarato dimostra un profilo di tollerabilità gastrointestinale migliore rispetto al Dimetil Fumarato nei pazienti con sclerosi multipla recidivante-remittente: risultati dello studio randomizzato, in doppio cieco, di fase III EVOLVEMS-2. Farmaci CNS 2020; 34: 185-196.
- Wundes A, et al: Il miglioramento del profilo gastrointestinale con il diroximel fumarato è associato a un impatto positivo sulla qualità della vita rispetto al dimetil fumarato: risultati dello studio EVOLVE-MS-2, randomizzato, in doppio cieco, di fase III. Ther Adv Neurol Disord 2021; 14: 1-14.
- Piehl F, et al: Terapie modulatrici della malattia e obiettivi di trattamento attuali ed emergenti per la sclerosi multipla, J Intern Med 2021; 289(6): 771 – 791.
- Informazioni tecniche Vumerity™, al momento: agosto 2021. www.swissmedicinfo.ch
- Wray S, et al: Diroximel Fumarato nei pazienti con sclerosi multipla recidivante-remittente: risultati intermedi di sicurezza ed efficacia dallo studio di fase 3 EVOLVE-MS-1. 37° Congresso del Comitato Europeo per il Trattamento e la Ricerca nella Sclerosi Multipla | 13-15 ottobre 2021. Poster: P739.
- Palte MJ, et al. Migliorare la tollerabilità gastrointestinale degli esteri dell’acido fumarico: primi risultati sugli eventi gastrointestinali con il diroximel fumarato nei pazienti con sclerosi multipla recidivante-remittente dallo studio EVOLVE-MS-1 di fase 3, in aperto. Erw Ther 2019; 36(11): 3154-3165.
- Singer BA, et al. Arrossamento ed eventi avversi correlati all’arrossamento con il diroximel fumarato nei pazienti con sclerosi multipla recidivante-remittente: risultati dello studio di fase 3 EVOLVE-MS-2. 37° Congresso del Comitato Europeo per il Trattamento e la Ricerca nella Sclerosi Multipla | 13-15 ottobre 2021. Poster: P673
- Phillips JT, et al: Significato clinico degli eventi gastrointestinali e di arrossamento nei pazienti con sclerosi multipla trattati con dimetil fumarato a rilascio ritardato Int J MS Care. 2015; 17: 236-243.
- Fox RJ, et al: Studio di fase 3 controllato con placebo di BG-12 orale o Glatiramer nella sclerosi multipla. N Engl J Med. 2012; 367: 1087-1097.
- Gold R, et al: Studio di fase 3 controllato con placebo della BG-12 orale per la sclerosi multipla recidivante. N Engl J Med. 2012; 367: 1098-1107.
Impronta
Testo/Editoriale: Leoni Burggraf
Fonte: 37
th
Congresso del Comitato Europeo per il Trattamento e la Ricerca sulla Sclerosi Multipla (ECTRIMS), 13-15.10.2021
Questo articolo è stato scritto con il sostegno finanziario di Biogen Switzerland AG, Baar.
© Prime Public Media AG, Zurigo 2021
Biogen-144226_12.2021
™
Questo medicinale è soggetto a ulteriori osservazioni. Per maggiori informazioni, consulti il foglio illustrativo di Vumerity all’indirizzo
™
su www.swissmedicinfo.ch. Z: Capsule con micropastiglie con rivestimento enterico di 231 mg di diroximel fumarato. I: Trattamento dei pazienti con sclerosi multipla recidivante-remittente (RRMS) per ridurre la frequenza delle ricadute. D: Dose iniziale 231 mg due volte al giorno, poi aumento a 462 mg (somministrati come due capsule da 231 mg) due volte al giorno. Uso orale. Può essere assunto con o senza pasti. Non schiacciare, dividere, succhiare o masticare le capsule. KI: Ipersensibilità al diroximel fumarato, al dimetil fumarato o agli eccipienti. Funzionalità epatica compromessa e funzionalità renale moderatamente o gravemente compromessa. Infezione da virus HI (HIV). Infezioni attive gravi, così come infezioni croniche attive. Gravi disturbi gastrointestinali (GI). Leucopenia < 3,0×10
9
/l, linfopenia < 0,5×109/l. Leucoencefalopatia multifocale progressiva (PML) o sospetta PML. Età < 18 anni. Iniziare il trattamento durante la gravidanza (S). VM: Nessun trattamento concomitante con altri derivati dell’acido fumarico. Sono stati segnalati casi di anafilassi durante il trattamento con dimetil fumarato. Laboratorio: Emocromo con Diff-BB: obbligatorio. prima di iniziare il trattamento, consigliato nei primi 1,5 anni, min. ogni 3 mesi e successivamente almeno ogni 6-12 mesi e quando clinicamente indicato. Nei pazienti con leucopenia < 3,0×10
9
/l o linfopenia < 0,5×10
9
Terapia di pausa /l. Valutazione del rischio-beneficio nei pazienti con conta linfocitaria di ≥ 0,5×10
9
/l e < 0,8×10
9
/l durante > 6 mesi. Il tempo medio di normalizzazione della conta linfocitaria dopo l’interruzione del trattamento con dimetil fumarato nei pazienti senza linfopenia grave prolungata è stimato in 4,7 settimane. Con il dimetil fumarato e altri farmaci contenenti fumarato, i casi di PML si sono verificati soprattutto in pazienti con linfopenia (< 0.91×10
9
/l), si sono verificati casi di PML. Ai primi segni/sintomi di PML, Vumerity deve essere interrotto e devono essere eseguiti esami diagnostici. I pazienti devono informare i loro confidenti o assistenti del trattamento con Vumerity, in quanto potrebbero notare sintomi che non vengono notati dal paziente. Le infezioni gravi da herpes zoster (HZI) possono verificarsi in qualsiasi momento con Vumerity. Se viene confermata la presenza di HZI, devono essere adottate misure appropriate. Funzione renale/epatica: raccomandata prima e 6 mesi dopo l’inizio della terapia, poi ogni 6-12 mesi e in contesti clinici appropriati. Vumerity può causare lesioni epatiche indotte dal farmaco, compreso l’innalzamento degli enzimi epatici (≥ 3x ULN) e l’innalzamento della bilirubina totale (≥ 2x ULN). Usare solo con cautela in caso di insufficienza renale lieve e di comedicazione nefrotossica. In caso di infezioni gravi, consideri la possibilità di interrompere la terapia. Quando si passa dalla terapia modificante la malattia e/o dagli immunosoppressori (IS) a Vumerity, eseguire un follow-up clinico ravvicinato per quanto riguarda le infezioni opportunistiche durante i primi mesi di trattamento. S: Contraccezione obbligatoria in età fertile. Non è raccomandato durante la S; se raccomandato, solo se clinicamente necessario e se il beneficio per la paziente supera il rischio per il feto. Decisione individuale se interrompere l’allattamento o il trattamento con Vumerity. Si devono prendere in considerazione i benefici dell’allattamento al seno per il bambino e i benefici della terapia per la madre. UW: gastroenterite, linfopenia, leucopenia, sensazione di bruciore, vampate di calore, disturbi gastrointestinali (diarrea, nausea, dolore superiore/addominale, vomito, dispepsia, gastrite, disturbi gastrointestinali), prurito, eruzione cutanea, eritema, proteinuria, vampate di calore, chetonuria, elevazione di AST e ALT. IA: Aumento del rischio di infezione con il trattamento concomitante con IS. In caso di pre-trattamento con IS, l’immunocompetenza deve essere ripristinata prima di iniziare la terapia. Nessuna influenza di 325 mg di ASA sul profilo PK. Elenco B. Le informazioni professionali complete sono pubblicate su www.swissmedicinfo.ch. Biogen Switzerland AG, Neuhofstrasse 30, CH-6340 Baar. Stato delle informazioni: agosto 2021. Biogen-129742_09.2021