La diagnosi di IBS si basa sui criteri ROM IV e su un work-up diagnostico limitato. L’asse intestino-cervello è uno dei concetti eziopatogenetici riconosciuti di questa complessa malattia multifattoriale. Le interazioni tra il sistema nervoso autonomo e quello centrale giocano un ruolo importante. Un’attenta diagnosi differenziale è fondamentale. La terapia è individuale e orientata ai sintomi.
Il termine sindrome dell’intestino irritabile (IBS) comprende i disturbi funzionali intestinali non specifici. Si tratta di una malattia multifattoriale complessa, e le relazioni eziologiche e fisiopatologiche non sono ancora del tutto comprese. La diagnosi di IBS si basa sui criteri di Roma IV (panoramica 1) e sulle indagini gastroenterologiche, compresa l’anamnesi psicosociale. L’IBS è il disturbo funzionale più comune del tratto gastrointestinale, con una prevalenza stimata del 7-30% in Europa [1]. A seconda della consistenza delle feci, vengono descritti i seguenti tre sottotipi: IBS di tipo diarrea (IBS-D), IBS di tipo costipazione (IBS-O), IBS di tipo misto (IBS-M). Le persone colpite soffrono di una qualità di vita compromessa e vi sono associati costi economici sanitari diretti e indiretti significativi. La prevalenza dei disturbi depressivi è significativamente più alta rispetto alla popolazione generale [2].
L’asse intestino-cervello come componente dell’eziopatogenesi multifattoriale
Vengono discussi diversi fattori patogenetici per l’IBS e altri disturbi funzionali del tratto gastrointestinale. Tra l’altro, si ritiene che il meccanismo dell’ipersensibilità viscerale, cioè l’aumento della vigilanza su sensazioni specifiche nel tratto gastrointestinale, svolga un ruolo importante [3,4]. Le soglie percettive e del dolore agli stimoli intestinali sono più basse nei pazienti con IBS, il che può contribuire alla sensibilizzazione nervosa centrale [5]. Il tratto digestivo umano è un sistema estremamente sensibile e altamente innervato. Innumerevoli fibre nervose afferenti generano informazioni sul contenuto intestinale e sui processi regolatori della digestione, dell’assorbimento e della difesa immunitaria [6].
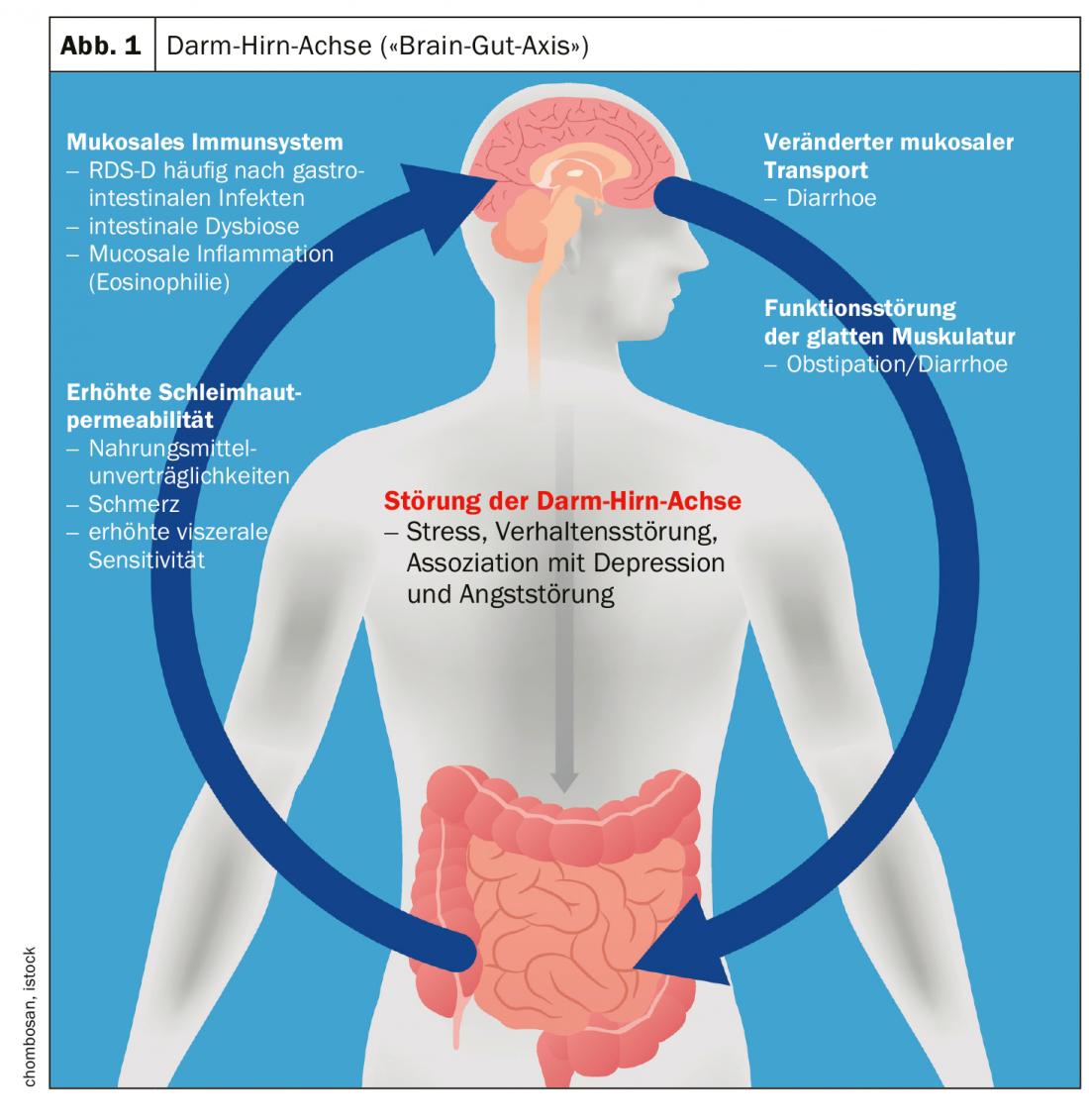
Ci sono prove che nell’IBS sia l’elaborazione centrale di queste informazioni che la risposta ai segnali intestinali sono disturbate [7]. Questi meccanismi avvengono all’interno dell’asse intestino-cervello (“brain-gut axis”), che è un concetto di interazione dei sistemi autonomico, neuroendocrino e neuroimmunologico con il sistema nervoso centrale [8] (Fig. 1) . Questo modello esplicativo include anche fattori psicosociali (ad esempio, l’elaborazione dello stress). Nella prossima versione rivista della linea guida S3 “Sindrome dell’intestino irritabile”, il ruolo del microbioma è discusso in dettaglio nel capitolo sulla fisiopatologia [9]. La complessità della malattia si riflette, tra l’altro, nel fatto che le stesse correlazioni non sono rilevabili in tutte le persone affette. Alcuni cluster di processi associati alla fisiopatologia dell’IBS sono mostrati nella figura 1.
Diagnosi differenziale guidata dai criteri
La diagnosi di IBS è possibile sulla base di test diagnostici limitati e dei criteri di Roma IV [10,11]. Se non sono presenti segni di allarme (box), la diagnosi di IBS può essere fatta se sono soddisfatti i criteri di Roma [12]. Se ci sono segnali di allarme, si raccomanda una diagnostica estesa. L’esclusione di malattie sistemiche rilevanti è particolarmente importante nel primo anno dopo l’insorgenza dei sintomi dell’IBS, anche se la malattia organica si riscontra solo nel 5% di tutti i pazienti con IBS [13]. La probabilità di cancro al colon dopo una presunta diagnosi di IBS è dell’1% dopo i 50 anni, che è significativamente più alta rispetto alla media della popolazione generale. Le linee guida americane raccomandano la colonscopia nei pazienti di età superiore ai 50 anni, quelle europee raccomandano la colonscopia nella RDS-D anche prima dei 50 anni [14,22] .
Nelle donne, il cancro ovarico deve essere sempre preso in considerazione, perché spesso è associato a sintomi simili alla sindrome dell’intestino irritabile [15]. La diagnostica sierologica di esclusione della celiachia, che comprende la determinazione degli anticorpi IgA transglutaminasi e IgA totali, è raccomandata nei pazienti con RDS-D, poiché è stato dimostrato che la prevalenza della carenza di IgA nella celiachia è significativamente più alta (1,7-3%) rispetto alla popolazione generale (0,2%) [16]. La calprotectina deve essere determinata nelle feci per la diagnosi differenziale della malattia infiammatoria intestinale. Se il livello di calprotectina è <40 µg/g, il rischio di malattia infiammatoria intestinale (IBD) è inferiore all’1% [17]. Le nuove aggiunte agli argomenti rilevanti nella nuova versione delle linee guida S3 sono la sensibilità al glutine e l’intolleranza all’istamina. Esistono raccomandazioni negative per i test basati sulle IgG, scientificamente non stabiliti, per le intolleranze alimentari. Le diete di eliminazione inutili e problematiche sono sconsigliate e anche l’analisi della disbiosi nelle feci è sconsigliata [10].
Terapia individuale e orientata ai sintomi
Nella nuova linea guida S3 [9], all’aspetto della nutrizione viene attribuita una maggiore priorità terapeutica. Come possibile misura, si consiglia una dieta a basso contenuto di FODMAP e si raccomandano anche prebiotici e probiotici. Tra le terapie orientate ai sintomi, l’olio di menta piperita e gli antidepressivi triciclici sono raccomandati per il dolore, oltre agli spasmolitici, mentre gli SSRI sono più probabilmente presi in considerazione per i problemi psicologici concomitanti. L’olio di menta piperita è stato discusso per anni come rimedio naturale efficace e ben tollerato dai pazienti con sindrome dell’intestino irritabile. Prove convincenti di efficacia sono state fornite da una meta-analisi di Khanna e colleghi [18]. Cinque studi randomizzati controllati con placebo hanno dimostrato un miglioramento generale dei sintomi dell’intestino irritabile con l’uso di olio di menta piperita. In particolare, il dolore addominale è migliorato in modo significativo. La task force dell’American College of Gastroenterology riconosce l’olio di menta piperita come superiore al solo placebo per la sindrome dell’intestino irritabile [19]. Oltre alla comprovata efficacia a breve termine della terapia, anche la tollerabilità è buona [20]. L’olio di menta piperita interagisce con i canali del calcio nell’intestino, dove impedisce al calcio di fluire nelle cellule muscolari lisce. Si verifica un rilassamento dell’intestino, che porta a una riduzione della motilità e a una concomitante riduzione dei sintomi del dolore [20]. Inoltre, l’olio di menta piperita ha proprietà antinfiammatorie e antibatteriche [20].
Letteratura:
- Saha L: World J Gastroenterol 2014; 20(22): 6759-6773.
- Grundmann O, Yoon SL: J Gastroenterol Hepatol 2010;25: 691-699.
- Madisch A, et al: Dtsch Arztebl Int 2018; 115: 222-232.
- Mari A, et al: Adv Ther 2019; 36(5): 1075-1084.
- Soares RLS: World J Gastroenterol 2014; 20(34): 12144-12160.
- Brookes SJH, et al: Nat Rev Gastroenterol Hepatol 2013; 10(5): 286-296.
- Lee YJ, Park KS: World J Gastroenterol 2014; 20(10): 2456-2469.
- Matricon J, et al: Aliment Pharmacol Ther 2012; 36(11-12): 1009-1031.
- Linea guida DGVS, attualmente in fase di revisione, www.dgvs.de/wissen-kompakt/leitlinien/dgvs-leitlinien/reizdarmsyndrom, ultimo accesso 06.07.2020
- Lacy BE: Gastroenterologia 2016; 150: 1393-1407.
- Lenglinger J: Sindrome dell’intestino irritabile. Johannes Lenglinger, MD. FOMF Basilea, 29.01.2020.
- Whitehead WE, et al: Expert Rev Gastroenterol Hepatol 2017; 11(4): 281-283.
- El-Serag HB, et al: Aliment Pharmacol Ther 2004; 19(8): 861-870.
- AGA: Gastroenerologia 2002; 123(6): 2105-2107.
- Hamilton W, et al: BMJ 2009; 339(7721): 616.
- Burri E, Szabo M: HAUSARZT PRAXIS 2019; 14(1): 11-18.
- Menees SB, et al: Am J Gastroenterol 2015; 110(3): 444-454.
- Khanna R, et al: J Clin Gastroenterol 2014; 48: 505-512.
- Ford AC, et al: Am J Gastroenterol 2014; 109 (1): 2-26.
- Shams EC, et al. JSM Gastroenterol Hepatol 2015; 3(1): 1036.
- Lacy BE, Patel NK: J Clin Med.2017 26 ottobre; 6(11).
- Layer P, et al: Linea guida S3 Sindrome dell’intestino irritabile. Journal of Gastroenterol 2011; 49(2): 237-293.
- Vanner SJ: Gastroenterologia 2016; 150: 1280-1291
PRATICA GP 2020; 15(9): 23-24













