Tracce di gadolinio possono essere rilevate nei tessuti dopo applicazioni multiple con metodi chimici moderni, anche per un periodo di tempo più lungo, ma senza rilevanza clinica o sequele associate. Tuttavia, di recente sono state imposte restrizioni su alcuni preparati di gadolinio all’interno dell’UE.
Introdotti clinicamente nel 1989, i composti di gadolinio come mezzi di contrasto (Gd-KM) hanno presto iniziato una marcia trionfale grazie al potenziale della risonanza magnetica (RM) ma anche grazie alla loro buona tollerabilità, soprattutto rispetto ai mezzi di contrasto della TAC. Molto richiesti all’inizio per abbreviare un po’ i lunghi tempi di esame, i composti di gadolinio sono stati utilizzati sempre più diffusamente e anche in dosi crescenti nella ponderazione del contrasto T1 alla risonanza magnetica. Il gadolinio accorcia e catalizza il tempo di rilassamento T1 dei protoni che ronzano intorno all’atomo nelle immediate vicinanze e quindi aumenta il cosiddetto segnale T1. Ciò consente di individuare e caratterizzare meglio alcune lesioni. Inizialmente utilizzato solo per le domande sul SNC, per facilitare il rilevamento delle patologie, la loro caratterizzazione e il monitoraggio della risposta al trattamento, il campo si è espanso fino a includere domande cliniche praticamente in tutto il corpo [1,2]. Si riteneva che il gadolinio contenente MR KM sarebbe stato escreto rapidamente e completamente dall’organismo.
Indicazioni per l’uso del Gd-KM
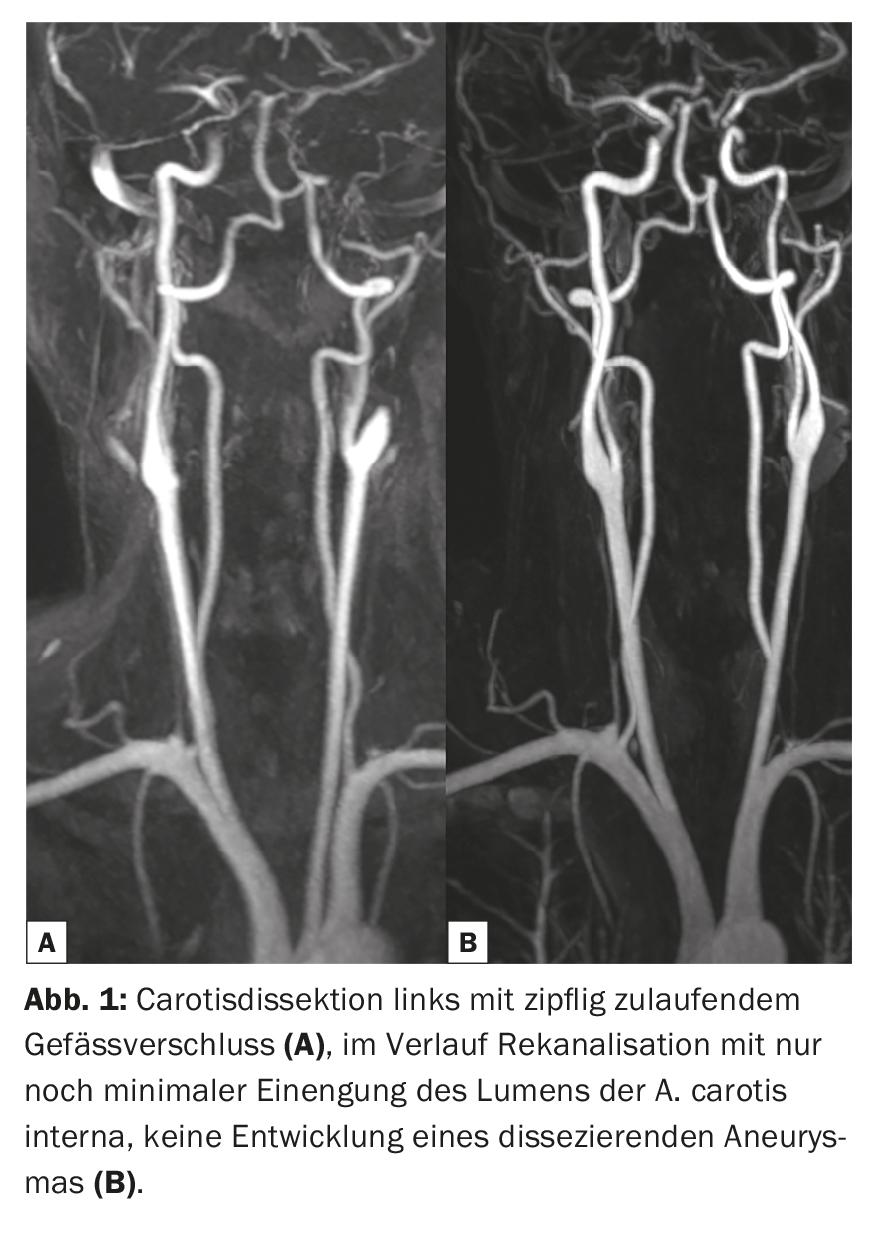
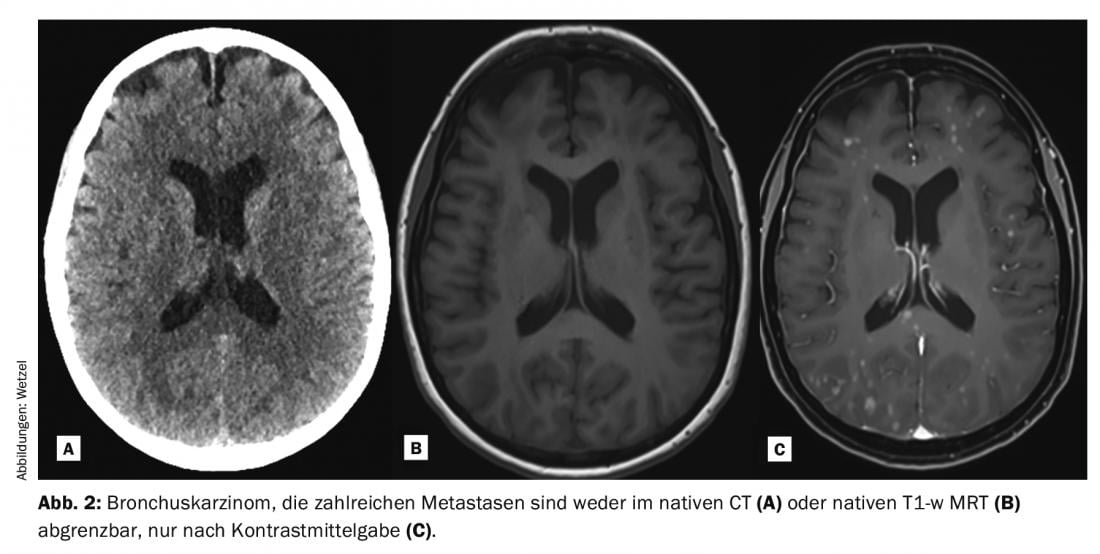
Nella pratica clinica, le sequenze di impulsi amplificati Gd-KM pesati in T1 sono spesso misurati e convertiti in immagini dopo gli esami nativi. A seconda del problema, questo avviene in tutto il corpo, anche se è più probabile che singole patologie si affidino all’uso della Gd-KM rispetto ad altre. Grazie all’aumento del segnale T1 dei protoni (ricco di segnale) nelle lesioni contrastate dopo la Gd-KM, spesso possono essere meglio rilevate e delimitate dal tessuto circostante. Il prerequisito per il cambiamento del segnale è la ponderazione T1, la dose corretta e anche le proprietà cinetiche specifiche, soprattutto nell’area del SNC con il passaggio attraverso la barriera emato-encefalica disturbata. Le indicazioni tipiche per cui la Gd-KM viene somministrata per valutare il parenchima cerebrale sono la diagnosi di malattie tumorali, sclerosi multipla, malattie infiammatorie e patologie vascolari (Fig. 1-3). Nonostante gli enormi progressi tecnici, ci sono numerose patologie e lesioni che ancora oggi possono essere visualizzate solo grazie alla somministrazione di mezzi di contrasto. Pertanto, le Gd-KM sono spesso utilizzate anche semplicemente per escludere la patologia [3]. Un’altra indicazione importante per la Gd-KM è l’imaging classico delle aree del percorso del flusso vascolare, soprattutto l’area arteriosa. L’imaging senza radiazioni di stenosi vascolari, ostruzioni o bypass è stato reso possibile per la prima volta con la risonanza magnetica e la Gd-KM.
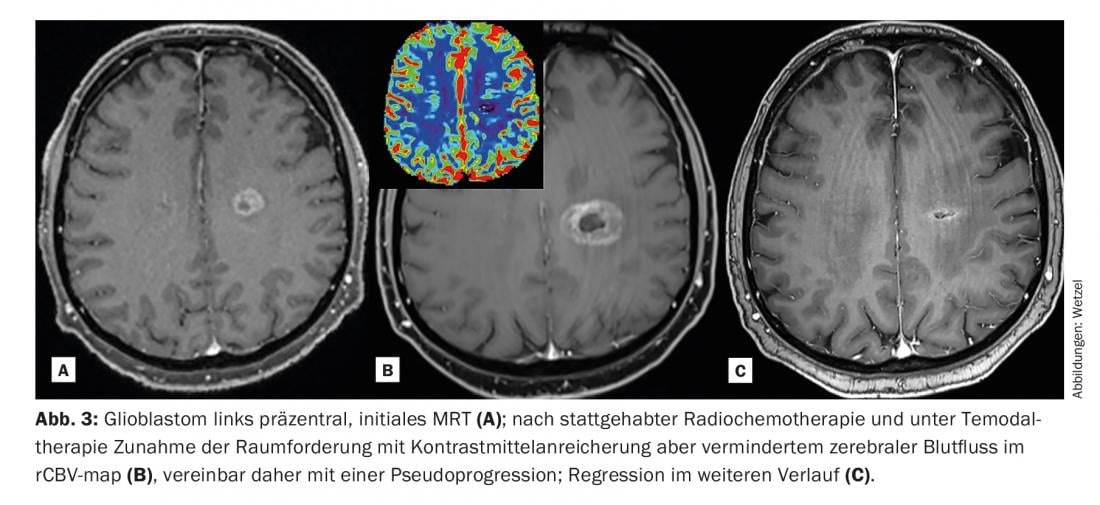
L’analisi della perfusione RM è un’altra area più recente nell’applicazione del KM. Nei tumori, c’è spesso un aumento del contrasto tra il tumore e il tessuto circostante a causa di una maggiore vascolarizzazione, definita neoangiogenesi, e di una perdita vascolare più pronunciata, definita aumento della “permeabilità vascolare” (leakage). L’inondazione del mezzo di contrasto nei focolai tumorali, nelle infiammazioni o nelle infezioni avviene spesso con curve di afflusso e deflusso caratteristiche e spesso rende possibile l’interpretazione di una questione clinica che rimarrebbe poco chiara senza il mezzo di contrasto.
La caratterizzazione della perfusione dei focolai sospetti viene oggi eseguita sempre più spesso utilizzando modelli farmacocinetici. Oltre a migliorare il rilevamento, il contrasto correlato al flusso sanguigno può anche caratterizzare meglio la progressione di un focolaio tumorale e la sua aggressività. I modelli di perfusione tipici possono essere suddivisi in modo molto specifico utilizzando immagini con codice colore di ulteriori punti finali e codificati pixel per pixel in modo specifico per il sito.
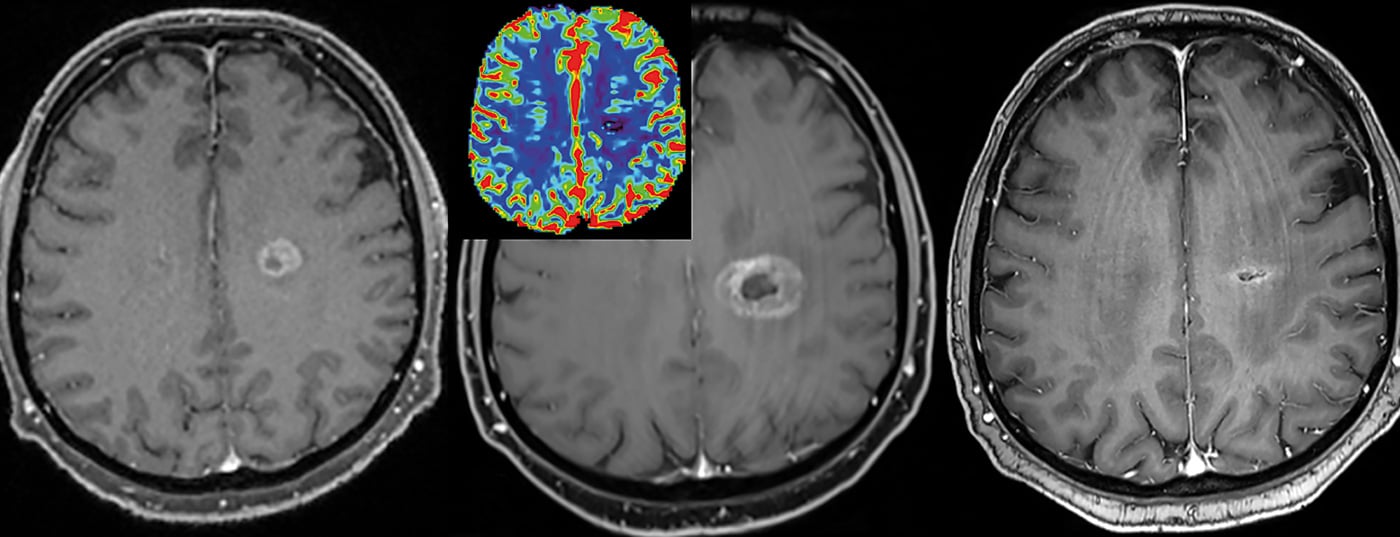
Questo permette di catturare e differenziare meglio l’eterogeneità di un tumore [2]. Questo, a sua volta, ha delle conseguenze per il trattamento successivo e per il monitoraggio della terapia (in particolare anche per la radioterapia). Le lesioni possono quindi essere tracciate relativamente bene nel tempo e, in particolare, caratterizzate e monitorate mediante punti d’angolo quantitativi.
Proprietà del Gd-KM
Il gadolinio viene utilizzato grazie alla sua attività “super-singola”: è l’unico elemento in soluzione che ha sette singoli spin di elettroni (singoli) che interagiscono in modo ideale con i protoni dell’acqua nei tessuti. Le soluzioni di gadolinio presentano quindi una proprietà paramagnetica pronunciata. Lo scambio di energia tra gli elettroni del gadolinio nei suoi gusci di valenza esterni e i protoni eccitati dal segnale MR è ciò che rende possibile l’aumento del contrasto nell’immagine T1. Tempi T1 più brevi portano quindi a un maggior segnale e anche a modelli di contrasto selettivi ovunque si diffonda l’agente di contrasto. Anche se si parla in modo semplicistico di gadolinio come agente di contrasto per la risonanza magnetica, bisogna sottolineare che i complessi di gadolinio sono effettivamente utilizzati clinicamente come agenti di contrasto per la risonanza magnetica (=Gd-KM). Sono costituiti dall’atomo centrale (Gd3+) e dai chelanti o leganti che lo circondano. I chelanti o i leganti legano il gadolinio in modo estremamente stretto, in modo da formare un legame complesso. I principi attivi sono disponibili disciolti sotto forma di soluzioni standardizzate di gadolinio (Gd-KM), che di solito possono essere iniettate i.v. o diluite intraarticolarmente. Rispetto ai mezzi di contrasto CT, hanno una concentrazione inferiore e quindi anche un’esposizione sistemica minore (circa 0,01 mol con Gd-KM contro 0,1 mol con i mezzi di contrasto a raggi X).
I complessi di gadolinio sono altamente idrosolubili, si distribuiscono a livello vascolare e interstiziale con un’emivita di distribuzione di circa due-cinque minuti e, se nefrotropici, vengono escreti per via renale immutati tramite filtrazione glomerulare con un’emivita di eliminazione di circa 90 min. Piccole quantità di Gd-KM superano la barriera placentare o possono essere rilevate anche nel latte materno. Nell’MRKM specifico per il fegato, si verifica una cinetica associata al recettore con assorbimento epatocitario selettivo ed escrezione nei dotti biliari, oltre all’eliminazione renale parallela. La ricettività epatica deriva dai gruppi laterali specifici del recettore anionico che sono stati legati ai ligandi.
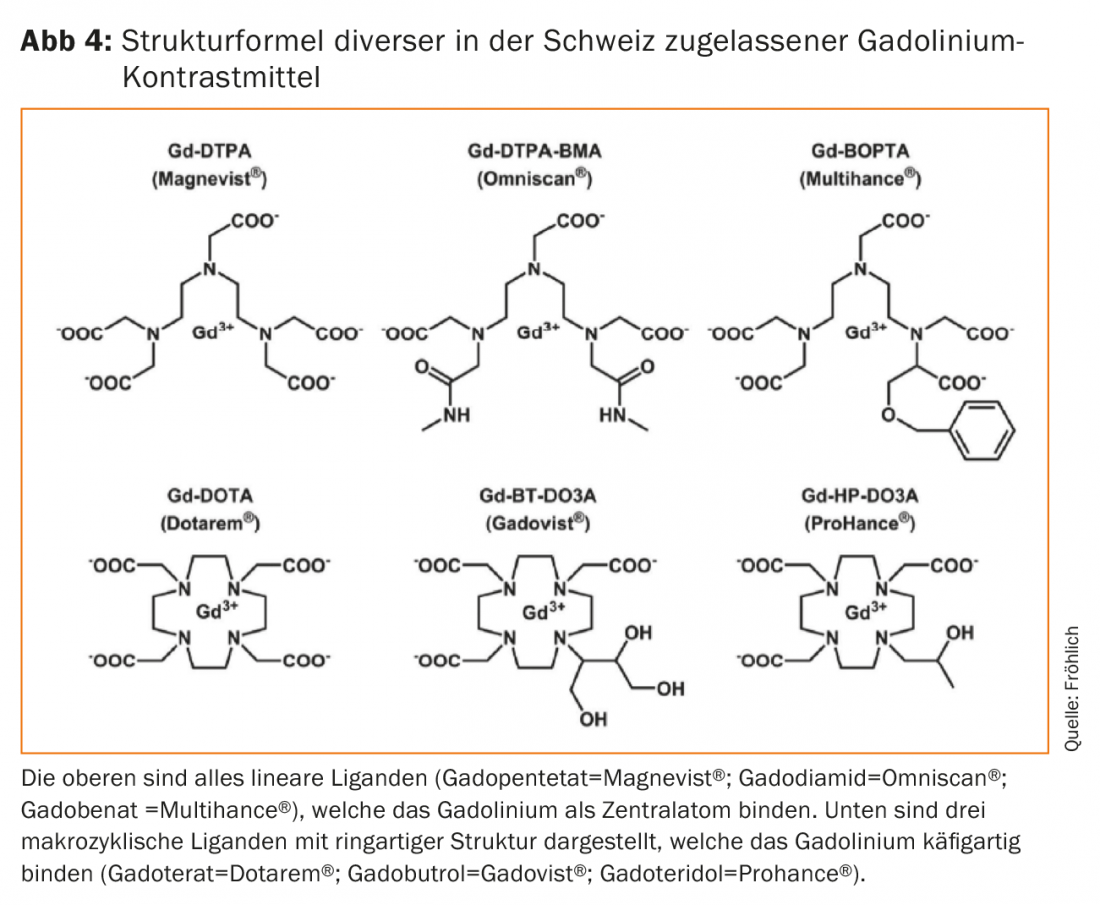
I leganti che legano termodinamicamente il gadolinio sono presenti in una struttura ciclica, ad anello, come i cosiddetti macrocicli, oppure a catena, come leganti lineari (Fig. 4). I macrocicli si dimostrano significativamente più stabili dal punto di vista termodinamico, anche se l’importanza clinica di questa proprietà è stata riconosciuta solo in seguito. Se il gadolinio si dissocia dal legame complesso – cioè si libera dal legame complesso, per così dire – precipita come idrossido o fosfato nel plasma, si accumula nel fegato, nella milza e nei macrofagi e interagisce come bloccante del calcio con numerosi processi metabolici dipendenti dal calcio (coagulazione del sangue, respirazione mitocondriale, turnover osseo). La valutazione degli effetti di tossicità è ulteriormente complicata dalle interazioni con gli elettroliti endogeni come zinco, ferro, rame o persino calcio. Pertanto, l’obiettivo è chiaro: occorre impedire con ogni mezzo il rilascio del gadolinio dal legame del complesso [5].
Fibrosi sistemica nefrogenica [6]
Il gadolinio ha subito una prima battuta d’arresto nel 2006, quando il giovane nefrologo Thomas Grobner della Landesklinikum Wiener Neustadt ha osservato per la prima volta un collegamento tra la somministrazione di gadolinio in cinque dei suoi pazienti in dialisi e il loro significativo peggioramento di una misteriosa malattia della pelle, fino ad allora inspiegabile (dermopatia fibrotica nefrogenica) [7]. La misteriosa malattia è apparsa per la prima volta a grappoli in singole città americane nel 1997 e non è stata pubblicata su “The Lancet” fino al 2000 [8]. Solo tre anni dopo, la malattia è stata ribattezzata “Fibrosi Sistemica Nefrogenica (NSF)” a causa della fibrosi sistemica letale con corrispondente cicatrizzazione interna (attivazione dei fibrociti) in alcuni pazienti [9]. Solo nel 2011 la malattia è stata chiaramente definita e circoscritta, sia dal punto di vista istopatologico che clinico [10]. Sono seguite numerose serie di casi, aumentando costantemente la paura della NSF e le speculazioni sulla sua causa scatenante. Le ipotesi spaziavano da un problema di dialisi (anche se non tutti i pazienti colpiti erano in dialisi) agli agenti infettivi. Anche il registro gestito da Cowper a Yale, con oltre 300 casi, non è riuscito a fornire una spiegazione plausibile per la NSF. Solo Grobner e un po’ più tardi il gruppo di Copenaghen intorno a Henrik Thomsen hanno risolto parzialmente il mistero. A quanto pare, il Gd-KM è circolato negli insufficienti renali fino a quando non si è dissociato nei singoli casi, soprattutto con i composti complessi più instabili, ed è stato rilasciato nel tessuto. In alcuni pazienti, questo ha portato a un’intossicazione simile a un corpo estraneo, molto dolorosa, con una mobilitazione e una proliferazione significativa dei cosiddetti fibrociti tissutali, un aumento delle quantità di procollagene di tipo I quando sono state rilevate cellule CD34 positive, più spesso associate a complicazioni se post-operatorie o con una disposizione infiammatoria [11]. Poco dopo, si sono verificate contratture e compromissioni muscolari significative a livello periferico, ma anche occasionalmente nel tronco del corpo, con ulteriori complicazioni. Nonostante l’uso di diverse terapie, i pazienti potevano essere trattati con successo solo in pochi casi.
Le autorità competenti in materia di farmaci, prima la FDA americana nel giugno 2006 e poco dopo Swissmedic, hanno reagito in modo mirato ed estremamente rapido. Hanno chiesto di considerare attentamente la risonanza magnetica con contrasto nei pazienti con insufficienza renale grave, di utilizzare la dose più bassa possibile e di prestare attenzione ai sintomi clinici di allarme. Successivamente, nel febbraio 2007, l’EMA europea ha seguito le controindicazioni per due agenti di contrasto lineari instabili al gadolinio in caso di insufficienza renale preesistente (eGFR<30ml/min/1,73m2). Le precauzioni definite nel 2007 e successivamente nel 2011 evidenziano esplicitamente i benefici del gadolinio in un esame RM indicato. Per evitare ulteriori casi di NSF, soprattutto i pazienti con una funzione renale limitata e quindi con tempi di circolazione più lunghi sono stati protetti meglio. I mezzi di contrasto lineari, instabili e privi di escrezione epatica non potevano praticamente più essere utilizzati in caso di insufficienza renale, altrimenti le dosi venivano limitate il più possibile e, se necessario, i preparati di gadolinio macrociclico venivano utilizzati solo dopo un’attenta valutazione dei rischi e dei benefici. Queste raccomandazioni si basavano, da un lato, su dati epidemiologici che dimostravano un numero maggiore di casi relativi di NSF con le MRKM lineari gadodiamide, gadoversetamide e gadopentetato, ma anche su numerosi studi preclinici che dimostravano differenze di stabilità e conseguenze. Pertanto, i macrocicli hanno guadagnato lo status di paziente a rischio, soprattutto nei pazienti con nota insufficienza renale preesistente. Il gadoterato, che era stato utilizzato in modo prospettico in diverse centinaia di pazienti che necessitavano di dialisi in Francia senza provocare NSF, era considerato relativamente sicuro.
Depositi di gadolinio nel cervello
Già a partire dal 2010, grazie alle misure in più fasi, alla restrizione della dose, alla maggiore moderazione e al passaggio sempre più frequente all’MRKM macrociclico, non si sono verificati nuovi casi di NSF, per cui è stato tirato un sospiro di sollievo generale. [12] fino alla fine del 2014, quando i ricercatori giapponesi guidati da Tomonori Kanda hanno pubblicato sulla rivista Radiology, questa volta in pazienti con reni, una correlazione tra il numero di esami RM ripetuti con complessi di gadolinio e l’aumento dell’intensità del segnale nell’immagine T1. [13]. Questo ha interessato principalmente il nucleo dentato e il globus pallidus già nelle immagini native, per cui i cambiamenti visibili del segnale sono stati descritti di solito solo dopo cinque o sei esami, come risultato della somministrazione di preparati di gadolinio lineari e piuttosto instabili. In seguito, fenomeni simili sono stati misurati anche in altre strutture del SNC [14]. Poiché modelli di contrasto simili sono stati descritti anche in seguito a varie intossicazioni da metalli, sclerosi multipla o anche dopo radiazioni, è stata messa in dubbio la specificità dell’effetto. Poco più tardi, nel 2015, McDonald ha potuto dimostrare che i segnali aumentati nel nucleo dentato dei suoi pazienti erano effettivamente depositi di gadolinio [15]. Il gadolinio poteva essere rilevato chimicamente e localizzato. Spesso si è verificato nell’area perivascolare, ma a volte anche in aree di tessuto più distali. Va sottolineato che la forma in cui il gadolinio è stato immagazzinato nel tessuto era tutt’altro che chiara. Rimane quindi la domanda se il gadolinio in forma libera dissociata fosse al massimo legato ai fosfati o agli idrossidi o se continuasse a persistere nel tessuto in una forma legata complessa.
Sono seguite numerose serie di casi retrospettivi che, come Kanda, hanno mostrato differenze significative di segnale tra i complessi lineari instabili e i preparati di gadolinio macrociclico, più stabili. Le preparazioni macrocicliche di gadolinio non hanno portato a cambiamenti di segnale misurabili nella maggior parte dei casi (nemmeno dopo un uso ripetuto), mentre quelle più instabili hanno praticamente sempre portato a un aumento di segnale chiaramente misurabile nella risonanza magnetica, a seconda del numero di dosi di Gd-KM somministrate. In realtà, gli studi sugli animali condotti all’inizio degli anni Novanta del secolo scorso avevano già mostrato tali differenze nel lavaggio dei complessi di gadolinio dai vari tessuti, ma si era sempre pensato che ciò fosse di scarsa importanza pratica. I nuovi dati con cambiamenti di segnale visibili apparentemente anche a lungo termine (rispettivamente residui) sono preoccupanti, anche se non è stato possibile assegnare a questi cambiamenti di segnale alcuna malattia o patologia visibile. Quindi, il cambiamento del segnale T1 recentemente rilevato nel tessuto del SNC è molto diverso dall’intossicazione associata al gadolinio nota come NSF. Soprattutto perché gli effetti a lungo termine non sono chiari, alla fine del 2017 l’EMA ha ordinato che la distribuzione di tutti i composti lineari di gadolinio non specifici per il fegato deve essere interrotta in Europa [16]. Fanno eccezione i mezzi di contrasto per l’artrografia MR diretta (gadopentetato; Magnevist® 2.0 con 0,002 mol Gd/Lit) e il gadoterato macrociclico (Artirem® con 0,0025 mol Gd/Lit). Entrambi vengono iniettati direttamente nelle varie articolazioni in dosi e concentrazioni molto basse e vengono utilizzati clinicamente. Allo stesso modo, i Gd-KM lineari, specifici per il fegato, come il gadobenato (Multihance®) o il gadoxetato (Primovist®), rimangono sul mercato. Il gadoterato MR-KM macrociclico (Dotarem®), il gadobutrolo (Gadovist®) o il gadoteridolo (Prohance®) possono continuare ad essere utilizzati a livello diagnostico alla dose più bassa possibile, grazie alla loro complessa stabilità. Il gadolinio, come atomo centrale potenzialmente tossico, può essere intrappolato meglio in termini di entropia e anche cineticamente grazie alla struttura ad anello di questi leganti.
In considerazione dell’incertezza sulla rilevanza clinica delle alterazioni del segnale T1 in varie strutture del SNC, successivamente anche con depositi di gadolinio dimostrabili in altri tessuti (ossa, reni, reticoloendoteliali) [17,18], sono sorte numerose nuove domande intorno al gadolinio. Come fa a passare la barriera emato-encefalica nelle due aree cerebrali sopra menzionate? Viene escreto lentamente di nuovo da lì? Può dissociarsi lentamente ed essere rilasciato? Ci possono essere conseguenze locali simili all’NSF? E i depositi nel resto del tessuto corporeo? Come si comportano i macrocicli rispetto ai KM lineari? Oltre alle osservazioni acute, ci sono anche conseguenze a lungo termine che non possono ancora essere valutate correttamente?
Così, oltre al profilo di tollerabilità acuta dei preparati di gadolinio, che come la maggior parte dei mezzi di contrasto possono portare a reazioni di ipersensibilità (allergiche, simil-allergiche) o, a dosi più elevate, alla nefropatia indotta da KM, le questioni relative alla tollerabilità subcronica e cronica del Gd-KM hanno acquisito importanza. In definitiva, nel caso di tempi di ritenzione più lunghi o di residui anche piccoli, gli esperti non possono escludere completamente un certo rischio di sintomi di intossicazione cronica o tardiva, anche se non ci sono segni di questo, e questo nonostante diverse centinaia di milioni di applicazioni di Gd-KM in totale.
E altro ancora?
Non del tutto inaspettatamente, dato che la risonanza magnetica coinvolge praticamente tutte le patologie, si sono verificate altre reazioni avverse al farmaco (ADR) parzialmente inspiegabili in relazione alla somministrazione di Gd-KM. Non era sempre chiaro se l’esame di risonanza magnetica o il mezzo di contrasto somministrato fossero responsabili dei sintomi osservati. In particolare, i due esperti Semelka (Durham) e Ramalho sono stati i primi a postulare una cosiddetta “malattia da deposito di gadolinio”, che hanno riscontrato in casi rari e senza un chiaro nesso causale nei loro pazienti affetti da MR anche con una funzione renale completamente normale [19]. Le manifestazioni cliniche tipiche includono un’intera gamma di cefalee persistenti non specifiche, dolori ossei o articolari. A volte è accompagnato da proliferazione dei tessuti molli sottocutanei, ispessimento, dolore periferico al braccio e alla gamba, descritto come bruciore o taglio. Questi effetti si sono verificati in parte dopo una sola applicazione di gadolinio e in diversi periodi di tempo (da pochi giorni a mesi) dopo l’esame di risonanza magnetica e non potevano essere attribuiti ad altre patologie. A volte il gadolinio può essere analizzato nel plasma, nell’urina o persino nei campioni di tessuto dei pazienti. È stata discussa una certa disposizione genetica con una maggiore sensibilità. In alternativa, la possibile contaminazione ambientale con tracce di gadolinio anche nelle acque reflue e quindi nella catena alimentare è diventata sempre più il centro dell’interesse con le richieste di un migliore trattamento delle acque reflue intorno agli ospedali o per gli esami di risonanza magnetica. Sebbene siano stati descritti numerosi meccanismi tossici e interazioni del gadolinio con le funzioni endogene, che potrebbero svolgere un ruolo soprattutto nell’ambito della tossicità determinata da citochine e chemiochine, degli effetti dei canali del calcio, dei formatori di radicali reattivi dell’ossigeno o nell’ambito delle MMPS e della neurotossicità, manca una chiara relazione causale.
Le tracce di gadolinio che a volte possono essere ancora rilevate dopo mesi o anni nel tessuto del SNC, ma anche nel resto dell’organismo, con quantità più elevate dopo i complessi Gd lineari, portano a chiedersi come si possa spiegare tale cinetica. Grazie a un’intensa collaborazione di ricerca tra il Dipartimento di Medicina Legale dell’Università di Zurigo e il Dipartimento di Radiologia dell’Ospedale Cantonale di Baden, sono stati uno dei primi gruppi di ricerca a dimostrare clinicamente che il gadolinio iniettato può essere rilevato in piccole quantità anche nel liquido cerebrospinale [20]. In più di 60 pazienti che avevano ricevuto una risonanza magnetica e nei quali era clinicamente indicato un campione di liquor, è stato possibile quantificare il contenuto di gadolinio mediante ICP-MS rispetto a un gruppo di controllo. In modo piuttosto inaspettato, tutti i pazienti esposti al gadoterato hanno mostrato una misurazione positiva corrispondente, con differenze in parte elevate a seconda del paziente e anche della malattia preesistente, per cui i dispositivi analitici utilizzati sono estremamente sensibili. In due pazienti di controllo, che hanno misurato anche la positività al gadolinio nel liquor, è stato successivamente dimostrato un esame di risonanza magnetica precedente con gadolinio. Per circa otto ore dopo l’iniezione, la concentrazione di gadolinio nel liquor aumenta lentamente ma costantemente, seguita da un’eliminazione lenta e prolungata per periodi di tempo molto lunghi. Ciò comporta un valore di picco molto più tardivo e un’eliminazione molto lenta rispetto al plasma. Le misurazioni nel liquor sono state effettuate con il metodo di spettroscopia di massa ICP, molto sensibile e preciso, che tuttavia non consente di differenziare il tipo di legame chimico del gadolinio (se libero o legato a un complesso solido). Le misurazioni del liquor potrebbero essere la chiave per il passaggio del gadolinio anche con una barriera emato-encefalica intatta – questo probabilmente avviene attraverso il plesso coroideo e, nel migliore dei casi, attraverso la circolazione glinfatica – anche se tutto questo è ancora speculativo. A seconda della stabilità dei complessi di gadolinio, si può prevedere un diverso tasso di dissociazione, transmetallazione e scambio con altri elettroliti, ioni metallici e anche fosfati/idrossidi nel liquor.
Restano aperte molte domande sull’eliminazione e la ridistribuzione da questi compartimenti distali, possibilmente in alcune aree cerebrali; deve essere chiarito in quale forma il gadolinio rimane alla fine, se viene ridistribuito e se viene lentamente escreto di nuovo attraverso gli spazi perivascolari, se esistono. In linea di principio, va sottolineato che nemmeno gli esperti sono d’accordo sul significato delle osservazioni di cui sopra. In particolare, rimane aperto il significato di numerosi effetti subtossici delle varie forme di gadolinio (a seconda della forma di legame e della dose) con conseguenze precliniche o anche cliniche. Così, sono state descritte l’induzione di necrosi e apoptosi nelle cellule del tubulo renale, l’aumento della citotossicità o altre reazioni nefrotossiche, ematotossiche, neurotossiche o infiammatorie [21]. Mentre le autorità europee hanno categoricamente bandito dal mercato i preparati di gadolinio lineare, più instabili, le autorità sanitarie americane sono generalmente più caute, raccomandando l’uso dei preparati di Gd macrociclici, più stabili, nei casi di uso ripetuto o anche in pediatria, ma certamente consentendo anche l’uso clinico continuato dei complessi lineari più instabili. Questo con l’indicazione che finora non si conoscono effetti avversi in relazione ai depositi di gadolinio, non si possono rilevare cambiamenti istopatologici e ci sono ancora numerose domande aperte sulla cinetica. L’Agenzia svizzera per i medicinali Swissmedic non ha ancora preso una posizione chiara.
Come spesso accade nella medicina moderna, ci siamo lasciati trasportare un po’ acriticamente dal puro entusiasmo per la nuova tecnica di imaging a bassa radiazione con un contrasto pronunciato dei tessuti molli e Gd-KM ottimamente tollerato. Ora è necessario utilizzare i mezzi di contrasto contenenti gadolinio in modo clinico ben indicato e sensato. Quando si utilizzano i complessi macrociclici di gadolinio più stabili o i singoli inserti di MRKM specifici per il fegato, attualmente non vi è alcuna indicazione di una malattia secondaria associata, nonostante le tracce e i possibili aumenti del segnale T1 in vari tessuti, anche per periodi di tempo più lunghi. Da un lato, è importante non fraintendere il possibile aumento del segnale dopo la somministrazione sequenziale di diverse dosi di gadolinio sulle immagini native, e dall’altro confrontare il potenziale beneficio della somministrazione di gadolinio con il rischio estremamente basso. I pazienti devono essere informati dell’utilità prevalente della somministrazione di contrasto con gadolinio quando è clinicamente indicato e per escludere la patologia.
Messaggi da portare a casa
- Il Gd-KM viene utilizzato soprattutto per via endovenosa, con una dose di 0,1 mmol Gd/kg di peso corporeo. Applicazioni speciali come gli esami del fegato o l’angiografia vascolare richiedono dosi inferiori. Nell’artrografia a risonanza magnetica diretta, dove il Gd-KM viene iniettato intra-articolare, sono necessarie dosi molto basse di Gd-KM.
- Il Gd-KM deve essere utilizzato alla dose più bassa possibile. In caso di somministrazione ripetuta e di rischi corrispondenti, ogni somministrazione deve essere attentamente ponderata e si deve utilizzare il Gd-KM macrociclico più stabile. Nei pazienti con insufficienza renale con un eGFR <30 ml/min/1.73 m2 , può essere somministrata al massimo una dose singola di Gd-KM (=0,1 mmol/kg di peso corporeo) nell’arco di sette giorni.
- Tracce di gadolinio possono essere rilevate nei tessuti dopo applicazioni multiple con metodi chimici moderni (ICP-MS), anche per un periodo di tempo più lungo, ma senza rilevanza clinica o sequele associate.
- Le proprietà specifiche dei singoli preparati di gadolinio devono essere prese in considerazione nella pratica clinica.
Letteratura:
- Czeyda-Pommersheim F, Martin DR, Costello JR, Kalb B: Agenti di contrasto per la risonanza magnetica. Magn Reson Imaging Clin N Am 2017; 25: 705-711.
- Yuan Jm Chow SK, Yeung DK, King AD: Un metodo di mappatura a cinque colori per l’analisi DCE-MRI dei tumori della testa e del collo. Radiologia clinica 2012; 67: 216-223.
- Roberts TP, Mikulis D: Neuro RM: principi. JMRI 2007; 26: 823-837.
- Durmo F, et al: Caratterizzazione del tumore cerebrale mediante valutazione multibiometrica della risonanza magnetica. Tomoy 2018; 4: 14-25.
- Port M, et al: Efficienza, stabilità termodinamica e cinetica dei chelati di gadolinio in commercio e le loro possibili conseguenze cliniche: una revisione critica. Biometals 2008; 21: 469-490.
- Matoori S, Gutzeit A, Fröhlich JM: Fibrosi sistemica nefrogenica nel 2015. Switzerland Med Forum 2015; 15: 340-344.
- Grobner T: Gadolinio – un fattore scatenante specifico per lo sviluppo della dermopatia fibrosante nefrogenica e della fibrosi sistemica nefrogenica? Nephrol Dial Transplant 2006; 21: 1104-1108.
- Cowper SE, et al: Malattie cutanee simili allo scleromixoedema nei pazienti in dialisi renale. Lancet 2000; 356: 1000-1001.
- Cowper SE: Dermopatia fibrosa nefrogenica: i primi 6 anni. Curr Opin Rheumatol 2003; 15: 785-790.
- Girardi M, et al: Fibrosi sistemica nefrogenica: definizione clinicopatologica e raccomandazioni di workup. J Am Acad Dermatol 2011; 65: 1095-1106.
- Grebe S, et al.: Infiammazione cronica e aterosclerosi accelerata come cofattori importanti nella fibrosi sistemica nefrogenica in seguito all’esposizione al gadolinio per via endovenosa. Clin Exp Nephrol 2008; 12: 403-406.
- Bennett Cl, et al: Fibrosi sistemica nefrogenica indotta da gadolinio: ascesa e declino di una malattia iatrogena. Clin Kidney J 2012; 5: 82-88.
- Kanda T, et al: Alta intensità di segnale nel Nucleo Dentato e nel Globus Pallidus nelle immagini di risonanza magnetica non potenziate con peso T1: relazione con l’aumento della dose cumulativa di un materiale di contrasto a base di gadolinio. Radiologia 2014; 270(3): 834-841.
- Pozeg P, et al.: Modello spazio-temporale dell’aumento dell’iperintensità legata al gadolinio nei nuclei cerebrali profondi. Congresso svizzero di radiologia, Losanna 10-12 maggio 2018; SS149.
- McDonald RJ, et al: Deposito intracranico di gadolinio dopo la risonanza magnetica con contrasto. Radiologia 2015; 275: 772-782.
- Agenzia Europea dei Medicinali EMA. L’opinione finale dell’EMA conferma le restrizioni sull’uso degli agenti di gadolinio lineare nelle scansioni corporee. www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/referrals/Gadolinium-containing_contrast_agents/human_referral_prac_000056.jsp (visitato il 22.5.2018).
- Murata N, Murata K, Gonzalez-Cuyar LF, Maravilla MR: Deposito tissutale di gadolinio nel cervello e nell’osso. Magn Reson Imaging 2016; 34: 1359-1365.
- McDonald RJ, et al: Confronto delle concentrazioni di gadolinio all’interno di più organi di ratto dopo la somministrazione endovenosa di chelati di gadolinio lineari rispetto a quelli macrociclici. Radiologia 2017; 285: 536-545.
- Ramalho M, Ramalho J, Burke LM, Semelka RC: Ritenzione e tossicità del gadolinio – un aggiornamento. Adv Chronic Kidney Dis 2017; 24: 138-146.
- Berger F, et al.: Distribuzione del gadolinio nel liquido cerebrospinale dopo la somministrazione di un agente di contrasto MR a base di gadolinio nell’uomo. Radiologia 2018; https://doi.org/10.1148/radiol.2018171829.
- Rogosnitzky M, Branch S: Tossicità dei mezzi di contrasto a base di Gd: una revisione dei meccanismi noti e proposti. Biometals 2016; 29: 365-376.
InFo NEUROLOGIA & PSICHIATRIA 2018; 16(4): 23-29.